Statistical Genetics Wiki
Spis treści
| Coarctatio aortae | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|

Koarktacja aorty, zwężenie cieśni aorty (łac. coarctatio aortae, ang. aortic coarctation, CoAo) – wrodzona, niesinicza wada serca, polegająca na zwężeniu aorty między odejściem lewej tętnicy podobojczykowej i więzadłem tętniczym, lub przetrwałym przewodem tętniczym. Czasami towarzyszy mu niedorozwój łuku aorty (hypoplazja). W rzadkich przypadkach zwężenie może dotyczyć innych odcinków aorty. Wada ta występuje szczególnie często u osób chorych z zespołem Turnera[1].


W typie nadprzewodowym (tzw. postać niemowlęca, B) zwężenie występuje na długim odcinku i ma miejsce pomiędzy odejściem lewej tętnicy podobojczykowej a ujściem przewodu tętniczego. Umożliwia to, w przypadku utrzymania jego drożności, występowanie przecieku prawo-lewego i zaopatrywanie dolnej części ciała z prawej komory (krew nieutlenowana) – stąd, w przypadku współwystępowania tych dwóch wad może dojść do sinicy w obrębie tego obszaru. Występuje u 5% dziewczynek z zespołem Turnera[2][3].
W typie podprzewodowym lub w koarktacji na wysokości przewodu tętniczego (tzw. typ dorosłych, A i C) zwężenie ma postać pierścienia. Ukrwienie dolnej części ciała ulega z czasem zwiększeniu dzięki rozwojowi krążenia obocznego.

Epidemiologia
Wada stanowi około 3/5% wszystkich wad wrodzonych serca, występuje 2–3 razy częściej u chłopców. Wada występuje często w skojarzeniu z innymi anomaliami, jak np. ubytek międzykomorowy, czy z innymi wadami rozwojowymi naczyń[4]. W 85% przypadków towarzyszy jej dwupłatkowa zastawka aortalna. Szczególnie często dotyczy kobiet z zespołem Turnera (35% pacjentów z koarktacją aorty)[5].
Krążenie oboczne
Wysokie ciśnienie powyżej zwężenia powoduje powstanie krążenia obocznego. Krew z tętnicy piersiowej wewnętrznej (odgałęzienie tętnicy podobojczykowej) płynie do tętnic międzyżebrowych przednich, następnie za pośrednictwem tętnic międzyżebrowych tylnych do aorty zstępującej. Krążenie oboczne prowadzi do powstania ubytków w dolnych krawędziach żeber (tzw. uzury).
Objawy i przebieg
Stan chorego zależy od stopnia zwężenia i wieku. U noworodków wada może być początkowo bezobjawowa. W ciągu pierwszej doby, wraz z czynnościowym zamknięciem się przewodu Botalla, pojawiają się objawy niewydolności krążenia[6]:
- duszność
- tachykardia
- powiększenie wątroby
- osłabienie tętna na kończynach dolnych
- niższe ciśnienie skurczowe na kończynach.
Objawy przedmiotowe
- miękki, ciągły szmer krążenia obocznego w okolicy międzyłopatkowej
- szmer wyrzutu nad aortą (niestale)
- szmery wtórne do wad zastawki aortalnej
- akcentacja drugiego tonu serca (o ile występuje nadciśnienie)
- nadciśnienie tętnicze w pomiarze na kończynach górnych
- w badaniu radiologicznym:
- powiększenie sylwetki serca u noworodków i niemowląt
- poszerzenie aorty wstępującej
- ubytki kostne na dolnych krawędziach żeber obustronnie w typie podprzewodowym
- ubytki kostne na dolnych krawędziach żeber prawostronnie w typie nadprzewodowym
- w EKG: cechy przerostu lewej komory
Powikłania
- zastoinowa niewydolność krążenia
- zawał mięśnia sercowego
- zapalenie wsierdzia
- krwawienie śródczaszkowe i udar mózgu
- tętniak aorty
- nadciśnienie tętnicze
- niedomykalność aortalna
- tętniaki tętnic międzyżebrowych i innych naczyń tętniczych.
Leczenie
Przed urodzeniem
W przypadku rozpoznania zwężenia cieśni aorty u dziecka przed urodzeniem stosuje się technikę podawania ciężarnej 45% mieszaniny tlenu do oddychania. W czasie trzech posiedzeń, trwających trzy do czterech godzin, ciężarna oddycha przez maskę 45% tlenem. Krew z podwyższonym wysyceniem w tlen, dochodzi do płodu przez łożysko i powoduje zwiększenie przepływu krwi przez płuca przez poszerzenie łożyska naczyń płucnych. Zwiększona ilość krwi po osiągnięciu lewego serca przepływa do łuku aorty. Leczenie to zalecane jest od 34. tygodnia ciąży. Prowadzone jest przez trzy do czterech tygodni i powoduje istotne poszerzenie światła hypoplastycznego łuku aorty[7].
W niektórych przypadkach działanie tlenoterapii było neutralizowane lub osłabiane przez obecność ubytków w przegrodzie międzykomorowej oraz niemożności napełniania lub opróżniania komór serca, ale może ułatwić leczenie poporodowe i poprawić rokowanie w odpowiednich przypadkach[8].
Po urodzeniu
Oba typy wymagają troskliwej kontroli i leczenia operacyjnego, które polega na usunięciu zwężenia. Nieleczony typ nadprzewodowy może prowadzić do 60–90% śmiertelności w okresie niemowlęcym z powodu niewydolności krążenia i dlatego dzieci z tym rozpoznaniem operowane są w pierwszych tygodniach lub miesiącach życia. Typ podprzewodowy leczy się operacyjnie najczęściej w 3–4 r.ż. Leczenie w późniejszym okresie może skutkować utrwalonym nadciśnieniem i/lub wcześniejszą miażdżycą w dotkniętym nadciśnieniem obszarze tętniczym[9]. Duże badanie, opublikowane w 1970 roku o przebiegu naturalnym koarktacji aorty, wykazało, że średni wiek przeżycia chorych nie operowanych wynosi 34 lata, przy średnim przeżyciu populacji w tamtym okresie 71 lat[10].
Krytyczna koarktacja aorty – w przypadku ciasnego zwężenia aorty objawy niewydolności krążenia występują już w pierwszych godzinach po urodzeniu. Wymaga ona poprawy i stabilizacji stanu pacjenta:
- zabezpieczenie wydolności oddechowej – intubacja i oddech wspomagany, lub kontrolowany
- wlew dożylny z prostaglandyny E1 celem utrzymania drożności przewodu tętniczego
- wyrównanie kwasicy
- wspomaganie lekami inotropowymi w celu zmniejszenia stopnia niewydolności krążenia (pochodne naparstnicy np. digoksyna i leki moczopędne)
Po ustabilizowaniu stanu chorego podejmuje się decyzję co do dalszego postępowania – leczenie interwencyjne, czy operacyjne.
Techniki operacyjne:
- wycięcie zwężenia i zespolenie sposobem koniec do końca – zastosowana po raz pierwszy przez szwedzkiego chirurga Clarence Crafoorda w 1944 roku (w Polsce Leon Manteuffel w 1957 r.) – zaletą jest brak zastosowania obcego materiału. Uważana jest za metodę z wyboru, dającą najlepsze wyniki, jeżeli jest możliwa do zastosowania[11].
- wycięcie zwężenia i wszycie protezy naczyniowej – w przypadkach długiego odcinka zwężenia
- plastyka zwężonego odcinka cieśni aorty z wykorzystaniem łaty ze sztucznego tworzywa – zastosowana w 1957 roku przez niemieckiego chirurga Vossschulte. Zaletą metody jest stosunkowo krótki czas zakleszczenia aorty (zamknięcia), wadą – pozostawienie na tylnej ścianie zwężenia niepełnowartościowej tkanki, z której w przyszłości może powstać tętniak.
- poszerzenie zwężonego odcinka łatą z własnej lewej tętnicy podobojczykowej- stosowana czasami u niemowląt. Może wystąpić niedorozwój kończyny górnej lewej
- zespolenie omijające zwężenie z użyciem protezy naczyniowej (bypass – ominięcie zwężenia) – zaletą jest brak konieczności zakleszczania aorty i rozległego preparowania zwężonego odcinka. Zalecana u osób starszych ze słabo rozwiniętym krążeniem obocznym i w przypadkach nawrotu zwężenia (rekoarktacji)[12].
Angioplastyka, polegająca na poszerzeniu nieprawidłowego odcinka, czyli tak zwanej angioplastyce balonowej z implantacją stentu lub bez, ze względu na powikłania i częsty nawrót stenozy jest obecnie stosowane tylko w przypadku zwężenia pooperacyjnego. Poprzez te zabiegi zarówno górna jak i dolna część organizmu otrzymuje wystarczającą ilość krwi.
Galeria
Rekoarktacja po zespoleniu koniec-do-końca u 4-miesięcynego dziecka leczona przezskórna angioplastyką balonową:
-
Rekoarktacja po zespoleniu koniec-do-końca u 4-miesięcynego dziecka
-
Rekoarktacja po zespoleniu koniec-do-końca u 4-miesięcynego dziecka - angioplastyka balonowa
-
Rekoarktacja po zespoleniu koniec-do-końca u 4-miesięcynego dziecka - stan po angioplastyce balonowej
Powikłania pooperacyjne
- pooperacyjne, paradoksalne nadciśnienie tętnicze – występuje u ok. 30% chorych po usunięciu koarktacji aorty, częstsze u chorych operowanych powyżej 5. r.ż.[9]
- objawy bólów brzucha mogące imitować niedrożność jelit
- uszkodzenie nerwu krtaniowego wstecznego lewego i/lub nerwu przeponowego lewego
- uszkodzenie przewodu piersiowego
- uszkodzenie niedokrwienne rdzenia kręgowego z paraplegią i spastycznym niedowładem kończyn
Śmiertelność okołooperacyjna i szpitalna w izolowanej koarktacji jest niewielka i bliska zeru. Wzrasta znacznie w tzw. zespole koarktacji, czyli w zwężeniu aorty współistniejącym z ubytkiem w przegrodzie międzykomorowej, drożnym przewodem tętniczym i przede wszystkim przy współistniejących złożonych wadach serca np. z zespołem Fallota. Z powodu częstych wad towarzyszących np. dwupłatkowa zastawka aortalna, możliwości nawrotu zwężenia, czy wytworzenie się tętniaka pacjenci po leczeniu koarktacji aorty do końca życia wymagają okresowej kontroli kardiologicznej[9].
Sport i obciążenie
Jeżeli w układzie naczyniowym nie obserwuje się restenozy, znacznego poszerzenia aorty wstępującej, tętniaka w obszarze cieśni aorty, ani nadciśnienia tętniczego pacjent nie ma ograniczeń ruchowych i obciążeń fizycznych. Należy unikać obciążeń statycznych o dużej intensywności[1].
Galeria
-
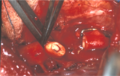
Obraz śródoperacyjny wypreparowanej koarktacji aorty z tętniakowato zmienionymi tętnicami międzyżebrowymi
-
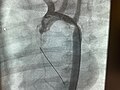
Schemat koarktacji aorty z zaznaczeniem wycięcia zwężenia
-
Obraz śródoperacyjny koarktacji aorty po wycięciu miejsca zwężenia
-
Koarktacja aorty - zespolenie koniec-do-końca
-
Koarktacja aorty przy użyciu różnych technik obrazowania. A. Zwężenie aorty w okolicy cieśni (strzałka). B. Obraz 3D z tomografii komputerowej z kontrastem ukazujący niewielkie zwężenie w okolicy metalowego stentu (strzałka), po poszerzeniu koarktacji - angioplastyka balonowa. C. Obraz w 3D z MRT z kontrastem ukazujący koarktację z bypassem (strzałka) omijającym koarktację. D. Obraz ukazujący duży tętniak rzekomy (grot strzałki) po uprzedniej plastyce z wszyciem łaty[13]
Przypisy
- ↑ a b Nikolaus A. Haas, Carsten Rickers, Rainer Kozlik- Feldmann, Robert Cesnjevar. Leitlinie Pädiatrische Kardiologie: Aortenisthmusstenose (2018).. www.awmf.org. [dostęp 2022-02-06].
- ↑ Völkl TM., Degenhardt K., Koch A., Simm D., Dörr HG., Singer H. Cardiovascular anomalies in children and young adults with Ullrich-Turner syndrome the Erlangen experience.. „Clinical cardiology”. 2 (28), s. 88–92, luty 2005. PMID: 15757080.
- ↑ Vinay Kumar, Abul K. Abbas, Nelson Fausto, Stanley L. Robbins, Ramzi S. Cotran: Robbins and Cotran pathologic basis of disease. Philadelphia, Pa.: Elsevier Saunders, 2005. ISBN 0-8089-2302-1.
- ↑ Kuroczyński W., Sadowski J, Moll J, Dobek J, Dyrkacz E.: Zwężenie cieśni aorty współistniejące z agenezją żyły głównej dolnej. Pol Przegl Chir (1981), 53, 9, 821-823
- ↑ Sípek A, Gregor V, Sípek A Jr, Hudáková J, Horácek J, Klaschka J, Skibová J, Langhammer P, Petrzílková L, Klímová B, Perinová B, Wiesnerová J. Incidence of congenital heart defects in the Czech Republic--current data. Ceska Gynekol 2010;75(3):221-42.. pubmed.ncbi.nlm.nih.gov. [dostęp 2022-02-06].
- ↑ Pees C, Haas NA, Lange PE. The clinical diagnosis of aortic isthmus stenosis. Dtsch Med Wochenschr 1991;24:1329-34.. www.thieme-connect.com. [dostęp 2022-02-06].
- ↑ T. Kohl, K. Tchatcheva, R. Stressig, A. Geipel, S. Heitzer, U. Gembruch: Maternal hyperoxygenation in late gestation promotes rapid increase of cardiac dimensions in fetuses with hypoplastic left hearts with intrinsically normal or slightly abnormal aortic and mitral valves.Ultraschall in Med., 2008, 29, S. 92
- ↑ Kohl T. Chronic intermittent materno-fetal hyperoxygenation in late gestation may improve on hypoplastic cardiovascular structures associated with cardiac malformations in human fetuses. Pediatr Cardiol 2010;31:250-63.. pubmed.ncbi.nlm.nih.gov. [dostęp 2022-02-06].
- ↑ a b c Kuroczynski W, Hartert M, Pruefer D, Pitzer-Hartert K, Heinemann M, Vahl CF. Surgical treatment of aortic coarctation in adults: Beneficial effect on arterial hypertension. Cardiol J. 2008;15: 537-542;. www.semanticscholar.org. [dostęp 2022-02-06].
- ↑ Campbell M.: Natural history of coarctation of the aorta. Br Heart J 1970; 32: 633–40
- ↑ Crafoord C, Nylin G: Congenital coarctation of the aorta and its surgical treatement. J Thorac Surg (1945), 14:347–361
- ↑ Jacob T, Cobanoglu A, Starr A:Late results of ascending aorta - decending aorta bypass graft for recurrent coarctation of the aorta. J Thorac Cardiovasc Surg (1988) 95:782–787
- ↑ Hopewell N, Hughes Marina L, Taylor Andrew M. The Role of Cardiovascular Magnetic Resonance in Pediatric Congenital Heart Disease, Journal of Cardiovascular Magnetic Resonance, 2011, 13, 51.(Koarktacja aorty. A. Ukośny rzut strzałkowy przedstawiający dyskretną, ciasną koarktację w miejscu cieśni aorty (strzałka). B. Angiogram TK 3D ze wzmocnieniem kontrastowym, pokazujący lekko zwężony stent z gołego metalu (strzałka), który częściowo pokrywa początek lewej tętnicy podobojczykowej. Grot strzałki przedstawia subtelny pseudo-tętniak na dystalnym końcu stentu. C. Angiogram 3D ze wzmocnieniem kontrastowym, obrazujący hipoplazję łuku aorty i koarktację z przeszczepem by-passu „omijającego” z tyłu (strzałka). D. angiogram MR 3D ze wzmocnieniem kontrastowym, pokazujący duży pseudo-tętniak (grot strzałki) po wcześniejszej operacji plastycznej angioplastyki. Prawdziwe światło jest pokazane z tyłu (strzałka)
Bibliografia
- Zbigniew Religa (red.): Zarys kardiochirurgii. Warszawa: Wydawnictwo Lekarskie PZWL, 1993, s. 86-93. ISBN 83-200-1732-7.
- Krystyna Kubicka, Wanda Kawalec, Ewa Bernatowska: Pediatria. Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 319-320. ISBN 83-200-3001-3.
- Andrzej Szczeklik (red.): Choroby wewnętrzne. T. I. Kraków: Medycyna Praktyczna, 2005, s. 267-8. ISBN 83-7430-031-0.
Linki zewnętrzne
- Sandy Shah. Aortic Coarctation eMedicine