LIMSwiki
Eusi
| |||||||||||||||||||||||||
| Umum | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
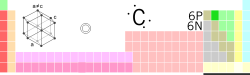
| Ngaran, Lambang, Wilangan | Karbon, C, 6 | ||||||||||||||||||||||||
| Dérét kimia | Nonlogam | ||||||||||||||||||||||||
| Golongan, Periode, Blok | 14 (IVA), 2, p | ||||||||||||||||||||||||
| Dénsiti, Kateuasan | 2267 kg/m3, 0.5 (grafit) 10.0 (inten) | ||||||||||||||||||||||||
| Panémbong | hideung (grafit) tanpawarna (inten) 
| ||||||||||||||||||||||||
| Sipat atom | |||||||||||||||||||||||||
| Beurat atom | 12.0107 amu | ||||||||||||||||||||||||
| Radius atom (calc.) | 70 (67) pm | ||||||||||||||||||||||||
| Radius kovalén | 77 pm | ||||||||||||||||||||||||
| Radius van der Waals | 170 pm | ||||||||||||||||||||||||
| konfigurasi éléktron | [He]2s22p2 | ||||||||||||||||||||||||
| e- per tingkat énergi | 2, 4 | ||||||||||||||||||||||||
| Wilangan oxidasi (Oxida) | 4, 2 (mildly acidic) | ||||||||||||||||||||||||
| Struktur kristal | Héxagonal | ||||||||||||||||||||||||
| Sipat fisik | |||||||||||||||||||||||||
| Wujud zat | padet (diamagnetik) | ||||||||||||||||||||||||
| Titik lééh | 3773 K (6332 °F) | ||||||||||||||||||||||||
| Titik golak | 5100 K (8721 °F) | ||||||||||||||||||||||||
| Volume molar | 5.29 ×10−6 m3/mol | ||||||||||||||||||||||||
| Panas panguapan | 355.8 kJ/mol (sublim) | ||||||||||||||||||||||||
| Panas fusi | N/A (sublim) | ||||||||||||||||||||||||
| Tekenan uap | 0 Pa | ||||||||||||||||||||||||
| Speed of sound | 18350 m/s | ||||||||||||||||||||||||
| Rupa-rupa | |||||||||||||||||||||||||
| Éléktronégativiti | 2.55 (Skala Pauling) | ||||||||||||||||||||||||
| Kapasitas panas spésifik | 710 J/(kg*K) | ||||||||||||||||||||||||
| Konduktiviti listrik | 0.061 × 106/(m·ohm) | ||||||||||||||||||||||||
| Konduktiviti panas | 129 W/(m*K) | ||||||||||||||||||||||||
| Poténsi ionisasi ka-1 | 1086.5 kJ/mol | ||||||||||||||||||||||||
| Poténsi ionisasi ka-2 | 2352.6 kJ/mol | ||||||||||||||||||||||||
| Poténsi ionisasi ka-3 | 4620.5 kJ/mol | ||||||||||||||||||||||||
| Poténsi ionisasi ka-4 | 6222.7 kJ/mol | ||||||||||||||||||||||||
| Poténsi ionisasi ka-5 | 37831 kJ/mol | ||||||||||||||||||||||||
| Poténsi ionisasi ka-6 | 47277.0 kJ/mol | ||||||||||||||||||||||||
| Isotop pangstabilna | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Unit SI & STP dipaké iwal mun ditandakeun lain. | |||||||||||||||||||||||||
Karbon mangrupa unsur kimia nu dina tabel periodik dilambangan C sarta nomer atom 6. Unsur karbon tétravalén mibanda sababaraha bentuk alotrop:
- inten (mineral pangteuasna). Struktur beungkeutan: 4 éléktron na orbital-sp3 3-diménsi
- grafit (salah sahiji zat panglemesna). Struktur beungkeutan: 3 éléktron na orbital-sp2 2-diménsi jeung 1 éléktron na orbital-s.
- Orbital sp1 nu kabeungkeut kovalén mangrupa hiji-hijina interés kimia.
Fullerit (fullerin) nyaéta molekul dina skala-nanométer. Dina bentuk nu basajan, 60 atom karbon ngabentuk lapisan grafit nu ngagulung jadi hiji struktur 3-dimensi nu sarupa jeung bal maénbal.
Karbon aya dina sadaya bahan organik sarta mangrupa dasar pikeun kimia organik. Nonlogam ieu ogé mibanda sipat kimia nu ahéng ku bisana kabeungkeut ku atom karbon jeung rupa-rupa unsur séjénna, ngabentuk ampir 10 juta sanyawa nu geus kanyahoan. Nalika ngahiji jeung oksigén, karbon jadi karbondioksida nu kacida pentingna pikeun tutuwuhan. Nalika ngahiji jeung hidrogén, karbon jadi rupa-rupa sanyawa nu disebut hidrokarbon nu penting pikeun industri dina bentuk minyak bumi (Ing. fossil fuel). Nalika ngahiji jeung oxigén lan hidrogén, karbon bisa jadi rupa-rupa golongan sanyawa kayaning asam lemak, nu penting pikeun mahluk hirup, jeung éster, nu méré rasa kana bungbuahan. Isotop karbon-14 ilahar dipaké pikeun pananggalan radioaktif.
Ciri penting
Karbon téh unsur nu penting jeung onjoy pisan. Bentukna nu béda-béda di antarana nyaéta salaku zat panglemesna (grafit) jeung pangteuasna (inten). Lian ti éta, karbon mibanda afinitas nu kacida gedéna pikeun ngabentuk beungkeut jeung atom leutik lianna, kaasup atom karbon séjén, katambah ku ukuranana nu leutik nu bisa ngabentuk sababaraha beungkeut. Ku ayana pasipatan ieu, karbon geus kanyahoan bisa ngabentuk ampir sapuluh juta sanyawa nu béda. Sanyawaan karbon jadi dasar sakabéh kahirupan di Marcapada, sedengkeun daur karbon-nitrogén nyadiakeun sabagian énergi nu dihasilkeun ku panonpoé jeung béntang lianna.
Aplikasi
Karbon mangrupa komponén penting dina unggal sistim mahluk hirup, tanpa karbon mah hirup téh moal aya (baca chauvinisme karbon). Ajén ékonomi utama tina karbon nyaéta dina bentuk hidrokarbon, utamana suluh fosil gas métan jeung minyak bumi. Minyak bumi dipaké ku industri pétrokimia pikeun ngahasilkeun, di antarana, béngsin, minyak tanah jeung solar, maké prosés distilasi. Minyak bumi ngahasilkeun rupa-rupa bahan atah pikeun zat-zat sintétik, di antarana plastik nu jadi béntang di jaman kiwari.
Mangpaat séjén
- Isotop 14C, kapanggih 27 Pébruari 1940, dipaké dina pananggalan radiokarbon.
- Sababaraha detéktor haseup ngagunakeun sajumlah ménél isotop radioaktif karbon salaku sumber radiasi pangionan (lolobana mah detéktor haseup téh maké isotop Amerisium)
- Grafit dicampurkeun jeung clays to form the 'léad' used in pencils.
- Inten dipaké pikeun hiasan, mata bor, jeung larapan séjén nu ngamangpaatkeun kateuasanana.
- Karbon ditambahkeun kana beusi pikeun ngahasilkeun waja.
- Karbon dipaké pikeun control rod dina réaktor nuklir.
- Tipung karbon grafit, bentuk asakna dipaké salaku areng pikeun masak, karya seni jeung nu lianna.
- Pél areng dipaké natambaan nu karacunan (nyerep racun/toksin tina patuangan).
- Nyerep bau ti cai sebagai media filter cai, éta téh disebatna sifat adsorpsi karbon aktif.
- Manfaat karbon aktif dalam pemurnian gas nyaeta menyaring VOC (Volatile Organic Compounds) atawa senyawa nu mudah menguap. Aya nu disebar faktor kualitas karbon aktif, misalna nomor iodin.
- Fungsi karbon aktif filter air pikeun nyerap zat kimia organik
Sipat fisik jeung kimiawi fulerin, dina bentuk nanotabung karbon, mibanda poténsi nu ngajangjikeun pikeun widang nanotéhnologi.
Sajarah
Karbon (tina basa Latin carbo nu hartina "areng", charcoal) kapendakna sarta geus dipikawanoh ti jaman prasajarah kénéh, dijieun ku jalan ngaduruk bahan organik dina kaayaan kurang oksigén (nyieun areng). Inten geus ti baheula dipikawanoh salaku barang nu jarang sarta éndah. Alotrop karbon nu pangahirna nu kapanggih, fulerin, kapanggih salaku hasil gigir (byproduct) percobaan molecular beam taun 1980-an.
Alotrop
Opat alotrop karbon nu dipikanyaho di antarana: amorf, grafit, inten, jeung fulerin. Bentuk nu kalima diumumkeun 22 Maret 2004.
Dina bentuk amorfna, karbon mah biasana grafit bubuk nu sok aya dina areng jeung méméhong songsong, lain dina makrostruktur kristalin.
Dina tekenan normal, karbon bentukna grafit, nu unggal atomna kabeungkeut ku tilu atom lianna dina hiji widang datar, kawas dina hidrokarbon aromatik. Dua bentuk grafit, alfa (héksagonal) jeung béta (rombohédral), duanana mibanda pasipatan fisik nu sarua, iwal struktur kristalna. Grafit alam ngandung nepi ka 30% bentuk béta, padahal nu sintétik mah ngan ngandung bentuk alfa. Bentuk alfa bisa dirobah jadi béta ku cara mékanis, sedengkeun bentuk béta bisa dibalikkeun ka bentuk alfa ku jalan dipanaskeun luhureun 1000°C.
Alatan delokalisasi awan pi, grafit bisa nyalurkeun listrik (konduktor). Bahanna lemes, lambaranana (biasana dipisahkeun ku atom séjén) napel ukur ku ayana gaya van der Waals, antukna gampang pisan leupas.
Dina tekenan nu luhur pisan, karbon mibanda alotrop nu disebut inten, nu unggal atomna ngabeungkeut opat atom lianna. Struktur kubik inten sarua jeung silikon jeung germanium, tina kuatna beungkeut karbon-karbon.
Occurrence
There are néarly ten million carbon compounds that are known to science and many thousands of these are vital to life processes and very economically important organic-based réactions. This element is abundant in the sun, stars, comets, and in the atmospheres of most planets. Some meteorites contain microscopic diamonds that were formed when the solar system was still a protoplanetary disk. In combination with other elements, carbon is found the éarth's atmosphere and dissolved in all bodies of water. With smaller amounts of calcium, magnesium, and iron, it is a major component of very large masses carbonate rock (limestone, dolomite, marble etc.). When combined with hydrogen, carbon form coal, petroleum, and natural gas which are called hydrocarbons.
Graphite is found in large quantities in New York and Texas, the United States; Russia; Mexico; Greenland and India.
Natural diamonds occur in the mineral kimberlite found in ancient volcanic "necks," or "pipes". Most diamond deposits are in Africa, notably in South Africa, Namibia, Botswana, the Republic of the Congo and Sierra Leone. There are also deposits in Canada, the Russian Arctic, Brazil and in Northern and Western Australia.
Sanyawa anorganik
(Baca ogé kimia organik)
Oksida karbon nu penting nyéta karbon dioxida, CO2, nu mangrupa salah sahiji komponén minor atmosfir Marcapada, dihasilkeun sarta dipigunakeun ku mahluk hirup, nu mibanda sipat volatil (gampang nguap). Na cai, oksida karbon ieu ngabentuk sajumlah renik asam karbonat, H2CO3, tapi teu stabil sabab boga beungkeut oksigén-karbon rangkep. Tina antara ieu, lajeng dihasilkeun ion karbonat nu kastabilkeun ku résonansi. Sababaraha mineral nu penting di antarana karbonat, utamana kalsit.
Ranté karbon
It´s the atomic structure of hydrocarbons in which a series of carbon atoms, saturated by hydrogen atoms, form a chain. Volatile oils have shorter chains. Fats have longer chain lengths, and waxes have extremely long chains.
Daur karbon
Prosés ngagabungkeun jeung ngaleupaskeun karbon jeung oksigén nu terus-terusan téh dina raraga ngahasilkeun atawa nendeun énérgi; katabolisme + anabolisme = métabolisme (baca daur karbon).
Isotop
Taun 1961 IUPAC (International Union of Pure and Applied Chemistry) ngajadikeun isotop karbon-12 pikeun dasar beurat atom.
- Karbon-14 nyaéta radioisotop nu waktu satengahna 5715 taun sarta geus loba dipaké pikeun pananggalan radiokarbon (radiocarbon dating) kai, situs arkéologis, jeung spésimén.
Karbon boga dua isotop stabi alami: C-12 (98.89%) jeung C-13 (1.11%). Nisbah isotop ieu dilaporkeun sacara rélatif kana baku VPDB (Vienna Pee Dee Belemnite, ti Formasi Peedee di Carolina Kidul).
Kawaspadaan
Sanyawaan karbon mibanda rupa-rupa peta toxik. Karbon monoxida (CO), nu aya dina haseup durukan mesin, sarta sianida (CN-), nu mindeng kapanggih dina polusi patambangan, toxik pisan pikeun mamalia. Sanyawaan karbon séjénna teu toxik sarta malah penting pisan pikeun hirup. Gas organik kayaning éténa (CH2=CH2), étuna (HCCH), jeung métana (CH4) pibahyaeun alatan gampang ngabeledug sarta kaduruk nalika dicampurkeun jeung hawa.
Tumbu kaluar
- Los Alamos National Laboratory – Carbon Archived 2008-09-13 di Wayback Machine
- [1][2]
- WebElements.com – Carbon
- EnvironmentalChemistry.com – Carbon
- It's Elemental – Carbon
- – Carbon Fullerene and other Allotropes Archived 2006-08-25 di Wayback Machine modéls by Vincent Herr