LIMSwiki
Contenidos
| Itrio ← Circonio → Niobio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Circonio, Zr, 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período | 4, 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 91,224 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Kr] 4d2 5s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 10, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Blanco grisáceo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,33 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 206 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 148 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 4 (anfótero) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 640,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1270 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 2218 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 3313 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 7752 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª energía de ionización | 9500 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 6501 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 2128 K (1855 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 4644 K (4371 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 58,2 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 16,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 0,00168 Pa a 2125 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 0,27 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 2,36·106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 22,7 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 3800 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del circonio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El circonio o zirconio[1] es un elemento químico de número atómico 40 y peso atómico 91.224. Situado en el grupo 4 de la tabla periódica de los elementos. Su símbolo es Zr. El nombre de circonio se toma del mineral circón, la fuente más importante de circonio, y que deriva de la palabra persa "zargun - زرگون", que significa "dorado".[2]
Es un metal de transición brillante, de color blanco grisáceo, duro, resistente a la corrosión, de apariencia similar al acero. Los minerales más importantes en los que se encuentra son el circón (ZrSiO4) y la baddeleyita (ZrO2), aunque debido al gran parecido entre el circonio y el hafnio (no hay otros elementos que se parezcan tanto entre sí) realmente estos minerales son mezclas de los dos; los procesos geológicos no han sido capaces de separarlos. Se utiliza sobre todo en reactores nucleares (por su baja sección de captura de neutrones). También se emplea como refractario y opacificador, como material abrasivo y, en pequeñas cantidades, como agente de aleación por su fuerte resistencia a la corrosión.
Historia

El circonio (del persa zargun, que significa «color dorado») fue descubierto en 1789 por Martin Heinrich Klaproth a partir del circón (Zr [SiO4]) piedra preciosa conocida desde la antigüedad. En 1824 Jöns Jacob Berzelius lo aisló en estado impuro; hasta 1914 no se preparó el metal puro.
En algunas escrituras bíblicas se menciona el mineral circón, que contiene circonio, o alguna de las variaciones de dicho mineral (jargón, jacinto, etc.) No se conocía que el mineral contenía un nuevo elemento hasta que Klaproth analizó un jergón procedente de Ceilán, en el océano Índico, denominando al nuevo elemento como circonia. Berzelius lo aisló impuro por la reducción de fluoruro de potasio y circonio, K2ZrF6 con potasio, para lo cual calentó una mezcla de fluoruro de potasio y circonio y potasio en un tubo de hierro. Después tratado con agua, secado y calentamiento prolongado en ácido clorhídrico diluido obtuvo un polvo semejante a negro de carbón.[3]
Sin embargo, hasta 1924 no se determinará, la correcta masa atómica, ya que se desconocía que el circonio natural siempre contiene pequeñas cantidades de hafnio. Sin esta información, las mediciones de la masa atómica siempre fueron muy elevadas.[4]
La primera aplicación práctica de circonio se utiliza como flash en fotografía.
Propiedades
Propiedades físicas
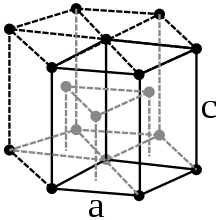
Es un metal sólido a temperatura ambiente, blanco grisáceo, lustroso. Es un metal pesado (densidad 6,501 g/ cm³ a 25 °C[5]), pero más ligero que el acero, con una dureza similar a la del cobre.
El punto de fusión de circonio es 1855 °C (3371 °F), y su punto de ebullición es de 4371 °C (7900 °F).[6] circonio tiene una electronegatividad de 1.33 en la escala de Pauling. De los elementos del bloque d, el circonio tiene la cuarta más baja electronegatividad después de itrio, lutecio y hafnio.[7]
A temperatura ambiente el circonio presenta una estructura cristalina hexagonal compacta, α-Zr, del mismo tipo que el magnesio. A 863 °C cambia a una estructura cristalina cúbica centrada, β-Zr, similar a la del wolframio. El circonio conserva la fase-β hasta el punto de fusión.[8]
Las aleaciones con zinc se vuelven magnéticas por debajo de 35 K.[6] ZrZn2 es una de las dos sustancias que presentan superconductividad y ferromagnetismo simultáneamente, la otra es UGe2.[9] Por debajo de 0.55 K el circonio es superconductor.[10]
Puro es dúctil y maleable, es de fácil laminación y forja. Pero pequeñas impurezas de hidrógeno, carbono o nitrógeno lo vuelven frágil y difícil de procesar.[11][12] La conductividad eléctrica es relativamente mala para ser un metal, es sólo el 4 % de la del cobre. Pero a pesar de su mal conductividad eléctrica es relativamente buen conductor térmico. Si lo comparamos con el titanio los puntos son de fusión y de ebullición son ligeramente más altos (punto de fusión: titanio: 1667 °C, de circonio: 1857 °C). La conductividad eléctrica y térmica es mejor.
Las propiedades de circonio y el homólogo más pesado, el hafnio, son similares debido a la contracción lantánida. Esta hace que los radios atómicos sean semejantes (Zr: 159 pm, Hf: 156 pm[10] ) y tanto las propiedades similares. Los dos metales, sin embargo, difieren considerablemente en su densidad, Zr: 6,5 g/cm³ , Hf: 13,3 g/cm³.[13]
Una propiedad de gran importancia para el empleo del circonio en reactores nucleares es su baja sección eficaz de captura de neutrones. Por el contrario el hafnio tiene una sección muy elevada esto hace necesario el proceso de separación para aplicaciones nucleares.
Propiedades químicas
Sus estados de oxidación más comunes son +2, +3 y +4.
El circonio forma una delgada y compacta capa de óxido, circonio pasivado y por lo tanto inerte. Presenta una alta resistencia a la corrosión por álcalis, ácidos, agua salada y otros agentes.[6] Las bases acuosas reaccionan con el circonio. Pero se puede disolver mediante ácido fluorhídrico (HF), seguramente formando complejos con los fluoruros. También, se disolverá en una mezcla de ácido clorhídrico y sulfúrico especialmente cuando está presente el flúor.[14]
Cuando está finamente dividido es altamente inflamable, puede arder espontáneamente en contacto con el aire (reacciona antes con el nitrógeno que con el oxígeno), especialmente a altas temperaturas. En forma compacta es mucho menos propenso a la ignición, a presiones moderadas, reacciona solo al rojo vivo con el oxígeno y el nitrógeno. Pero a una presión elevada de circonio reacciona con el oxígeno a temperatura ambiente, ya que el óxido de circonio formado es soluble en el metal fundido.[10]
Isótopos
El circonio de origen natural está formado por cuatro isótopos estables:90Zr, 91Zr, 92Zr, 94Zr y un radioisótopo de muy larga vida media 96Zr. El 94Zr puede sufrir una doble desintegración beta (no observada experimentalmente) con una vida media de más de 1,10×1017 años. El 96Zr tiene una vida media de 2,4×1019 años, por lo que es el radioisótopo más longevo de circonio. De estos isótopos naturales, el 90Zr es la más común, representa 51,45 % de todo el zirconio, mientras que el 96Zr es el menos común, que comprende solo 2,80 % de circonio.[15]
Se han sintetizado veintiocho isótopos artificiales del circonio, que van en la masa atómica de 78 a 110. El 93Zr es el isótopo artificial de vida más larga, con una vida media de 1,53×106 años. El 110Zr es el isótopo más pesado de circonio, y también el de más corta duración, y se estima que la vida media de sólo 30 ms. La mayoría tienen periodos de semidesintegración de menos de un día, excepto el 95Zr (64,02 días), 88Zr (63,4 días) y 89Zr (78,41 horas). Los radioisótopos en o por encima de número de masa 93 se desintegran por desintegración beta β -, mientras que los que están en o por debajo de 89 por desintegración β +. La única excepción es el 88Zr, que se desintegra por captura electrónica ε.[15]
También existen cinco isótopos de circonio en la forma de isómeros metaestable: 83mZr, 85mZr, 89mZr, 90M1Zr, 90m2Zr y 91mZr. De estos, 90m2Zr tiene la vida media más corta 131 nanosegundos, mientras que 89mZr es el más longevo con una vida media de 4,161 minutos.
Aplicaciones
- Principalmente (en torno a un 90 % del consumido) se utiliza, generalmente aleado, zircaloy, en reactores nucleares, debido su resistencia a la corrosión y su muy baja sección de captura de neutrones. La sección de captura del hafnio es alta, por lo que es necesario separarlos para esta aplicación (para otras, no es necesario), generalmente mediante un proceso de extracción con dos disolventes no miscibles, o bien empleando resinas de intercambio iónico.
- Se utiliza como aditivo en aceros obteniéndose materiales muy resistentes. También se emplean aleaciones con níquel en la industria química por su resistencia frente a sustancias corrosivas, especialmente para válvulas, bombas, tuberías e intercambiadores de calor
- El óxido de circonio impuro se emplea para fabricar crisoles de laboratorio (que soportan cambios bruscos de temperatura), recubrimiento de hornos y como material refractario en industrias cerámicas y de vidrio.
- El óxido de circonio estabilizado con itrio es ampliamente utilizado en odontología para la confección de prótesis fijas, prótesis removibles y pilares de implantes. Además, es utilizado para el reemplazo de articulaciones, ya que es un material bioinerte al igual que el titanio.
- También se emplea en intercambiadores de calor, tubos de vacío y filamentos de bombil se emplean para la fabricación de antitranspirantes.
- Con fines militares se emplea como agente incendiario, como el cartucho aliento de dragón.
- Aleado con niobio presenta superconductividad a bajas temperaturas, por lo que se puede emplear para hacer imanes superconductores. Por otra parte, la aleación con cinc es magnética por debajo de los 35 K.
- El óxido de circonio se usa en joyería; es una gema artificial denominada circonita que imita al diamante.
- Podemos agregar una industria en sus comienzos: la fabricación de hojas de corte, que pueden ser extremadamente resistentes y duraderas, superando a las mejores aleaciones de acero. Hoy podemos encontrar cuchillos y otros accesorios de cocina de tipo comercial y profesional.
- Se utiliza como aditivo para fabricar arenas sintéticas.
Abundancia

No se encuentra en la naturaleza como metal nativo, lo que refleja su inestabilidad intrínseca con respecto al agua. Pero forma parte de numerosos minerales. En la corteza terrestre el circonio se encuentra presente en una concentración de aproximadamente 130 mg/kg y alrededor de 0.026 mg/L en el agua de mar.[16] En abundancias ocupa el puesto 18, pero a pesar de ser muy común, por lo general solo se encuentra en cantidades muy pequeñas y cristales muy pequeños (típicamente 0,1 mm), por lo que en otros tiempos se consideró un elemento escaso. El circonio se encuentra principalmente en rocas silíceas intrusivas, como el granito. La materia prima son generalmente depósitos secundarios, llamados depósitos de placer. Estos se forman cuando la roca circundante se degrada y quedan los restos de circonio ya que son más resistentes a la intemperie. Además, tales depósitos pueden ser causados por corrientes de agua que enjuagan los cristales de circón y los depositan en otros lugares. En contraste, los depósitos primarios suelen tener un bajo contenido de circonio y no son rentables para la minería. La principal fuente comercial de circonio es el mineral circón (silicato de circonio, ZrSiO4),[11] que se encuentra principalmente en depósitos en Australia, Brasil, India, Rusia y los Estados Unidos, así como en depósitos más pequeños de todo el mundo.[12] El 80 % de la minería de circón se produce en Australia y Sudáfrica.[11] la reservas de circón superan 60 millones de toneladas en todo el mundo[16] y la producción de circonio anual mundial es de aproximadamente 900 000 toneladas.[16] El circonio también se encuentra en más de otros 140 minerales, incluyendo minerales comercialmente útiles baddeleyita(ZrO2), kosnarite.[17] y la eudialita (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2) El circón se obtiene como subproducto de la minería y procesado de minerales de metales pesados de titanio, la ilmenita (FeTiO3) y el rutilo (TiO2), y también de la minería del estaño. El circonio y el hafnio se encuentran en el circón en una relación de 50 a 1 y es muy difícil separarlos. También se encuentra en otros minerales, como la badeleyita .
También es abundante en las estrellas de tipo S y se ha detectado en el Sol y en meteoritos. Además, se ha encontrado una alta cantidad en óxido de circonio (en comparación con la presente en la corteza terrestre) en muestras lunares traídas por el programa Apolo.[6]
Producción
El circón es un subproducto de la minería y el procesamiento de los minerales de titanio ilmenita y rutilo, así como de la minería del estaño.[18] Entre 2003 y 2007, los precios de circón han aumentado constantemente desde $360 a $840 por tonelada.[19]
Al ser recogido de las aguas costeras, la arena de circonio que contienen se purifica mediante concentradores en espiral para eliminar los materiales más ligeros, que luego se colocan de nuevo en el agua con seguridad, ya que son todos los componentes naturales de la arena de la playa. Mediante separación magnética se eliminan los minerales del titanio ilmenita y rutilo.
La mayoría de circón se utiliza directamente en aplicaciones comerciales, pero un pequeño porcentaje se convierte en el metal. El primer paso consiste en la obtención del dióxido de circonio fundiendo el circón con hidróxido de sodio, digestión química. No es posible la reducción directa de óxido de circonio con carbono (como en el proceso de alto horno), ya que se forman carburos muy difíciles de separar. La mayoría de circonio metálico se produce por la reducción del cloruro de circonio (IV) con magnesio metálico en el proceso Kroll.[6] Primero se prepara el cloruro:
para después reducirlo con magnesio en una atmósfera de helio.
El metal resultante se sinteriza hasta que esté suficientemente dúctil para metalurgia.[12] En procesos semi-industriales se puede realizar la electrólisis de sales fundidas, obteniéndose el circonio en polvo que puede utilizarse posteriormente en pulvimetalurgia. Para la obtención del metal con mayor pureza se sigue el proceso van Arkel-de Boer basado en la disociación del yoduro de circonio, obteniéndose una esponja de circonio metal denominada crystal-bar. Para lo cual se calienta, a unos 200 °C, bajo vacío circonio con yodo para obtener yoduro de circonio (IV). Este se descompone en un alambre caliente, 1200 °C, de nuevo en yodo, que se mantiene gaseoso, y circonio que se deposita sobre el alambre:
Tanto en este caso, como en el anterior, la esponja obtenida se funde para obtener el lingote.
El circonio de calidad comercial, incluso siguiendo el proceso van Arkel-de Boer, todavía tiene un contenido de 1 % a 3 % de hafnio.[20] Este contaminante no es importante para la mayoría de usos excepto en aplicaciones nucleares.
Separación de circonio y hafnio
El circonio comercial generalmente contiene de 1 a 2,5 % de hafnio. Para las aplicaciones usuales esto no es un problema debido a las propiedades químicas de hafnio y circonio son bastante similares. Pero las propiedades de absorción de neutrones difieren fuertemente, por lo que se requiere la separación de hafnio del circonio para aplicaciones que implican reactores nucleares.[21] Varios métodos de separación están en uso.[20] La extracción líquido-líquido del tiocianato y los derivados de óxido, explota la ligera mayor solubilidad del derivado de hafnio en metil-isobutil-cetona frente al agua. Este método se utiliza principalmente en los Estados Unidos. El circonio y hafnio también se pueden separar por cristalización fraccionada del hexafluorocirconato de potasio (K2ZrF6), que es menos soluble en agua que el derivado de hafnio análogo. La destilación fraccionada de los tetracloruros, también llamado destilación extractiva, se utiliza principalmente en Europa. Un proceso VAM cuádruple (fusión por arco al vacío), combinado con extrusión en caliente y diferentes aplicaciones de laminación se cura usando gas de alta temperatura de alta presión de esterilización en autoclave, resultando el circonio de grado de reactor aproximadamente 10 veces más caro que el grado comercial contaminado de hafnio. La separación de hafnio es importante para aplicaciones nucleares ya que el Hf tiene una muy alta sección transversal de absorción de neutrones, unas 600 veces superior a la de zirconio.[22] El hafnio separado se puede utilizar para las barras de control del reactor.[23]
Precauciones
No son muy comunes los compuestos que contengan circonio, y su toxicidad inherente es baja. El polvo metálico finamente dividido puede arder en contacto con el aire y calor, por lo que hay que considerarlo como un agente de riesgo de fuego o explosión, se debe aclarar no obstante que esta no es una característica específica de este metal, todos los metales o materiales sólidos finamente divididos presentan el mismo riesgo de auto combustión. No se conoce ningún papel biológico de este elemento.
Referencias
- ↑ «Nombres y símbolos en español acordados por la RAC, la RAE, la RSEQ y la Fundéu». 1 de marzo de 2017. Consultado el 4 de abril de 2017.
- ↑ Harper, Douglas. «zircon». Online Etymology Dictionary.
- ↑ Johann Joseph Prechtl: Jahrbücher des kaiserlichen königlichen polytechnischen Instituts in Wien, 1826, Bd. 9, S. 265.
- ↑ O. Hönigschmied, E. Zintl, F. Gonzalez: Über das Atomgewicht des Zirconiums. In: Zeitschrift für allgemeine und anorganische Chemie, 1924, 139, S. 293–309.
- ↑ Gordon B. Skinner, Herrick L. Johnston: Thermal Expansion of Zirconium between 298°K and 1600°K. In: J. Chem. Phys. 1953, 21, S. 1383-1284, doi 10.1063/1.1699227.
- ↑ a b c d e Lide, David R., ed. (2007–2008). «Zirconium». CRC Handbook of Chemistry and Physics 4. New York: CRC Press. p. 42. ISBN 978-0-8493-0488-0.
- ↑ Winter, Mark (2007). «Electronegativity (Pauling)». University of Sheffield. Consultado el 5 de marzo de 2008.
- ↑ Schnell I and Albers RC (enero de 2006). «Zirconium under pressure: phase transitions and thermodynamics». Journal of Physics: Condensed Matter (Institute of Physics) 18 (5): 16. Bibcode:2006JPCM...18.1483S. doi:10.1088/0953-8984/18/5/001.
- ↑ Day, Charles (septiembre de 2001). «Second Material Found that Superconducts in a Ferromagnetic State». Physics Today (American Institute of Physics) 54 (9): 16. Bibcode:2001PhT....54i..16D. doi:10.1063/1.1420499.
- ↑ a b c Holleman-Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ a b c Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 506-510. ISBN 0-19-850341-5.
- ↑ a b c «Zirconium». How Products Are Made. Advameg Inc. 2007. Consultado el 26 de marzo de 2008.
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage, VCH Verlagsgesellschaft, 1988, ISBN 3-527-26169-9.
- ↑ Considine, Glenn D., ed. (2005). «Zirconium». Van Nostrand's Encyclopedia of Chemistry. New York: Wylie-Interscience. pp. 1778-1779. ISBN 0-471-61525-0.
- ↑ a b Audi, G; Bersillon, O.; Blachot, J.; Wapstra, A.H. (2003). «Nubase2003 Evaluation of Nuclear and Decay Properties». Nuclear Physics A (Atomic Mass Data Center) 729: 3-128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ↑ a b c Peterson, John; MacDonell, Margaret (2007). «Zirconium» (PDF). Radiological and Chemical Fact Sheets to Support Health Risk Analyses for Contaminated Areas. Argonne National Laboratory. pp. 64-65. Archivado desde el original el 28 de mayo de 2008. Consultado el 26 de febrero de 2008.
- ↑ Ralph, Jolyon and Ralph, Ida (2008). «Minerals that include Zr». Mindat.org. Consultado el 23 de febrero de 2008.
- ↑ Callaghan, R. (21 de febrero de 2008). «Zirconium and Hafnium Statistics and Information». US Geological Survey. Consultado el 24 de febrero de 2008.
- ↑ «Zirconium and Hafnium» (PDF). Mineral Commodity Summaries (US Geological Survey): 192-193. enero de 2008. Consultado el 24 de febrero de 2008.
- ↑ a b Nielsen, Ralph (2005) "Zirconium and Zirconium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi 10.1002/14356007.a28_543
- ↑ Stwertka, Albert (1996). A Guide to the Elements. Oxford University Press. pp. 117–119. ISBN 0-19-508083-1.
- ↑ Brady, George Stuart; Clauser, Henry R. and Vaccari, John A. (24 de julio de 2002). Materials handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors. McGraw-Hill Professional. pp. 1063-. ISBN 978-0-07-136076-0. Consultado el 18 de marzo de 2011.
- ↑ Zardiackas, Lyle D.; Kraay, Matthew J. and Freese, Howard L. (1 de enero de 2006). Titanium, niobium, zirconium and tantalum for medical and surgical applications. ASTM International. pp. 21-. ISBN 978-0-8031-3497-3. Consultado el 18 de marzo de 2011.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Circonio.
Wikimedia Commons alberga una galería multimedia sobre Circonio.- WebElements.com - Zirconium.
- EnvironmentalChemistry.com - Zirconium.





















