LIMSpec Wiki
Obsah
| Hydrazin | |
|---|---|
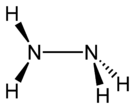 | |
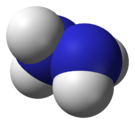 model molekuly | |
| Obecné | |
| Systematický název | Hydrazín Diazan |
| Anglický název | Hydrazine |
| Německý název | Hydrazin |
| Sumární vzorec | N2H4 |
| Vzhled | bezbarvá kapalina nebo krystaly |
| Identifikace | |
| Registrační číslo CAS | 302-01-2 |
| EC-no (EINECS/ELINCS/NLP) | 206-114-9 |
| PubChem | 9321 |
| ChEBI | 15571 |
| UN kód | 2029 |
| Číslo RTECS | MU7175000 |
| Vlastnosti | |
| Molární hmotnost | 32,045 6 g/mol 50,061 g/mol (monohydrát) |
| Teplota tání | 1,4 °C −51,6 °C (monohydrát) |
| Teplota varu | 113,5 °C 118,5 °C (monohydrát) |
| Hustota | 1,014 g/cm3 (15 °C) 1,011 g/cm3 (20 °C) 1,03 g/cm3 (monohydrát, 21 °C) |
| Dynamický viskozitní koeficient | 1,21 cP (5 °C) 0,91 cP (25 °C) |
| Index lomu | nD= 1,469 79 (22 °C) |
| Kritická teplota Tk | 380 °C |
| Kritický tlak pk | 1 469 kPa |
| Disociační konstanta pKb | 5,770 |
| Rozpustnost ve vodě | neomezeně mísitelný |
| Rozpustnost v polárních rozpouštědlech | methanol ethanol |
| Rozpustnost v nepolárních rozpouštědlech | diethylether aromatické uhlovodíky |
| Relativní permitivita εr | 52,9 (20 °C) |
| Ionizační energie | 8,74 eV |
| Povrchové napětí | 66,7 mN/m |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 50,4 kJ/mol −205 kJ/mol (monohydrát, plyn) −243 kJ/mol (monohydrát, kapalina) |
| Entalpie tání ΔHt | 395,1 J/g |
| Entalpie varu ΔHv | 1 279 J/g |
| Standardní molární entropie S° | 121 JK−1mol−1 264 JK−1mol−1 (monohydrát, plyn) |
| Standardní slučovací Gibbsova energie ΔGf° | 149,2 kJ/mol −79,1 kJ/mol (monohydrát, plyn) |
| Izobarické měrné teplo cp | 3,084 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R10, R23/24/25, R34, R43, R45, R50/53 |
| S-věty | S45, S53, S60, S61 |
| NFPA 704 |  4
4
3
|
| Teplota vzplanutí | 52 °C |
Některá data mohou pocházet z datové položky. | |
Hydrazin (systematický název diazan) je anorganická sloučenina dusíku s vodíkem. Je to bezbarvá kapalina slabého čpavého zápachu, podobného čpavku, jedovatá, silně zásaditá, tedy žíravá. Připravuje se reakcí vodného roztoku amoniaku s roztokem chlornanových solí, např. chlornanu sodného podle rovnice
- 2 NH3 + NaClO → N2H4 + H2O + NaCl.
Fyzikální vlastnosti hydrazinu jsou velmi podobné vodě (viz infobox), chemické jsou však velmi odlišné. S vodou tvoří krystalický monohydrát, N2H4.H2O.
Použití
Nejvíce hydrazinu se spotřebuje jako palivo v raketových motorech. Používá se jako jednosložková pohonná látka (monopropelant), kde se využívá jeho rozkladu na vodík a dusík na katalyzátorech podle rovnice
- N2H4 → N2 + 2H2,
nebo jako jedna ze složek dvousložkové pohonné látky (bipropelantu), přičemž jako okysličovadlo se nejčastěji používá oxid dusičitý; spalování probíhá dle rovnice
- 2N2H4 + N2O4→ 3N2 + 4H2O.
Směs hydrazinu s oxidem dusičitým je hypergolická, tj. uvedená reakce započne automaticky po smíchání obou složek pohonné látky. Proto při použití této směsi jsou raketové motory jednodušší, neboť nepotřebují zážehový systém. Méně často se jako okysličovadlo používá dýmavá kyselina dusičná nebo kapalný kyslík.
Vzhledem k vysokému bodu varu hydrazinu se jedná o tzv. skladovatelnou pohonnou látku (na rozdíl např. od kapalného vodíku). Na druhou stranu je nevýhodou jeho vysoký bod tání; proto se často používá jeho směsi s dimethylhydrazinem, která se nazývá Aerozin-50 a tuhne hluboko pod bodem mrazu.
Regulace
V červnu 2011 byl Evropskou agenturou pro chemické látky zařazen na kandidátský seznam látek vzbuzující mimořádné obavy.[2]
Bezpečnost
Hydrazin je vysoce toxický a nebezpečně nestabilní ve své bezvodé formě. Při expozici vyšším dávkám se může dostavit podráždění očí, nosu a hrdla, závratě, nevolnost, bolest hlavy a nebo kóma. Akutní expozice poškozuje játra, ledviny a centrální nervový systém. Tekutý je žíravý a způsobuje dermatitidu při kontaktu s kůží člověka nebo zvířete. Poškození plic, jater, sleziny a štítné žlázy byly nahlášeny u zvířat s chronickou expozicí hydrazinu vdechováním.
Využití v chemické syntéze
Hydrazin je někdy používán v organických i anorganických syntézách (příkladem syntéza azidů, tetrazolového kruhu resp. aminoguanidinu nebo luminolu). V těchto aplikacích se ovšem nikdy nepoužívá ve své bezvodé formě. Místo toho se používá jeho sůl (nejčastěji síran-hydrazin sulfát). Tato krystalická chemikálie je buď dodána přímo do reakční směsi obsahující přebytek zásady, čímž se uvolní volná hydrazinová báze in situ a okamžitě reaguje, popřípadě se sulfát zvlášť předem převede na volnou bázi ve vodném prostředí, čímž vznikne vodný roztok hydrazinu a ten se následně dodá do hlavní reakční směsi, čímž odpadá nutnost mít v reakční směsi zásadu. Obě dvě popsané formy jsou bezpečnější než bezvodý hydrazin, avšak stále se jedná o činidla, s nimiž musí být nakládáno opatrně. To zejména pro jejich značnou toxicitu a karcinogenitu. Všechny formy hydrazinu taktéž nesmí přijít do kontaktu s horkou koncentrovanou kyselinou dusičnou, neboť hrozí vznik plynného azidovodíku, jež může způsobit otravu.
Reference
- ↑ a b Hydrazine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Miroslav Šuta: REACH: 7 nebezpečných chemikálií přidáno na černou listinu Archivováno 4. 2. 2015 na Wayback Machine., 26. června 2011
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu hydrazin na Wikimedia Commons
Obrázky, zvuky či videa k tématu hydrazin na Wikimedia Commons























