LabLynx Wiki
Vsebina
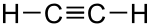

Alkin je nenasičen ogljikovodik, ki ima med ogljikovimi atomi vsaj eno trojno vez -C≡C-. Najenostavnejši alkin je etin (CH≡CH), bolj znan kot acetilen. Alkini tvorijo homologno vrsto s splošno formulo CnH2n-2.
Alkini niso topni v vodi, pač pa v nepolarnih topilih, na primer v etru, benzenu in tetraklorometanu. Njihova gostota je manjša od gostote vode. Njihova vrelišča naraščajo s številom ogljikovih atomov in so skoraj enaka vreliščem alkanov z enakim številom ogljikovih atomov. S kisikom zgorijo v ogljikov dioksid in vodo. Nekateri alkini tvorijo z zrakom eksplozivne zmesi.
Kemijske lastnosti
Alkini so zaradi trojne vezi mnogo bolj reaktivni in nestabilni od alkanov in alkenov.
Alkini s trojno vezjo za prvim ogljikovim atomom (terminalni alkini) in acetilen so proti pričakovanjem kisli: njihova pKa=25, kar je nekje med etanolom (pKa=16) in amonijakom (pKa=35). Kislost je pogojena s stabilnostjo nastale konjugirane baze, se pravi karboaniona, ta pa je pogojena z lastnostmi hibridne orbitale, ki vsebuje vezni elektronski par. V hibridni orbitali sp3 je udeležba orbitale s 25%, v orbitali sp2 33% in v orbitali sp 50%. Iz tega sledi, da je sp orbitala alkinov zaradi 50% deleža orbitale s bliže jedra, da je zato elektronski par elektrostatsko bolj stabilen, da se zato konjugirane baze alkinov laže tvorijo in so tudi bolj stabilne.[1]
Vez C-H v terminalnih alkinih kljub tem značilnostim ni močno kisla, zato so za tvorbo karboanionov potrebne močne baze, na primer natrij, natrijev amid, n-butillitij ali Grignardovi reagenti. V reakciji z bazami nastane anion terminalnega alkina oziroma njegova sol (acetilenid):
- 2RC≡CH + 2Na → 2RC≡CNa + H2
Reakcijo lahko posplošimo:
- RC≡CH + B → RC≡C− + HB+
pri čemer B pomeni močno bazo. Terminalni alkini lahko tvorijo acetilenide tudi z drugimi kovinami, na primer z bakrom in srebrom. Takšne spojine so zelo nestabilne in eksplozivne.
Acetilenidni anion je kot močan nukleofil zelo uporaben v organskih sintezah, na primer za formiranje novih vezi C-C.
Fizikalne lastnosti
V naslednji tabeli so prikazane nekatere fizikalne lastnosti najpomembnejših alkinov.[2]
| Ime | Formula | Tališče [°C] | Vrelišče [°C] | Gostota pri 20° [g cm-3]) |
| Etin | C2H2 | −83,8 | −80,8 | plin, 1,097 kg/m3 |
| Propin | C3H4 | -102,7 | -23,2 | 0,530 |
| But-1-in | C4H6 | -106 | 8,1 | 0,678 |
| But-2-in | C4H6 | -32,2 | 26,95 | 0,691 |
| Pent-1-in | C5H8 | -105 | 40,2 | 0,695 |
| Pent-2-in | C5H8 | -101 | 55 | 0,714 |
| Heks-1-in | C6H10 | -124 | 72 | 0,719 |
| Hept-1-in | C7H12 | -80 | 100 | 0,733 |
| Okt-1-in | C8H14 | -70 | 126 | 0,747 |
| Non-1-in | C9H16 | -65 | 151 | 0,763 |
| Dek-1-in | C10H18 | -35 | 181 | 0,770 |
Zgradba
Ogljikovi atomi v alkinih so sp hibridizirani: vsak atom ima dve p orbirali in dve hibridni sp orbitali. S prekrivanjem po ene sp orbitale iz vsakega ogljikovega atoma nastane σ-vez sp-sp, s prekrivanjem dveh p orbital iz vsakega ogljikovega atoma pa nastaneta dve π-vezi, skupaj torej tri vezi. Preostala sp orbitala tvori σ-vez s kakšnim drugim elementom, na primer z vodikom. σ-vezi, ki ležita na nasprotnih straneh trojne vezi, oklepata s trojno vezjo kot 180°.
V trojni vezi so udeleženi trije vezni elektronski pari, zato je vez močna: 839 kJ/mol. K tej energiji prispeva σ-vez 369 kJ/mol, prva π-vez 268 kJ/mol in druga π-vez 202 kJ/mol. Razdalja med ogljikovimi atomi je 1,21 Å, kar je mnogo manj kot pri alkenih (1,34 Å) in alkanih (1,53 Å).
Terminalni in interni alkini
Terminalni alkini so alkini, ki imajo vodikov atom vezan na najmanj en sp hibridizirani ogljikov atom, se pravi tisti, ki tvori trojno vez. Takšen je, na primer, propin (CH3-C≡CH):

in vsi alkini, ki imajo trojno vez za prvim in/ali pred zadnjim ogljikovim atomom.
Interni alkini imajo na sp hibridiziranem ogljiku namesto vodika vezan nek drug, običajno ogljikov, atom. Primer internega alkina je pent-2-in (2-pentin, CH3-C≡C-C2H5), v katerem je na eni strani trojne vezi metilna, na drugi strani pa etilna skupina:

Terminalni vodikov atom je rahlo kisel in se z zelo močnimi bazami odcepi in tvori soli. Ta lastnost je uporabna za ugotavljanje položaja trojne vezi: vzorcu se doda nekaj kapljic raztopine diaminosrebrovega(I) hidroksida (Ag(NH3)2OH), ki tvori s terminalnimi alkini belo oborino netopnega srebrovega acetilenida:
R-C≡CH + Ag(NH3)2OH → R-C≡CAg + NH4OH + NH3
Soli terminalnih alkinov s prehodnimi kovinami so v suhem stanju eksplozivne.
Ta lastnost je uporabna za podaljševanje verige ogljikovih atomov.
Sinteze
Alkini se običajno pripravljajo z eliminacijo vodikovih halogenidov (dehidrohalogeniranje) iz vicinalnih alkilnih dihalogenidov:
- R1-CHBr-CHBr-R2 → R1-C≡C-R2 + 2HBr
ali z reakcijo med acetilenidom in primarnim alkil halogenidom:
- R1-C≡CNa + Br-CH2-R2 → R1-C≡C-CH2-R2 + NaBr
Alkine se lahko sintetizira tudi iz vinil bromida s Fritsch-Buttenberg-Wiechellovo prerazporeditvijo:
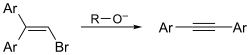
Na sliki je reakcija z aromatskim vinil bromidom, vendar poteče tudi z alifatskim vinilbromidom.[3]
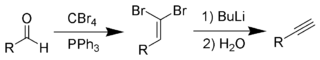
Alkini nastanejo tudi iz aldehidov s Corey-Fuchsovo reakcijo
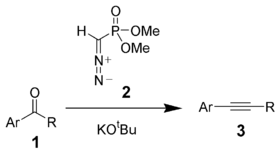
in iz aldehidov in ketonov s Seyferth-Gilbertovo homologacijo:
Reakcije
Alkini so zaradi trojne vezi mnogo bolj reaktivni kot alkani in alkeni in sodelujejo v mnogih kemijskih reakcijah.
Elektrofilna adicija
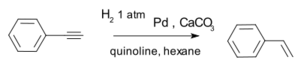
- Hidrogeniranje: z adicijo vodika nastanejo najprej alkeni in iz njih alkani. Primer: pretvorba fenilacetilena v stiren, ki jo učinkovito katalizira Lindlarjev katalizator:[4]
- Adicija halogena daje vinil ali alkil halogenide.
- Adicija vodikovega halogenida daje vinil ali alkil halogenide.
- Nicholasova reakcija.
- Adicija vode daje karbonilne spojine (pogosto preko enolnih intermediatov). Značilen primer adicije vode je hidroliza fenilacetilena v acetofenon z natrijevim tetraklorauratom v vodni raztopini metanola, ki je prikazana na naslednji reakcijski shemi.[5]. Reakcija poteče tudi z (Ph3P)AuCH3 [6].
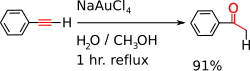
Cikloadicija
- Diels-Alderjeva reakcija z 2-pironom daje po eliminaciji ogljikovega dioksida aromatsko spojino.
- S Huisgenovo cikloadicijo azidov nastanejo triazoli.
- Bergmanova ciklizacija enedinov v aromatske spojine.
- Z alkinsko trimerizacijo nsatanejo aromatske spojine.
- Cikloadicija 2+2+1: s cikloadicijo med alkinom, alkenom in ogljikovim monoksidom (Pauson-Khandova reakcija) nastaneta α in β-ciklopentenon:[7][8]
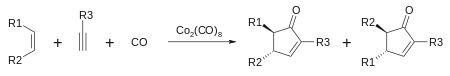
Metateza
- Alkinska metateza: iz alkinov nastanejo novi alkini.
- Eninska metateza: v reakciji z alkeni nastanejo butadieni.
Nukleofilna substitucija
- Z nukleofilnimi substitucijami kovinskih acetilenidov z alkilnimi halogenidi nastanejo nove vezi C-C.
Nulkeofilna adicija
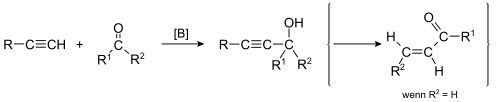
- V reakcijah kovinskih acetilenidov s karbonilnimi spojinami nastanejo najprej intermediati alkoksidi, iz njih pa s kislo obdelavo (reakcija Favorskega) hidroksialkini. Iz hidroksialkinov lahko s preureditvijo nastanejo nenasičeni ketoni:
Hidroboriranje
- Hidroboriranje alkinov z organskimi borani daje vinilne borane. Z naknadno oskidacijo vinilnih boranov z vodikovim peroksidom (H2O2) nastanejo aldehidi ali ketoni.
Oksidativno cepljenje
- Oksidativno cepljenje s kalijevim permanganatom (KMnO4) daje karboksilne kisline.
Migriranje trojne vezi
- Obdelava alkinov z močnimi bazami povzroči premik trojne vezi po ogljikovi verigi.
Pripajanje
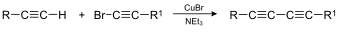
- Pripajanje alkinov na alkine povzroči nastanek dialkinov. Na reakcijski shemi je prikazano Cadiot-Chodkiewiczevo pripajane, znani pa sta tudi Glaserjevo in Eglintonovo pripajanje.
Reference
- ↑ »Francis A. Carey, Organic Chemistry«. Arhivirano iz prvotnega spletišča dne 26. oktobra 2008. Pridobljeno 15. februarja 2009.
- ↑ [Alkynes http://www.ucc.ie/academic/chem/dolchem/html/dict/alkynes.html]
- ↑ Rezaei, H.; Yamanoi, S.; Chemla, F.; Normant, J.F. (2000). »Fritsch-Buttenberg-Wiechell Rearrangement in the Aliphatic Series«. Org. Lett. 2 (4): 419–421. doi:10.1021/ol991117z.
- ↑ Organic Syntheses, Coll. Vol. 5, str. 880 (1973); Vol. 46, p.89 (1966). http://orgsynth.org/orgsyn/pdfs/CV5P0880.pdf
- ↑ Fukuda, Y.; Utimoto, K. "Effective transformation of unactivated alkynes into ketones or acetals with a gold(III) catalyst". J. Org. Chem. 1991, 56, 3729–3731. DOI: 10.1021/jo00011a058
- ↑ Mizushima, E.; Cui, D.-M.; Nath, D. C. D.; Hayashi, T.; Tanaka, M. "Au(I)-Catalyzed hydratation of alkynes: 2,8-nonanedione". Organic Syntheses, Vol. 83, p.55 (2005). Link.
- ↑ P. L. Pauson and I. U. Khand. Ann. N.Y. Acad. Sci. 1977, 295, 2.
- ↑ Blanco-Urgoiti, J.; Añorbe, L.; Pérez-Serrano, L.; Domínguez, G.; Pérez-Castells, J. Chem. Soc. Rev. 2004, 33, 32. (doi:10.1039/b300976a)

















