LabLynx Wiki
Innhold
| Kalium | |||
|---|---|---|---|
 | |||
| Basisdata | |||
| Navn | Kalium | ||
| Symbol | K | ||
| Atomnummer | 19 | ||
| Utseende | sølvhvitt | ||
| Plass i periodesystemet | |||
| Gruppe | 1 | ||
| Periode | 4 | ||
| Blokk | s | ||
| Kjemisk serie | alkalimetall | ||
| Atomegenskaper | |||
| Atomvekt | 39,0983 u | ||
| Empirisk atomradius | 220 pm | ||
| Kalkulert atomradius | 243 pm | ||
| Kovalent atomradius | 196 pm | ||
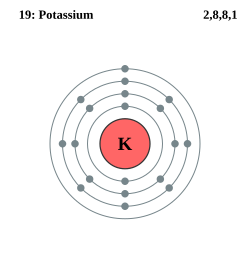
| Elektronkonfigurasjon | [Ar] 4s1 | ||
| Elektroner per energinivå | 2, 8, 8, 1 | ||
| Oksidasjonstilstander | 1 | ||
| Krystallstruktur | kubisk romsentrert | ||
| Fysiske egenskaper | |||
| Stofftilstand | fast stoff | ||
| Smeltepunkt | 63,38 °C | ||
| Kokepunkt | 759 °C | ||
| Molart volum | 45,94 · 10-6 m³/mol | ||
| Tetthet | 856 kg/m³ | ||
| Hardhet | 0,4 (Mohs skala) | ||
| Fordampningsvarme | 79,87 kJ/mol | ||
| Smeltevarme | 2,334 kJ/mol | ||
| Damptrykk | 1,06 · 10−4 Pa | ||
| Lydfart | 2 000 m/s | ||
| Diverse | |||
| Elektronegativitet etter Pauling-skalaen | 0,82 | ||
| Spesifikk varmekapasitet | 757 J/(kg · K) | ||
| Elektrisk ledningsevne | 13,9 · 106 S/m | ||
| Termisk konduktivitet | 102,4 W/(m · K) | ||
Kalium eller kali (foreldet form) er et grunnstoff med kjemisk symbol K og atomnummer 19.
Historie
Kalium ble oppdaget i 1807 av den britiske kjemikeren Humphry Davy, og var det første metallet som ble fremstilt ved elektrolyse. Davy utvant stoffet fra pottaske (kaliumkarbonat) og kunngjorde sin oppdagelse til The Royal Society i London 19. november samme år.
Den engelskspråklige betegnelsen «potassium» er avledet av ordet potash. Navnet kalium ble innført i 1796 av den tyske kjemikeren Martin Heinrich Klaproth, og kommer fra arabisk al-qali som betyr «fra aske».
Egenskaper
Kalium er et svært mykt materiale som lett kan skjæres med kniv. Ved kontakt med luft oksideres det raskt, og det oppbevares derfor ofte i parafin. Hvis det kommer i kontakt med vann reagerer det voldsomt, under dannelse av hydrogen. Ved flammetest avgir kalium en fiolett flamme.
Isotoper
Naturlig forekommende kalium består av 3 isotoper, 2 stabile: 39K (93,2581 %) og 41K (6,7302 %) samt 1 ustabil (og dermed radioaktiv): 40K (0,0117 %) med halveringstid 1,277 • 109 år. I tillegg finnes 22 kunstig fremstilte ustabile isotoper hvorav de mest stabile er 43K med halveringstid 22,3 timer, 42K med halveringstid 12,36 timer, 44K med halveringstid 22,13 minutter og 45K med halveringstid 17,3 minutter. Alle de resterende isotopene har halveringstider kortere enn 10 minutter, og de fleste kortere enn 1 minutt.[1]
CAS-nummer: 7440-09-7
Forekomst

Kalium utgjør ca. 2 % av jordskorpen, og kommer som nummer 8 i rekken av de vanligste grunnstoffene. Stoffet finnes imidlertid ikke naturlig i ren form på grunn av at det så lett reagerer med andre grunnstoffer. Kalium forekommer i naturen i bl.a. mineralene karnalitt, kainitt, kalifeltspat og sylvin.
Anvendelse
Kaliumdamp brukes i flere typer magnetometer. Legeringen med natrium (NaK) er flytende, og brukes til å transportere varmeenergi. Kaliumsalt (kaliumklorid) brukes som erstatning for bordsalt (natriumklorid).[2] De fleste typer kunstgjødsel inneholder kaliumklorid.
Biologisk betydning
Kalium er viktig for alle levende celler. Natrium pumpes ut av cellene og resulterer i at kalium strømmer inn i cellene. Ved flere alvorlige sykdomstilstander fungerer natriumpumpen dårlig og det strømmer kalium ut av cellene. For høyt nivå av kalium, kalt hyperkalemi, kan være dødelig. For lavt nivå kalium, kalt hypokalemi, kan også være dødelig. Normal konsentrasjon av kalium i blodplasma hos mennesker er 3,6–5,0 mmol/L. Lett hypokalemi tilsvarer en konsentrasjon på 3,0–3,5 mmol/L; moderat hypokalemi tilsvarer en konsentrasjon på 2,5–2,9 mmol/L; alvorlig hypokalemi, tilsvarer en konsentrasjon <2,5 mmol/L. Periodisk hypokalemisk paralyse er en sjelden genetisk sykdom som karakteriseres av at mengden kalium i blodet synker og gir lammelser.
Referanser
- ^ Lawrence Berkeley National Laboratory – Isotoptabell for kalium Arkivert 11. mai 2008 hos Wayback Machine.
- ^ «Arkivert kopi». Arkivert fra originalen 19. oktober 2013. Besøkt 15. oktober 2013.

















