LabLynx Wiki
Innhold
- For romanen med samme navn, se Bly (roman)
| Bly | |||
|---|---|---|---|
 | |||
| Basisdata | |||
| Navn | Bly | ||
| Symbol | Pb | ||
| Atomnummer | 82 | ||
| Utseende | gråhvit | ||
| Plass i periodesystemet | |||
| Gruppe | 14 | ||
| Periode | 6 | ||
| Blokk | p | ||
| Kjemisk serie | metall | ||
| Atomegenskaper | |||
| Atomvekt | 207,2 u | ||
| Empirisk atomradius | 180 pm | ||
| Kalkulert atomradius | 154 pm | ||
| Kovalent atomradius | 147 pm | ||
| Elektronkonfigurasjon | [Xe] 4f14 5d10 6s2 6p2 | ||
| Elektroner per energinivå | 2, 8, 18, 32, 18, 4 | ||
| Oksidasjonstilstander | +4, +2 | ||
| Krystallstruktur | kubisk flatesentrert | ||
| Fysiske egenskaper | |||
| Stofftilstand | fast stoff | ||
| Smeltepunkt | 327,46 °C | ||
| Kokepunkt | 1749 °C | ||
| Molart volum | 18,26 · 10-6 m³/mol | ||
| Tetthet | 11 340 kg/m³ | ||
| Hardhet | 1,5 (Mohs skala) | ||
| Fordampningsvarme | 179,5 kJ/mol | ||
| Smeltevarme | 4,77 kJ/mol | ||
| Damptrykk | 4,21 · 10-7 Pa ved 600 K | ||
| Lydfart | 1 200 m/s | ||
| Diverse | |||
| Elektronegativitet etter Pauling-skalaen | 2,33 | ||
| Spesifikk varmekapasitet | 129 J/(kg · K) | ||
| Elektrisk ledningsevne | 4,84 · 106 S/m | ||
| Termisk konduktivitet | 35,3 W/(m·K) | ||
Bly er et grunnstoff med kjemisk symbol Pb og atomnummer 82.
Historie
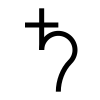
Bly har vært kjent for mennesker i over 7 000 år. Bly er et vanlig grunnstoff i store deler av verden, i tillegg er det relativt lett å utvinne. Bly er også mykt, og derfor lett å bearbeide. Bly har tidligere blitt brukt i vannrør, dette var særlig vanlig i Romerriket (det engelske ordet for rørlegger - plumber - stammer fra bruken av bly - latinsk: plumbum - til vannrør). Siden 1980-tallet har man forsøkt å redusere bruken av bly på grunn av de alvorlige helsefarene. Bly brukes derfor ikke lenger i bensin, maling eller i vannrør.

Egenskaper
Bly er et mykt, tungt og giftig metall med en matt, grå farge. Det regnes som tungmetall, og har det høyeste atomnummeret av de stabile grunnstoffene. Til tross for at bly er et metall er det en dårlig elektrisk leder. Bly oksiderer meget langsomt i tørr luft eller oksygenfritt vann. I fuktig luft dannes et beskyttende sjikt av blyoksid. I oksygenholdig vann løses bly sakte opp. Blys mekaniske styrke kan lett økes ved å legere det med andre metaller, som for eksempel antimon.
Isotoper
Naturlig forekommende bly består av 4 isotoper, hvorav 3 er stabile: 206Pb (24,1 %), 207Pb (22,1 %) og 208Pb (52,4 %), og 1 er ustabil (og dermed radioaktiv): 204Pb (1,4 %) med halveringstid 1,4 · 1017 år. Den lange halveringstiden gjør at 204Pb ofte blir betraktet som stabil. I tillegg finnes 34 kunstig fremstilte ustabile isotoper, hvorav de mest stabile er 205Pb med halveringstid 1,53 · 107 år, 202Pb med halveringstid 52 500 år, 210Pb med halveringstid 22,3 år og 203Pb med halveringstid 51,873 timer. Alle de resterende isotopene har halveringstider kortere enn 1 døgn, og de fleste kortere enn 1 time.[1]
CAS-nummer: 7439-92-1
Forekomst

Bly forekommer sjelden i ren form naturlig, men finnes i noen mineraler som galenitt (blyglans), cerusitt (blykarbonat), krokoitt (blykromat) og anglesitt (blysulfat). Naturlig forekommende bly er toverdig.
Den viktigste kommersielle kilden til produksjon av «nytt» bly er blyglans, men gjenvinning sto for 76 % av blyforbruket i USA i 2007. Det ble i 2007 produsert 3 550 tonn bly med Kina som den største produsenten (1 320 tonn), fulgt av Australia, USA og Peru. Verdens bly-reserver anslås til 1,5 milliarder tonn.[2]
Anvendelse
Nåværende:
- Brukes som søkke i fiskeredskap.
- Brukes i blybatterier, som blant annet benyttes i kjøretøy.
- Brukes som fargestoff i keramikk.
- På grunn av den høye tettheten brukes bly ofte i ammunisjon.
- Brukes som beskyttelse mot radioaktiv stråling.
- Blir ofte brukt som medie i kulemøller pga. tyngden og at det ikke slår gnister.
- Bly brukes som tilsetningsstoff i krystallglass (blyglass).
- Brukes i enkelte sjøkabler.
- Brukes i loddetinn, som er en legering med tinn og andre metaller
Tidligere:
- Har blitt brukt som tilsetningsstoff (oktanforhøyer og ventilsmøring) i bensin.
- Ble tidligere brukt som fargestoff i blymaling.
- Ble brukt til å lage vannrør, særlig vanlig i Romerriket.
- Ble brukt som søkke i skipsankere i Romerriket.
Helseeffekter
Bly er et giftig metall som kan gi alvorlige nerve- og hjerneskader, siden bly hindrer signaloverføring mellom nervetrådene. Blyforgiftning er også nevnt som en mulig årsak til schizofreni. Stoffet tas lettere opp av barn enn av voksne. Bly akkumuleres i beinbygningen, og har svært lang utskillelsestid.
Blyeddik (også kalt blysukker eller blyacetat) er et giftig stoff med søt smak. Blyeddik ble faktisk brukt som søtningsstoff i vin hos romerne, og er nevnt som en årsak til at flere av de romerske keiserne hadde demenssymptomer.

















