LabLynx Wiki
Obsah
| Fosgen | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | karbonylchlorid dichlorid karbonylu |
| Triviální název | fosgen |
| Ostatní názvy | oxychlorid uhličitý chlorid kyseliny chlormethanové dichlorid kyseliny uhličité |
| Anglický název | Carbonyl chloride, Phosgene |
| Německý název | Carbonylchlorid, Phosgen |
| Funkční vzorec | COCl2 |
| Sumární vzorec | CCl2O |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 75-44-5 |
| EC-no (EINECS/ELINCS/NLP) | 200-870-3 |
| Indexové číslo | 006-002-00-8 |
| SMILES | O=C(Cl)Cl |
| Číslo RTECS | SY5600000 |
| Vlastnosti | |
| Molární hmotnost | 98,916 g/mol |
| Teplota tání | −127,76 °C (155 K) |
| Teplota varu | 8,3 °C (281 K) |
| Hustota | 1,4 g/cm3 (8,3 °C/kapalina) 0,004 g/cm3 (25 °C, plyn) |
| Kritická teplota Tk | 182 °C |
| Kritický tlak pk | 5,67 MPa |
| Rozpustnost ve vodě | hydrolýza (vzniká HCl a CO2) |
| Rozpustnost v nepolárních rozpouštědlech | dobře rozpustný |
| Tlak páry | 161,6 kPa (20 °C) |
| Měrná magnetická susceptibilita | −6,08×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | čtverečná (pevná látka) |
| Hrana krystalové mřížky | a=1 582 pm, c=572 pm |
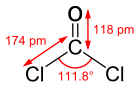
| Tvar molekuly | Planární |
| Dipólový moment | 3,9×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −219,26 kJ/mol |
| Standardní slučovací Gibbsova energie ΔGf° | −206,08 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H330 H314 |
| R-věty | R26, R34 |
| S-věty | S9, S26, S36/37/39, S45 |
| NFPA 704 |  0
4
1
|
| Teplota vznícení | Není vznítitelný |
Některá data mohou pocházet z datové položky. | |
Fosgen (nazývaný též dichlorid karbonylu, chlorid karbonylu, karbonyldichlorid, karbonylchlorid, oxychlorid uhličitý, chlorid kyseliny chlormethanové nebo dichlorid kyseliny uhličité) je prudce jedovatý, dusivý bezbarvý plyn, mnohem nebezpečnější než chlor. Když je velmi silně zředěn, zapáchá jako shnilé brambory.
Příprava
Vzniká slučováním oxidu uhelnatého s chlorem za teploty od 130 °C do 150 °C za přítomnosti katalyzátoru, kterým je v této reakci aktivní uhlí nebo houbovitá platina
- CO + Cl2 → COCl2,
případně pomaleji působením světla, zejména ultrafialového, na uvedenou směs plynů.
Může vznikat také fotochemickým rozkladem chlorovaných uhlovodíků, např. dichlormethanu nebo tetrachlormethanu. Vzniká i při tepelném rozkladu těchto látek.[2]
Chemické reakce
Působením vody se za normální teploty zvolna, za zvýšené teploty rychleji, hydrolyzuje za vzniku kyseliny chlorovodíkové a kyseliny uhličité resp. oxidu uhličitého
- COCl2 + 2 H2O → H2CO3 + 2 HCl,
- COCl2 + H2O → CO2 + 2 HCl.
Působením některých kovů v práškové podobě, např. zinku nebo cínu se rozkládá na chlorid příslušného kovu a oxid uhelnatý
- COCl2 + Zn → ZnCl2 + CO.
S organickými alkoholy reaguje za vzniku esterů kyseliny uhličité, např. reakcí s ethanolem
- COCl2 + 2 C2H5OH → (C2H5O)2CO + 2 HCl
vzniká diethylester kyseliny uhličité a chlorovodík.
Reakcí s alkeny (olefiny) vznikají chloridy chlorovaných karboxylových kyselin, např. adicí fosgenu na ethen (ethylen)
- COCl2 + H2C=CH2 → Cl–CH2–CH2–COCl
vzniká chlorid kyseliny 3-chlorpropanové.
Použití
Vysoká reaktivita fosgenu, který snadno uvolňuje aktivní (atomární) chlor, se využívá v organické syntéze k přípravě chlorovaných derivátů, případně k vnášení karbonylové skupiny –CO– do organických sloučenin.
Za první světové války byl použit jako bojový plyn.
Jedovatost

Hlavním cílovým orgánem jsou plíce. Fosgen dráždí kůži a zejména oči. Není známo, že by docházelo k systémové absorpci, při kontaktu s tkání probíhá ihned hydrolýza.[2]
Proces hydrolýzy je hlavní příčinou jedovatého účinku na lidský organizmus; ve styku s vlhkostí sliznic se podle uvedených rovnic rozkládá (případně může být rozkladným produktem také chlor). Rozkladné produkty reagují s volnými aminoskupinami –NH2, hydroxylovými skupinami –OH nebo sulfhydrylovými skupinami –SH v molekulách bílkovin v buněčných membránách. Oba efekty vedou k porušení membrán oddělujících v plicích vzduch od krve a v konečném důsledku ke vzniku plicního edému, který bývá příčinou smrti.[2]
Koncentrace 500 až 800 ppm je smrtelná (LD50) při expozici po dobu 1 minuty. Koncentrace 200 ppm může procházet přes bariéru vzduch-krev a způsobovat srážení krve. Koncentrace nad 50 ppm se považují za téměř jistě smrtelné. Při koncentracích 2–5 ppm se projeví příznaky otravy, dlouhé expozice mohou být životu nebezpečné. Koncentrace 0,5 ppm po dobu 2 hodin vyvolává u potkanů zřetelné změny v plicní tkáni.[2]
Po expozici může být bezpříznakové období trvající 30 minut až 24 hodin. Pokud otrávený přežije 2–3 dny, je další prognóza dobrá. Zotavení po otravě bývá dlouhé, plná funkce plic se obnovuje řadu týdnů, úplné vyléčení trvá i několik let. Některé příznaky (kašel, dechová nedostatečnost) mohou i poté přetrvávat. Otrava fosgenem může zhoršit průběh pozdějšího onemocnění chřipkou.[2]
Historie
Fosgen poprvé připravil v roce 1812 anglický chemik John Davy. V roce 1917 v průběhu první světové války použila německá armáda v bitvě u Verdunu granáty plněné kapalným fosgenem. Přestože v období před druhou světovou válkou všechny mocnosti vyrobily značné zásoby dělostřelecké munice a leteckých bomb plněných fosgenem, nebyl v průběhu války fosgen již bojově použit. Dnes je považován jako bojový prostředek za zastaralý a byl nahrazen modernějšími bojovými látkami. Vzhledem k jeho snadné dostupnosti (je vyráběn jako surovina pro chemický průmysl) není však vyloučeno jeho zneužití.
Původ jména
Jméno fosgen je odvozeno od řeckých slov fós, φώς (světlo) a gennaó, γεννάω (tvořím), podle způsobu jeho přípravy ze směsi oxidu uhelnatého a chloru působením světla.
Odkazy
Reference
- ↑ a b Phosgene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b c d e Phosgene - International Programme on Chemical Safety - Poisons Information Monograph 419
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu fosgen na Wikimedia Commons
Obrázky, zvuky či videa k tématu fosgen na Wikimedia Commons



















