HL7 Wiki
| Monossido di carbonio | |
|---|---|
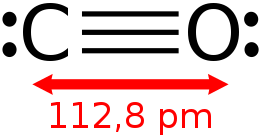 | |
 | |
| Nome IUPAC | |
| monossido di carbonio | |
| Nomi alternativi | |
| ossido di carbonio (II) ossido di carbonio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CO |
| Massa molecolare (u) | 28,04 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 211-128-3 |
| PubChem | 281 |
| DrugBank | DBDB11588 |
| SMILES | [C-]#[O+] |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 1,145 |
| Solubilità in acqua | 0,028 g/l a 293 K |
| Temperatura di fusione | −205 °C (68 K) |
| Temperatura di ebollizione | −192 °C (81 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −110,5 |
| ΔfG0 (kJ·mol−1) | −137,21 |
| S0m(J·K−1mol−1) | 197,7 |
| C0p,m(J·K−1mol−1) | 29,1 |
| Indicazioni di sicurezza | |
| Limiti di esplosione | 12,5 - 74% vol. |
| Temperatura di autoignizione | 605 °C (878 K) |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 331 - 220 - 360d - 372 - 280 |
| Consigli P | 260 - 210 - 202 - 304+340 - 308+313 - 377 - 381 - 405 - 403 [1] |
Il monossido di carbonio (o ossido di carbonio o ossido carbonioso) è un gas incolore, inodore e insapore, leggermente meno denso dell'aria. A seconda della concentrazione e del tempo di esposizione può risultare altamente tossico per gli animali, sia vertebrati che invertebrati, che usano l'emoglobina per trasportare l'ossigeno all'interno dell'organismo; in piccole quantità viene tuttavia prodotto dal normale metabolismo animale e si ritiene svolga alcune normali funzioni biologiche. La sua formula chimica è CO, cioè la sua molecola è formata da un atomo di carbonio e uno di ossigeno legati con triplo legame.
La sua concentrazione nell'atmosfera è variabile e ricopre un ruolo nella formazione dell'ozono a livello del suolo: si miscela bene nell'aria, con la quale forma facilmente miscele esplosive; in presenza di polveri metalliche finemente disperse, forma metallocarbonili tossici e infiammabili; può reagire vigorosamente con ossigeno, acetilene, cloro, fluoro, ossidi di azoto.[2]
Viene prodotto da reazioni di combustione in difetto di aria (cioè quando l'ossigeno presente nell'aria non è sufficiente a convertire tutto il carbonio in anidride carbonica[3]), per esempio negli incendi di foreste e boschi, dove il prodotto principale della combustione rimane comunque l'anidride carbonica; altre fonti naturali sono i vulcani, mentre la maggior parte si genera da reazioni fotochimiche che avvengono nella troposfera; inoltre si sprigiona durante le combustioni in ambienti chiusi[3] e dalle vecchie stufe a gas liquido, responsabili dell'alta frequenza di intossicazione da monossido di carbonio in caso la stufa non abbia efficiente aerazione.[3]
Produzione e usi
Il monossido di carbonio è un prodotto della combustione incompleta dei combustibili organici (ad esempio: carbone, olio, legno, carburanti). Il CO è inoltre un combustibile importante perché rilascia una considerevole quantità di calore quando brucia all'aria, secondo la reazione:
- 2 CO + O2 → 2 CO2
ΔH0gas = -565,53 kJ/mol
Importanti combustibili industriali a base di monossido di carbonio sono il gas d'acqua (una miscela di CO e H2), il gas d'aria (una miscela di CO e N2) e il gas da carbone (miscela di CO, H2, CH4 e CO2, prodotto per distillazione del carbone e conservato nei gasometri). Quest'ultimo era il cosiddetto gas di città, fornito nelle case per cucinare e per il riscaldamento; oggi sostituito dal gas naturale, costituito principalmente da metano (CH4).
Il gas d'acqua viene prodotto facendo passare del vapore su carbone scaldato:
- C + H2O → CO + H2 (gas d'acqua)
La reazione è tuttavia endotermica, è necessario pertanto interrompere il flusso di vapore e insufflare aria per scaldare nuovamente il carbone.
Il gas d'aria si ottiene invece facendo passare aria sul carbone sempre scaldato:
- 2 C + O2 + 4 N2 → 2 CO + 4 N2 (gas d'aria)
Questa reazione è invece esotermica, perciò non occorre riscaldare il carbone come nel caso precedente. Il gas d'acqua ha un potere calorifico maggiore di quello del gas d'aria.
In laboratorio, il CO è prodotto per disidratazione dell'acido formico con acido solforico (H2SO4) concentrato:
- HCOOH → CO + H2O (in presenza di H2SO4)
Il monossido di carbonio è molto reattivo: si combina facilmente con l'ossigeno, lo zolfo e gli alogeni fluoro, cloro e bromo
- CO + 1/2 O2 → CO2
- CO + S → COS
- CO + Cl2 → COCl2 (fosgene o cloruro di carbonile)
Il cloruro di carbonile è estremamente tossico ed è usato come gas asfissiante. È usato anche per ottenere diisocianato di toluene, un intermedio nella preparazione di materie plastiche.
Il CO è inoltre un legante molto importante: può donare un doppietto di elettroni a molti metalli di transizione, formando composti carbonilici. Nel processo Mond ad esempio veniva usato per purificare il nichel, usando gas d'acqua per produrre il CO:
- Ni + 4 CO → Ni(CO)4 (T = 50 °C)
Il nichel tetracarbonile per evaporazione può essere separato dalle impurezze; il nichel viene quindi recuperato decomponendolo per riscaldamento a 250 °C.
Altri usi
Viene inoltre utilizzato per la taratura dei rilevatori di gas domestico, nella fabbricazione di semiconduttori, come conservante e come "effetto speciale" per rendere più lucido il cibo quando deve essere fotografato.
Tossicità

Il monossido di carbonio è un'emotossina, perché legandosi saldamente allo ione del ferro nell'emoglobina del sangue forma un complesso (chiamato carbossiemoglobina) 300 volte più stabile di quello formato dall'ossigeno (chiamato ossiemoglobina),[3] ostacolando così il trasporto di ossigeno nel sangue. Tale affinità scaturisce dalla struttura dei suoi orbitali molecolari: infatti, a differenza dell'ossigeno, non solo cede un doppietto di elettroni al ferro, ma ha anche due orbitali π liberi che possono ricevere ulteriori elettroni dagli orbitali d del ferro, stabilizzando ulteriormente il complesso.
Note
- ^ scheda del monossido di carbonio su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Fonte: "Schede Internazionali di Sicurezza Chimica ICSC0023 Archiviato il 14 novembre 2010 in Internet Archive."
- ^ a b c d Corriere della Sera - Monossido di carbonio
Bibliografia
- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 24-26, ISBN 3-527-30578-5.
- Giorgio Di Domenico, Manuale per la formazione del Volontario della Croce Rossa, Torino, F.lli Scaravaglio & C. Industria Grafica ed Editoriale, 2012, pp. 278-279.
Voci correlate
Altri progetti
 Wikiquote contiene citazioni sul monossido di carbonio
Wikiquote contiene citazioni sul monossido di carbonio Wikimedia Commons contiene immagini o altri file sul monossido di carbonio
Wikimedia Commons contiene immagini o altri file sul monossido di carbonio
Collegamenti esterni
- (EN) carbon monoxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 38028 · LCCN (EN) sh85020121 · GND (DE) 4164521-2 · BNF (FR) cb119582607 (data) · J9U (EN, HE) 987007283485505171 · NDL (EN, JA) 00564272 |
|---|
















