Clinfowiki
Cuprins
| Fier | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Liniile spectrale ale fierului | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații generale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nume, Simbol, Număr | Fier, Fe, 26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie chimică | Metal de tranziție | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupă, Perioadă, Bloc | 8, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitate | 7860 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Culoare | metalic lucios, cu tentă gri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr CAS | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți atomice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masă atomică | 55,845 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază atomică | 140 (156) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază de covalență | 125 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază van der Waals | N/A | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurație electronică | [Ar]4s23d6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electroni pe nivelul de energie | 2, 8, 14, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr de oxidare | 2, 3, 4, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxid | amfolit(d) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structură cristalină | cubică cu volum centrat (a=286.65 pm), între 1185 - 1667 K, cubică cu fețe centrate | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fază ordinară | solid (feromagnetic) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de topire | 1538 °C, 1811 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fierbere | 2861 °C, 3134 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energie de fuziune | 13,81 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energie de evaporare | 340 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viteza sunetului | 5120 m/s la 293.15 K (fier electrolitic) m/s la 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații diverse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitate (Pauling) | 1,83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitate termică masică | 25,10 J/(mol·K) J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate electrică | 9,6×106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate termică | 80,4 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prima energie de ionizare | 762,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 2-a energie de ionizare | 1561,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 3-a energie de ionizare | 2957 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 4-a energie de ionizare | {{{potențial_de_ionizare_4}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 5-a energie de ionizare | {{{potențial_de_ionizare_5}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 6-a energie de ionizare | {{{potențial_de_ionizare_6}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 7-a energie de ionizare | {{{potențial_de_ionizare_7}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 8-a energie de ionizare | {{{potențial_de_ionizare_8}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 9-a energie de ionizare | {{{potențial_de_ionizare_9}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 10-a energie de ionizare | {{{potențial_de_ionizare_10}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cei mai stabili izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unitățile SI și condiții de temperatură și presiune normale dacă nu s-a specificat altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifică |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Fierul este un element chimic metalic, notat cu simbolul Fe (din limba latină: ferrum), ce are numărul atomic 26 și masa atomică 56. Este un metal aflat în prima grupă a metalelor tranziționale. Este elementul chimic cel mai întâlnit pe Terra, formând cea mai mare parte a nucleului acestei planete și este al patrulea element ca abundență în scoarța terestră. Este produs în cantitate mare ca rezultat de fuziune în stelele cu masă mare, unde producerea de nichel-56 (care se dezintegrează în fier) este ultima reacție fuziune nucleară ce este exotermă, devenind ultimul element care se produce înaintea stingerii unei supernove ce duce la reacții ce împrăștie precursorii radionuclizilor fierului în spațiu.
La fel ca și alte elemente ale grupei 8 (ruteniu, osmiu, etc.), fierul prezintă numeroase stări de oxidare, de la -2 la +6, deși cele mai comune sunt +2 și +3. Fierul elementar este întâlnit în meteoriți și unele medii sărace în oxigen, dar este reactiv cu oxigenul și apa. Suprafețele proaspăt tăiate ale fierului au o culoare gri-argintie, sunt lucioase, dar se oxidează în aer, produsul de reacție fiind oxizii de fier, cunoscuți de asemenea sub denumirea de rugină. Spre deosebire de alte metale care realizează pasivarea prin straturi de oxid, oxizii de fier ocupă un volum mai mare ca al volumului de fier, iar astfel oxizii de fier pot fi îndepărtați și să expună suprafețe proaspete pentru coroziune.
Fierul metalic a fost utilizat încă din Antichitate, deși aliajele cu punct scăzut de topire al cuprului au fost folosite primele în istorie. Fierul pur este moale (mai moale decât aluminiul), însă nu se poate obține prin topire. Materialul este întărit de impurități din procesul de topire, precum carbonul. O anumită proporție de carbon (între 0,2% și 2,1%) produce oțelul, care poate fi de 1000 de ori mai rezistent decât fierul pur. Fierul metalic brut este obținut în furnale, unde minereul este redus de către cocs la fonta. O prelucrare ulterioară cu oxigen reduce conținutul de carbon pentru a se obține oțel. Oțelurile și aliajele din fier cu conținut scăzut de carbon, în combinație cu alte metale, sunt de departe cele mai comune metale în industrie, datorită numărului mare de proprietăți dezirabile.
Compușii chimici ai fierului, care includ compuși feroși și ferici, au multe utilizări. Oxidul de fier amestecat cu pudră de aluminiu poate fi aprins pentru a crea termitul, folosit în prelucrarea minereurilor. Formează compuși binari cu halogenii și calcogenii. Printre compușii organometalici, ferocenul a fost primul compus-sandwich descoperit.
Fierul joacă un rol important în biologie, formând substanțe compuse cu oxigen molecular în hemoglobina și mioglobina; acești doi compuși sunt proteine comune ce au rol în transportul oxigenului la vertebrate. De asemenea, fierul este metalul cel mai utilizat în enzimele redox cele mai importante, care sunt implicate în respirația celulară, procesele de oxidare și reducere la organismele vegetale și animale.
Istorie
Începuturile prelucrării fierului
Primul tip de fier cunoscut și utilizat de oameni provenea din meteoriți. În Egipt și Mesopotamia s-au descoperit vărfuri de suliță și obiecte decorative cu această origine, datând din jurul anului 4000 î.Hr.[1] 2000 de ani mai târziu a apărut și fierul prelucrat din minereu (la început cel numit fier de mlaștină - în engleză bog iron sau limonit), folosit însă doar pentru obiecte de cult și considerat mai valoros decât aurul. Între 1600 î.Hr. și 1200 î.Hr. a început obținerea fierului în topitorii primitive, în Imperiul Hitit (Anatolia și Caucaz). Dispariția acestui imperiu a permis răspândirea cunoștințelor despre prelucrarea fierului în toată regiunea, facilitând trecerea de la Epoca Bronzului la Epoca Fierului.
În China

În jurul anului 550 î.Hr., în China a fost inventat furnalul și s-a obținut prima fontă turnată. Prima menționare a unui obiect de fier turnat datează din 513 î.Hr., ceea ce implică faptul că în acea epocă tehnica topirii fierului era cunoscută foarte bine. Vestigii de obiecte de fier turnate (topoare, sape, cuțite, săbii, ...), datând din Perioada Statelor Combatante, au fost descoperite într-o cantitate mare în siturile descoperite după 1950. În situl fostei capitale a statului Yan, în apropiere de Beijing, au fost dezgropate matrițe pentru turnarea unor obiecte de fier. Fonta, mai casantă și mai puțin tăioasă ca bronzul, avea asupra acestuia un avantaj de a putea fi produsă în cantități mari, mai ales în regiunile bogate în minereuri, ca Shanxi sau Shaanxi. Se pare, de altfel, că, datorită combinării între topire și forjare, armele de fier au început, încă din timpul Perioadei Statelor Combatante, să rivalizeze cu armele de bronz, de uz totuși mai general.
Acest avans al Chinei în domeniul siderurgiei a putut să stârnească uimire: chinezii puteau să producă oțel încă din secolul al II-lea î.Hr., în vreme ce Europa, doar la sfârșitul Evului Mediu asistă la primele încercări de turnare a fierului, și după încă ceva timp începe producerea oțelului. Acest decalaj, care mai mult decât un avans sau o rămânere în urmă relevă originalitatea tradițiilor tehnice ale diferitelor civilizații, se explică foarte bine prin experiența acumulată de lumea chineză în turnarea bronzului și prin perfecționarea foalelor, în Perioada Statelor Combatante.[2]
În India

Oțelul, aliaj al fierului cu relativ puțin carbon, a fost produs, se pare, pentru prima dată în India, în secolul al III-lea. Un exemplu al măiestriei indiene în domeniul metalurgiei este și faimoasa coloană de fier din Delhi, care este constituită în proporție de 98% din fier forjat și a fost ridicată la sfârșitul secolului al IV-lea sau începutul secolului al V-lea[3].
În Europa
În Europa, primele șarje de fontă turnată au fost obținute în Suedia, în secolul al XV-lea (Lapphyttan și Vinarhyttan). Ghiulele de tun din fontă au permis apoi răspândirea acestui material și a metodelor de obținere în toată lumea. Combustibilul de bază pentru aceste procese era cărbunele de lemn (mangalul).
Dispariția accentuată a pădurilor din Marea Britanie a dus în secolul al XVIII-lea la înlocuirea mangalului cu cocsul, de către Abraham Darby. Acest lucru, împreună cu inventarea mașinii cu abur, a dus la Revoluția industrială[4].
La sfârșitul anilor 1850, Henry Bessemer a inventat un nou procedeu de fabricare a oțelului cu conținut foarte scăzut de carbon, la care se sufla aer prin fonta brută topită. Acest progres a dus la diminuarea treptată a producției de fier forjat.

Simbolistică
În Evul Mediu, fierul era asociat cu planeta Marte, cu masculinitatea și cu soliditatea, rezistența. De altfel, în alchimie, simbolul fierului era identic cu cel folosit și în prezent pentru a indica genul masculin și cu cel pentru Marte în astrologie: ♂.
Termenul "de fier" a ajuns să fie folosit pentru a indica ceva de neclintit, de netrecut (de exemplu Cortina de fier), o încercare, provocare deosebită (de exemplu triatlonul "Ironman", om de fier desfășurat în Hawaii) sau, în cazul unor persoane, o voință deosebită (persoane care conduceau "cu o mână de fier", sau "doamna de fier", supranumele fostului prim-ministru al Marii Britanii, Margaret Thatcher).
"Fier" este și denumirea celei de-a patra povestiri din volumul "Sistemul periodic" publicat în 1975 de Primo Levi.
Structură atomică
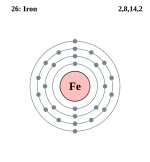
Izotopi
Fierul prezintă patru izotopi naturali. În ordinea abundenței relative, aceștia sunt: 56Fe (91,7 %), 54Fe (5,8 %), 57Fe (2,2 %) și 58Fe (0,3 %). De asemenea, se cunosc alți 10 izotopi sintetici ai fierului. S-a demonstrat (prin corelația existentă între abundența izotopului 60Ni, un produs de dezintegrare al 60Fe, și abundențele izotopilor stabili ai fierului în unii meteoriți) că 60Fe a existat în stare naturală în perioada de formare a sistemului solar.[5]

Proprietăți
Proprietăți fizice
Proprietăți mecanice
| Material | T (MPa) |
BH (Brinell) |
|---|---|---|
| Iron whiskers | 11000 | |
| Oțel întărit | 2930 | 850–1200 |
| Martensitic steel | 2070 | 600 |
| Bainitic steel | 1380 | 400 |
| Oțel perlitic | 1200 | 350 |
| Cold-worked iron | 690 | 200 |
| Small-grain iron | 340 | 100 |
| Fier ce conține carbon | 140 | 40 |
| Cristal de fier pur | 10 | 3 |
Proprietățile mecanice ale fierului și ale aliajelor sale sunt evaluate prin teste variate, precum scala Brinell, scala Rockwell sau teste de tracțiune, printre altele; rezultatele fierului sunt atât de consistente încât fierul este des folosit pentru calibrarea măsurătorilor sau pentru a compara rezultatele unui test cu ale altuia.[7][8] Acele măsurători dezvăluie că aceste proprietăți mecanice ale fierului depind de puritate: cele mai pure cristale de fier sunt mult mai moi decât cele de aluminiu. Adiția a doar 10 părți per milion de carbon le poate dubla duritatea.[6] Duritatea crește rapid cu un conținut de carbon de 0,2% și este saturată la ~0.6%.[9] Fierul produs industrial, care este cel mai pur (aproape 99,99% puritate), are o duritate de 20-30 Brinell.[10]
Proprietăți chimice
Compușii elementului
Fierul formează cu oxigenul combinații divalente și trivalente. Fenomenul de oxidare a fierului se mai numește ruginire.
Oxidul feros, FeO (II), se obține prin arderea directă a fierului. El este stabil doar la temperaturi de peste 833 K (560oC) și este de culoare neagră.
Oxidul feric, Fe2O3 (III), numit și hematit, este un mineral de culoare maronie, obținut prin oxidarea fierului în condițiile existenței unui surplus de oxigen. El reprezintă principala sursă de obținere a fierului.
Oxidul feric-feros, Fe3O4 (II,III), numit și magnetit, este materialul natural cu cele mai bune proprietăți magnetice.
Deși acești oxizi formează straturi protectoare la suprafața pieselor, porozitatea acestor straturi este atât de mare încât obiectele din fier expuse efectelor atmosferei ruginesc continuu până la distrugerea lor completă.
Oxidul feric este opac la radiații ultraviolete și infraroșii, proprietate ce își gasește aplicații la fabricarea geamurilor termoabsorbante.
În combinație cu carbonul, fierul poate forma soluții solide sau carbura de fier Fe3 (numită și cementită). În funcție de temperatură și de conținutul de carbon, soluțiile solide sunt ferita, austenita și ferita δ.
Pentacarbonilul de fier, Fe(CO)5 se obține prin reacția, sub presiune, a fierului cu monoxidul de carbon. Prin descompunerea sa se obține fierul carbonil cu o puritate de 97,5 %. De asemenea, el se folosește pentru obținerea a numeroși compuși ai fierului cu utilizare în sinteza organică.
Tiocianatul de fier, Fe(SCN)3 are o culoare roșie caracteristică și servește la punerea în evidență a ionilor Fe3+.
Diagrama fazelor si alotropia
Fierul este un exemplu de alotropie la un metal, cunoscându-se cel puțin patru forme alotropice ale acestuia, numite α, γ, δ și ε; la presiuni foarte mari, există unele dovezi experimentale considerate controversale pentru o formă β stabilă la temperaturi și presiuni inalte.[11]

Pe măsură ce fierul topit se răcește, acesta se cristalizează la 1538°C în forma sa alotropica δ, care are un cristal cu structura centrată cubic. Continuarea răcirii acestei structuri cristaline, se schimbă la 1394°C, când structura este cunoscută drept fier-γ sau austenit.
Forme alotropice
În funcție de domeniile de temperatură la care sunt stabile și de structura cristalină, este acceptată astăzi existența a 3 stări alotropice ale fierului solid:
- Fierul α are o structură cristalină cubică cu volum centrat și este stabil de la temperatura ambiantă până la temperatura de 1185 K (912oC). Între temperatura ambiantă și temperatura de 1043 K (770oC) (punctul Curie), fierul α este feromagnetic, iar peste 1043 K devine paramagnetic. Din această cauză, inițial formei structurale de fier existente între 1043 K și 1185 K i s-a dat denumirea de fier β. Ulterior s-a renunțat la această denumire întrucât între fierul α și fierul β nu există alte diferențe.
- Fierul γ are o structură cristalină cubică cu fețe centrate și este stabil între 1185 K (912oC) și 1667 K (1394oC).
- Fierul δ are o structură cristalină cubică cu volum centrat și este stabil între 1667 K (1394oC) și temperatura de topire, 1811 K (1538oC).[12]
Notă: La nivel mondial nu s-a ajuns încă la un acord complet în privința poziției exacte a diferitelor puncte caracteristice ale fierului (și nici a punctelor caracteristice din diagrama de echilibru fier-carbon). Valorile indicate aici pentru temperaturi sunt cele întâlnite în monografiile de specialitate uzuale din România.
Răspândire
Ca abundență, fierul este al zecelea element în univers și al 4-lea pe Pământ (al doilea metal, după aluminiu). Ca masă însă, fierul ocupă primul loc pe Pământ. În prezent se consideră că 80% din nucleul interior al Pământului este format din fier. Sub formă de diverse combinații, el formează 5% din scoarța terestră, însă în stare pură se găsește doar accidental (în meteoriți). Se presupune de asemenea că planeta Marte își datorează culoarea roșiatică unui sol bogat în oxid de fier.[13]
Producere
Preparare în laborator
Producere la scară industrială

Datorită reactivității sale mari, în natură fierul se găsește în stare pură doar în cazuri foarte rare, de obicei în meteoriții feroși.
Cele mai des utilizate minereuri de fier sunt hematitul, magnetitul, ilmenitul (FeTiO3), sideritul (FeCO3), limonitul (amestec de goethit - α-FeO(OH) - și lepidocrocit - γ-Fe3+O(OH)) și pirita (FeS2).
Cele mai mari zăcăminte de minereu de fier sunt asociate cu așa-numitele formațiuni feroase în benzi (în engleză: Banded Iron Formations).
Minereurile de fier se exploatează atât în exploatări de suprafață, cât și în mine. Cele mai importante exploatări de suprafață se găsesc în America de Sud (în special în Bolivia și Brazilia), în vestul Australiei, în China, în Ucraina și Canada. În ultimii ani, aceste țări au înlocuit treptat țările cu tradiție în extragerea minereului de fier din mine, cum ar fi Franța, Suedia sau Germania. Cel mai important zăcământ de fier se află la El Mutùn în Bolivia, unde se estimează că există cca. 40 miliarde tone de minereu cu un conținut de fier de peste 50%.[14]
După extragere, minereul se mărunțește și se macină, după care granulele de minereu se sortează după mărime și se sinterizează. Aceasta înseamnă că, sub influența unei călduri foarte mari și cu adaosuri de materiale calcaroase, granulele mici se unesc în bulgări mai mari, poroși. Acest lucru este esențial pentru că, ulterior, granulele fine ar împiedica trecerea normală a curentului de aer prin furnal.
În anul 2000, la nivel mondial au fost produse aproximativ 1 miliard de tone de minereu de fier, valorând cca. 25 miliarde euro. Din această cantitate de minereu s-au obținut aproximativ 572 milioane tone de fontă brută.
Minereurile de fier sunt exploatate în prezent în 48 de țări, primii cinci producători: China, Brazilia, Australia, Rusia și India asigurând 70% din producția mondială totală.

| Rang | Țara | Producția (în mil. t) |
|---|---|---|
| 1 | China | 420
|
| 2 | Brazilia | 280
|
| 3 | Australia | 262
|
| 4 | India | 140
|
| 5 | Rusia | 97
|
| 6 | Ucraina | 69
|
| 7 | SUA | 54
|
| 8 | Africa de Sud | 40
|
| 9 | Canada | 30
|
| 10 | Suedia | 23
|
| - | Total mondial | 1540
|

(Galați, România)
| Rang | Țara | Producția (în mil. t) |
Rang | Țara | Producția (în mil. t) |
|---|---|---|---|---|---|
| 1 | China | 202,3 |
10 | Franța | 13
|
| 2 | Japonia | 82,1 |
11 | Taiwan | 10,3
|
| 3 | Rusia | 48,3 |
12 | Italia | 10,1
|
| 4 | SUA | 39,1 |
13 | Marea Britanie | 10,1
|
| 5 | Brazilia | 32 |
14 | Canada | 8,5
|
| 6 | Ucraina | 29,6 |
15 | Belgia | 7,8
|
| 7 | Germania | 29,5 |
16 | Africa de Sud | 6,2
|
| 8 | Coreea de Sud | 27,3 |
17 | Australia | 6,1
|
| 9 | India | 26,1 |
18 | Olanda | 5,8
|
Pentru o listă mai detaliată a țărilor producătoare, vezi Lista celor mai mari producători de fontă brută.
La scară industrială, fierul este produs pornind de la minereu printr-o reacție de reducere directă cu carbon, la temperaturi de cca. 2000°C, în furnale (cuptoare înalte). Aceasta permite înlăturarea sub influența temperaturilor înalte a componenților neferoși sau pământoși din minereu. În partea superioară a furnalului se introduce minereu de fier, carbon sub formă de cocs și un flux de genul carbonatului de calciu sau a dolomitului, în timp ce prin partea inferioară este însuflat un curent de aer cald. Cocsul reacționează cu oxigenul din curentul de aer, formând monoxid de carbon:
- 6 C + 3 O2 → 6 CO

Monoxidul de carbon reduce minereul de fier (în cazul de jos, hematit), transformându-l în fier topit și devenind bioxid de carbon:
- 6 CO + 2 Fe2O3 → 4 Fe + 6 CO2
Fluxul ajută la topirea impurităților din minereu, în special a bioxidului de siliciu și a silicaților. Sub influența căldurii din furnal, carbonatul de calciu se descompune în oxid de calciu și bioxid de carbon:
- CaCO3 → CaO + CO2
Oxidul de calciu se combină cu bioxidul de siliciu formând o zgură ce se topește la temperatura din furnal (ceea ce nu s-ar fi întâmplat cu bioxidul de siliciu în stare pură):
- CaO + SiO2 → CaSiO3
Zgura topită plutește deasupra fierului topit, mai dens, și aceste componente pot fi evacuate separat prin deschizături speciale în furnal.[17]
Materialul util rezultat este de fapt fontă brută, cu un conținut de cca. 4-5% carbon. Aceasta poate fi redusă în continuare pentru obținerea oțelului sau a fierului tehnic pur, în alte cuptoare sau convertizoare.
Fierul chimic pur se poate prepara prin calcinarea precipitatului de hidroxid feric Fe(OH)3 sau a altor săruri de fier iar la scară industrială prin calcinarea sărurilor de fier cu ușoara tendință de descompunere.
Utilizare

Fierul este în prezent cel mai utilizat metal, cuprinzând 95% din producția mondială de metale, ca și masă. Datorită combinării unei rezistențe înalte cu un preț redus, acesta se folosește în prezent mai ales în cadrul aliajelor, pentru realizarea de diverse piese și structuri.
Alături de cobalt și nichel, fierul este unul dintre cele trei materiale feromagnetice care fac posibilă aplicarea practică a electromagnetismului la generatoare electrice, transformatoare și motoare electrice.
Aliajele fier-carbon sunt materialele cu cea mai largă răspândire în industrie. Ele se împart în oțeluri, cu un conținut de carbon de până la 2,11% și fonte, cu un conținut de carbon mai mare de 2,11%.
Fierul forjat este un produs maleabil care conține mai puțin de 0,2% carbon. Datorită modului de obținere, piesele din fier forjat conțin mici urme, filamente de zgură. Fierul forjat ruginește mai greu, însă a fost înlocuit în prezent în majoritatea aplicațiilor de oțeluri cu conținut scăzut de carbon, care sunt mai ieftine și mai ușor de obținut.
Oțelul nealiat conține între 0,06% și 2,11% carbon, cu mici cantități de mangan, sulf, fosfor și siliciu.
Oțelurile aliate conțin diferite cantități de carbon, dar și alte metale, cum ar fi cromul, vanadiul, molibdenul, nichelul, wolframul etc. Ele au de regulă domenii de utilizare bine precizate, deoarece conținutul de elemente de aliere le crește considerabil prețul. O varietate recentă de oțeluri aliate sunt așa-numitele oțeluri microaliate ce conțin cantități mici de elemente de aliere, însă cu rezistențe și tenacități ridicate, la costuri minime. Oțelurile inoxidabile sunt oțeluri aliate care conțin cel puțin 12% crom.
Fonta brută conține cca. 4-5% carbon și diverse cantități de sulf, siliciu și fosfor. Singura ei importanță tehnică este ca pas intermediar de la minereul de fier la oțel și fonta de turnată.
Fonta turnată conține 2,11% – 6,67% carbon, 1% – 6% siliciu și mici cantități de mangan. Proprietățile sale mecanice variază considerabil în funcție de forma sub care apare carbonul în aliaj. Fontele albe conțin carbonul sub formă de cementită, ceea ce le face dure, dar fragile. Suprafața de rupere a unei fonte albe prezintă numeroase fațete fine de carburi, de culoare foarte deschisă, argintie, care și dau numele materialului. În fonta cenușie, carbonul se găsește sub formă liberă, de grafit, și are de asemenea proprietăți mecanice reduse (deși mai bune decât ale fontelor albe). Variantele mai noi de fontă cenușie, fonta maleabilă și fonta modificată conțin grafitul sub formă de cristale foarte neregulate (grafit în cuiburi), respectiv sub formă sferoidală (grafit nodular), îmbunătățind mult rezistența și tenacitatea materialului.
Feroaliajele sunt aliaje ale fierului cu alte elemente chimice, acestea fiind prezente în procentaje ridicate. Exemple sunt ferosiliciul sau feromanganul; care se utilizează la elaborarea oțelurilor aliate sau a altor aliaje.
Alte aliaje importante sunt cele cu nichel, dintre care se remarcă invarul (36% Ni, rest fier), care caracterizează printr-un coeficient de dilatare termică foarte redus și se utilizează în aplicații unde este nevoie de modificări dimensionale minime în raport cu temperatura.
Oxizii de fier sunt folosiți la fabricarea de medii magnetice pentru stocarea informațiilor. Deseori ei sunt amestecați cu alți compuși, dar își păstrează proprietățile magnetice în soluție.
În medicină se folosesc preparate pe bază de fier ca antianemice.
Rolul elementului în biologie
Fierul este un element esențial pentru aproape toate organismele vii. El este inclus, de regulă în formă stabilă, în metaloproteine, deoarece în formă liberă sau expusă duce la producerea de radicali liberi care în general sunt toxici pentru celule. Fierul se poate combina cu orice tip de biomoleculă și, ca atare, va adera la membrane, acizi nucleici, proteine etc.
Multe animale înglobează fierul în hemuri, o componentă esențială a citocromilor, proteine implicate în reacții redox (incluzând respirația celulară), și a proteinelor purtătoare de oxigen hemoglobina și mioglobina. Fierul anorganic implicat în reacții redox se găsește de asemenea în complexele fier-sulf din multe enzime, cum ar fi nitrogenaza și hitrogenaza. Atunci când organismul se confruntă cu o infecție bacteriană, fierul este "sechestrat" în interiorul celulelor (de obicei în molecula de depozitare feritină) astfel încât să nu poată fi folosit de către bacterii. Fierul absorbit din duoden este legat în transferină și transportat prin sânge către diverse celule, unde este înglobat în proteine prin mecanisme încă neidentificate [18]. Vezi și Metabolismul fierului în organismul uman.
Cele mai bune surse de fier în alimente sunt carnea de porc, peștele, carnea de pui, lintea, fasolea, pătrunjelul, pâinea din făină integrală etc. Urtica urens (urzica) conține o mare cantitate de fier (100 mg fier la 100 g plantă). În schimb, spanacul ca sursă principală de fier este un mit datorat unei greșeli de transcriere a cantității de fier [19].
Măsuri de protecție chimică
Toxicitate
Fierul în cantități excesive este toxic pentru oameni, deoarece reacționează cu peroxizii din corp, producând radicali liberi. Toxicitatea apare atunci când cantitatea de fier o depășește pe cea de transferină necesară pentru legarea fierului liber. O cantitate prea mare de fier ingerată poate leza direct celulele din tractul gastro-intestinal și poate intra în sânge, distrugând celulele care altfel ar restricționa intrarea sa. Odată ajuns în sânge, fierul în exces poate afecta celulele din inimă, ficat (unde poate duce la sideroză) etc., putând duce la deteriorarea organelor respective pe termen lung sau chiar la moarte. De aceea, preparatele pe bază de fier sunt indicate doar în cazul unei deficiențe de fier.[20]
Toxicitatea fierului se manifestă la valori de peste 20 mg de fier pentru fiecare kilogram de masă corporală, 60 mg/kg reprezentând o doză letală [21].
Tratarea medicală a problemelor cauzate de toxicitatea fierului este complexă. Un aspect în acest sens este folosirea deferoxaminei, care leagă și elimină excesul de fier din organism.
Vezi și
- Anemia feriprivă
- Atomium Simbolul orașului Bruxelles, realizat ca model al unei celule elementare de fier
- Coloana de fier din Delhi
- Diagrama de echilibru fier-carbon
- Epoca Fierului
- Magnetit
- Metabolismul fierului în organismul uman
- Metalurgie
- Meteori
- Minereul de fier suedez în al doilea război mondial
- Siderurgie
- Tabelul periodic al elementelor
Referințe
- ^ en Tylecote, R. F., A History of Metallurgy, 2nd Ed., The Institute of Materials, Brookfield, VT, (1992)
- ^ Jacques, Gernet (). Lumea chineză (primul volum). Editura meridiane. p. 97 & 98.
- ^ Alan W. Cramb - Carnegie Mellon University. „A Short History of Metals”. Arhivat din original la . Accesat în .
- ^ en A. Raistrick, A dynasty of Ironfounders (1953; 1989); N. Cox, 'Imagination and innovation of an industrial pioneer: The first Abraham Darby' Industrial Archaeology Review 12(2) (1990), p.127-144
- ^ „Short-lived species in planetary differentiation”. Accesat în .
- ^ a b Kohl, Walter H. (). Handbook of materials and techniques for vacuum devices. Springer. pp. 164–167. ISBN 1563963876.
- ^ a b Kuhn, Howard and Medlin, Dana (prepared under the direction of the ASM International Handbook Committee), ed. (). ASM Handbook – Mechanical Testing and Evaluation (PDF). 8. ASM International. p. 275. ISBN 0871703890.
- ^ „Hardness Conversion Chart”. Maryland Metrics. Arhivat din original la . Accesat în .
- ^ Raghavan, V. (). Materials Science and Engineering. PHI Learning Pvt. Ltd. p. 218. ISBN 8120324552.
- ^ Takaji, Kusakawa; Toshikatsu, Otani (). „Properties of Various Pure Irons : Study on pure iron I”. Tetsu-to-Hagane. 50 (1): 42–47.
- ^ Boehler, Reinhard (). „High-pressure experiments and the phase diagram of lower mantle and core materials”. Review of Geophysics. American Geophysical Union. 38 (2): 221–245. doi:10.1029/1998RG000053. ISSN 1944-9208.
- ^ Mitelea, I., Lugscheider, E., Tillmann W. - Știința materialelor în construcția de mașini. Editura Sudura, Timișoara, 1999
- ^ „Science at NASA - Bringing Mars into the Iron Age”. Arhivat din original la . Accesat în .
- ^ „USGS - Mineral Industry Surveys January 2005” (PDF). Accesat în .
- ^ John D. Jorgenson. „United States Geological Survey - Iron Ore Statistics and Information” (PDF). Accesat în .
- ^ Handelsblatt - Die Welt in Zahlen, Scherz Verlag, 2005
- ^ „Science Aid: Blast Furnace”. Arhivat din original la . Accesat în .
- ^ Tracey A. Rouault. „How Mammals Acquire and Distribute Iron Needed for Oxygen-Based Metabolism”. Accesat în .
- ^ Indiana University School of Medicine,. „Medical Myth: Iron in Spinach”. Arhivat din original la . Accesat în .
- ^ Peter Nielsen. „Einteilung der Eisenüberladung”. Arhivat din original la . Accesat în .
- ^ „Toxicity, Iron”. Emedicine. Accesat în .
Bibliografie
- S. Gâdea, M. Petrescu Metalurgie fizică și studiul metalelor EDP, 1981
Legături externe
- Fierul Arhivat în , la Wayback Machine.
- Fier Arhivat în , la Wayback Machine.
- Anemia_prin_lipsa_de_fier
- en Webelements.com - Fierul
- en Webminerals
- en Producția mondială de fier, pe state
- de Landschaftsmuseum Obermain - Extragerea fierului
| |||||||||||||||||||||||||||||||||||||


















