Clinfowiki
Spis treści

Ciekłe kryształy – faza pośrednia między ciekłym i krystalicznym stanem skupienia materii, którą charakteryzuje zdolność do płynięcia, charakterystyczna dla cieczy i jednocześnie dalekozasięgowe uporządkowanie tworzących ją cząsteczek, podobnie jak to ma miejsce w kryształach[1].
W literaturze fachowej nazwa ciekły kryształ jest często zamieniana terminem mezofaza, który obejmuje jednak także kryształy plastyczne i kryształy condis.
Fizyczne podstawy tworzenia się ciekłych kryształów
W fazie krystalicznej wszystkie cząsteczki są ściśle uporządkowane i nie mają w ogóle swobody ruchu. W fazie ciekłej jest odwrotnie – cząsteczki mają pełną swobodę przemieszczania się w obrębie objętości cieczy i jednocześnie nie są w żaden sposób dalekozasięgowo uporządkowane. Natomiast w fazie ciekłokrystalicznej sytuacja jest pośrednia – cząsteczki mają częściową swobodę ruchu i jednocześnie są częściowo uporządkowane.
Znakomita większość substancji w procesie topnienia wykazuje jednoczesne uwolnienie translacyjnych (czyli dających możliwość przemieszczania się) i rotacyjnych stopni swobody. Dla niektórych cząsteczek (głównie o kształcie zbliżonym do kuli) uwolnienie rotacyjnych stopni swobody następuje jednak wcześniej (w niższej temperaturze), przy czym wykazują one w tej fazie dużą plastyczność, stąd nazwa – kryształ plastyczny. Z drugiej strony bardzo długie i giętkie cząsteczki (np. niektóre polimery) w pewnej temperaturze uzyskują zdolność dynamicznej zmiany swojej konformacji (czyli kształtu), z nadal zablokowanymi translacyjnymi stopniami swobody i są zdolne do generowania tzw. kryształów condis. Kryształy condis i kryształy plastyczne są zaliczane do mezofaz, jednak zwykle nie uznaje się ich za tradycyjne ciekłe kryształy, choć podział ten jest bardzo umowny i różnie interpretowany w różnych opracowaniach.
Fazę ciekłokrystaliczną sensu stricto mogą generować długie, sztywne cząsteczki podobne do prętów lub sztywne i płaskie cząsteczki podobne do dysków, czyli takie, które posiadają anizotropię kształtu. Cząsteczki takie wcześniej wykazują topnienie translacyjne, z zachowaniem zablokowania wszystkich lub części rotacyjnych stopni swobody. Powoduje to, że wszystkie ciekłe kryształy cechuje brak uporządkowań dalekiego zasięgu środków ciężkości molekuł (jak w cieczy), ale równocześnie dalekozasięgowe orientacyjne uporządkowanie molekuł (cecha kryształu).

|

|
| Mezogen prętopodobny | Mezogen dyskopodobny |
Jest wiele rodzajów faz ciekłokrystalicznych. Aby zrozumieć mechanizm ich tworzenia najlepiej jest się przyjrzeć najprostszej z nich zwanej fazą nematyczną.
W fazie tej pręto- lub dyskopodobne cząsteczki mają zablokowaną możliwość zmieniania kąta ułożenia jednej ze swoich osi względem innych cząsteczek, co powoduje, że cząsteczki układają się samorzutnie osiami równolegle do siebie:
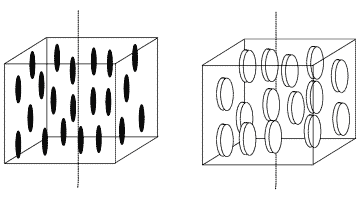
Mają one jednak nadal swobodę przemieszczania się w całej objętości cieczy. Skłonność układania się cząsteczek w ten, a nie inny sposób, wynika ze złożonych oddziaływań termodynamicznych między nimi, dodatkowo wzmacnianych przez siły Van Der Waalsa. Takie ułożenie cząsteczek zmienia szereg własności cieczy powodując, że wykazuje ona np. dwójłomność optyczną podobnie jak typowe kryształy.
Systematyka ciekłych kryształów
Liotropowe i termotropowe
Faza ciekłokrystaliczna może być generowana na dwa sposoby:
- poprzez ogrzewanie stałych kryształów – jest nazywana wtedy mezofazą termotropową. Kryształy, zamiast od razu topić się w zwykłą ciecz, przechodzą w pewnej określonej temperaturze w stan mezofazy, a dopiero w wyższej temperaturze następuje izotropizacja mezofazy, czyli zamiana ciekłych kryształów w ciecz izotropową. W zależności od rodzaju ciekłego kryształu może on przechodzić przez różne mezofazy, w miarę obniżania temperatury.
- poprzez rozpuszczanie cząsteczek mających tendencję do tworzenia mezofazy w odpowiednim rozpuszczalniku – faza jest nazywana wtedy mezofazą liotropową. W układzie takim rozpuszczone pręto- lub dyskopodobne cząsteczki tworzą mezofazę „zmuszając” niejako cząsteczki rozpuszczalnika do uczestniczenia w tej fazie.
Fazy termotropowe
Mezofazy termotropowe dzieli się na trzy główne klasy:
- fazę nematyczną – już wyżej opisaną – oznaczaną symbolem N,
- fazę smektyczną, w której oprócz równoległego uporządkowania osi cząsteczek wzdłuż direktora, istnieje też dodatkowe uporządkowanie w warstwy, oznaczaną symbolem S,
- fazę kolumnową, którą generują zwykle cząsteczki dyskopodobne – tutaj oprócz równoległego uporządkowania osi cząsteczek, cząsteczki układają się jeszcze w kolumny – tak jak np. monety w kasie. Fazy kolumnowe są oznaczane literą D,
- fazę cholesterolową, w której uporządkowanie jest związane ze skręceniem o określony kąt przy przechodzeniu między warstwami, czyli ich direktor nie jest linią prostą, lecz układa się w kształt helisy. Faza cholesterolowa jest w istocie podtypem fazy nematycznej. Fazę cholesterolową nazywa się też często fazą nematyczną skręconą i oznacza symbolem N*.
Fazy smektyczne

|
| Faza SmA |
Fazy smektyczne podzielić można dalej na dwa sposoby. Względem stopnia uporządkowania cząstek:
- smektyki cieczopodobne – brak uporządkowania molekuł w warstwach (poza uporządkowaniem środków ciężkości) np.: SmA, SmC,
- smektyki kryształopodobne – wykazujące pozycyjne ułożenie molekuł w warstwie np.: SmB (ułożenie heksagonalne), SmH, SmG, SmE.
Podział ten jednak jest nieco sztuczny, gdyż w istocie stopień uporządkowania molekuł w fazach smektycznych (których jest łącznie kilkadziesiąt) zmienia się płynnie od układów bardziej cieczopodobnych do bardziej kryształopodobnych.

|
| Faza SmC |
Drugi podział, wynika z orientacji warstw smektycznych, względem direktora:
- smektyki ortogonalne: direktor jest prostopadły do powierzchni warstw (SmA, SmB, SmE),
- smektyki pochylone (nieortogonalne) direktor przecina powierzchnie warstw pod kątem innym niż 90° (SmC, SmG, SmH). Nazwa pochodzi od tego, że w fazach tych, prętopodobne cząsteczki są „pochylone” w warstwach, w stosunku do płaszczyzny warstw.
Fazy kolumnowe

|
| Faza Dh |
Fazy kolumnowe tworzą się poprzez układanie się cząsteczek o kształcie dysków w długie kolumny, przypominające trochę stosy monet. Kolumny te mogą być dodatkowo zorganizowane w rodzaj siatki, której rodzaj jest podstawą podziału faz kolumnowych:
- faza kolumnowa heksagonalna (Dh) występuje najczęściej; w fazie tej kolumny układają się w siatkę, w której komórka elementarna przyjmuje kształt sześciokąta foremnego,
- faza kolumnowa rombowa (Drh), w której komórka elementarna siatki kolumn przybiera kształt rombu,
- faza kolumnowa kwadratowa (Dsq), najrzadziej spotykana, w której komórka elementarna przybiera kształt kwadratu.
Oprócz tego cząsteczki dyskopodobne mogą też generować mezofazę nematyczną i niektóre mezofazy smektyczne.
Fazy skręcone (chiralne)
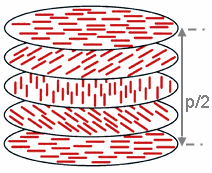
Smektyki pochylone mogą dodatkowo posiadać, podobnie jak to jest w przypadku fazy nematycznej, swoje wersje „skręcone”, w których direktor nie jest linią prostą, lecz helisą. Analogicznie do fazy nematycznej skręconej (cholesterolowej) – fazy smektyczne skręcone oznacza się symbolem wyjściowej fazy z dodaną gwiazdką (SmC*, SmH* itd). Smektyki ortogonalne z natury rzeczy nie posiadają swoich odpowiedników skręconych, gdyż łatwo można dowieść, że jest to niemożliwe geometrycznie. Z faz kolumnowych jedynie faza rombowa może występować w formie skręconej.
Fazy skręcone tworzą cząsteczki chiralne, zaś fazy nie skręcone tworzą cząsteczki niechiralne. Podobnie jak wszystkie cząsteczki chiralne, również chiralne fazy ciekłokrystaliczne skręcają światło spolaryzowane, przy czym kąt skręcenia jest tutaj dużo bardziej zależny od temperatury niż w przypadku związków nie generujących mezofaz.
Fazy liotropowe
Fazy liotropowe, są specyficznym rodzajem emulsji, w której cząsteczki rozpuszczalnika koordynują się względem wstępnie uporządkowanych cząsteczek mezogenu, albo na odwrót, siłą napędową tworzenia się fazy ciekłokrystalicznej jest wymuszanie przez rozpuszczalnik określonego uporządkowania rozpuszczonych w nim mezogenów. Przyjmuje się, że przy wyższych stężeniach mezogenów zachodzi pierwsze zjawisko, a przy niższych drugie. Fazy tworzące się w drugim przypadku opatruje się często mianem faz „odwróconych”. Przejścia od jednych faz do drugich można tu generować zarówno przez zmianę temperatury całego układu, jak i poprzez zmiany stężenia związku generującego.
Cząsteczki zdolne do tworzenia faz liotropowych mają zazwyczaj własności amfifilowe, tzn. posiadają długie łańcuchy, które na jednym końcu są hydrofilowe (a ogólniej liofilowe), a na drugim hydrofobowe (a ogólniej liofobowe). Powoduje to, że w roztworze cząsteczki takie mają skłonność do mikroseperacji i tworzenia złożonych, uporządkowanych układów micelarnych, która jest główną siłą napędową tworzenia się tych faz. Istnieją jednak też przypadki gdy fazy liotropowe są tworzone przez związki nie posiadające własności amfifilowych.
Ze względu na to, że tworzenie się faz liotropowych zależne jest od bardzo subtelnych oddziaływań międzycząsteczkowych, które niezwykle łatwo zaburzyć, badanie własności tych faz jest znacznie trudniejsze od faz termotropowych. Na przykład nawet delikatne wstrząśnięcie naczyniem z roztworem lub zmiana temperatury o 1 °C potrafi zaburzyć strukturę fazy liotropowej, a po ponownym osiągnięciu równowagi układ może przejść do innej fazy.
Fazy liotropowe występują powszechnie w układach biologicznych. Na przykład błona komórkowa jest w gruncie rzeczy bardzo cienką, lamelarną fazą liotropową, tworzoną przez lipidy, która powstaje w naturalny sposób na granicy cytoplazmy z otoczeniem.
Podział faz liotropowych
Podział faz liotropowych jest bardzo skomplikowany, ze względu na złożone, przestrzenne struktury, które tworzą się w roztworach. Obecnie znanych jest kilkaset różnych faz liotropowych. Najczęściej występującymi i najbardziej stabilnymi są fazy heksagonalna i lamelarna. Najbardziej złożone struktury posiadają niestabilne fazy sześcienne – występujące w trakcie przechodzenia układu z jednej fazy stabilnej do drugiej
W wielkim uproszczeniu można je podzielić na:
- fazy w roztworach rozcieńczonych: (gdy w układzie jest duży nadmiar cząsteczek rozpuszczalnika w stosunku do cząsteczek mezogenu),
- wszystkie one mają charakter faz szcześciennych, nieciągłych – w części z nich występują uporządkowane względem siebie sferyczne micele, a w innych występują złożone układy ruropodobnych, rozgałęzionych struktur, których ścianki są zbudowane ze związków amfifilowych – oznaczane są łącznie symbolem Q1,
- fazy w roztworach średnio stężonych:
- liotropowe fazy nematyczne – tworzone przez rozseparowane micele posiadające inny, niż sferyczny kształt i zachowujące się jako całość trochę podobnie do tradycyjnych mezogenów prętopodobnych – oznaczane symbolem Nα,
- fazy heksagonalne – w których występują długie, równoległe do siebie ruropodobne kolumny, które układają się względem siebie na wzór przypominający plaster miodu – oznaczane symbolem Hα,
- pośrednie fazy sześcienne drugiej serii Q2,
- fazy lamelarne – w których związki amififlowe układają się w podwójne warstwy, strukturą podobne do błony komórkowej, między którymi znajduje się cienka warstewka rozpuszczalnika – oznaczane symbolem Lα,
- fazy „odwrócone” w roztworach stężonych (gdy w układzie jest duży nadmiar cząsteczek mezogenu w stosunku do cząsteczek rozpuszczalnika),
- odwrócone fazy sześcienne serii trzeciej Q3,
- odwrócona faza lamelarna Lβ,
- odwrócone fazy sześcienne serii czwartej Q3,
- odwrócona faza heksagonalna Hβ.
Niektóre rodzaje mezogenów są zdolne tworzyć kilka- kilkanaście mezofaz, zależnie od stężenia i rodzaju rozpuszczalnika. Z kolei inne są zdolne tworzyć tylko jeden rodzaj mezofazy przy ściśle określonych warunkach stężenia i temperatury.
Stopień uporządkowania
Dla cząsteczek w każdym rodzaju fazy ciekłokrystalicznej wyróżnić można jeden, główny kierunek orientacji opisywany przez direktor, względem którego molekuły są średnio równoległe. Oprócz tego mogą jednak też występować dodatkowe formy orientacji.
Średni stopień uporządkowania cząstek S, dany wzorem:
gdzie: α – kąt pomiędzy direktorem a długą osią molekuł jest różny w różnych typach mezofazy. Może on przyjmować wartości od 0 (dla cieczy doskonale izotropowej) do 1 (dla doskonałego kryształu).
Tekstury mikroskopowe
Materiały generujące fazy ciekłokrystaliczne posiadają unikalną cechę tworzenia bardzo charakterystycznych tekstur w świetle spolaryzowanym pod mikroskopem optycznym zaopatrzonym w analizator polaryzacji (mikroskop polaryzacyjny). Matematyczno-fizyczna teoria wyjaśniająca tworzenie tego rodzaju tekstur jest bardzo złożona i stale rozwijana (Patrz artykuł Fizyka ciekłych kryształów) Tekstury te, jakkolwiek tłumaczyć ich powstawanie, są bardzo charakterystyczne dla określonego typu mezofazy i może je na tej podstawie szybko rozpoznawać.
Przykłady tekstur:
 |
 |
 |
| *zdjęcia wykonano w CBMiM PAN | ||
Przejścia między mezofazami

Istnieją substancje, które mogą występować w różnych fazach ciekłokrystalicznych w zależności od zmian temperatury, a przy stałej temperaturze tworzyć różne mezofazy pod wpływem zmian proporcji składników mieszaniny. Niektóre mieszaniny związków, przy ściśle określonej ich proporcji posiadają cechy eutektyków, tzn. pozostają w jednej mezofazie w znacznie szerszym zakresie temperatur, niż każdy z nich z osobna. Właśnie tego rodzaju mieszaniny są powszechnie stosowane w wyświetlaczach.
Ponadto niektóre związki mogą wykazywać takie same mezofazy zarówno przy ogrzewaniu, jak i przy ochładzaniu (przemiany enantiotropowe), lub różne mezofazy w zależności od kierunku zmian temperatury (przemiany monotropowe). Zazwyczaj przy ochładzaniu uzyskuje się większą liczbę kolejnych rodzajów ciekłych kryształów, co jest związane ze stopniowym porządkowaniem się molekuł aż do uzyskania sieci krystalicznej.
Więcej na ten temat w artykule Fizyka ciekłych kryształów.
Zastosowania
Ciekłe kryształy termotropowe znajdują szereg zastosowań w różnych dziedzinach m.in.:
- zastosowania własności elektrooptycznych:
- w wyświetlaczach, w których wykorzystuje się eutektyczne mieszaniny związków prętopodobnych, które są zdolne do generowania fazy nematycznej lub SmC*. Mechanizm działania wyświetlaczy opiera się na zmianach kierunku uporządkowania mezofazy pod wpływem przyłożonego pola elektrycznego co powoduje zmianę kierunku dwójłomności światła przechodzącego przez te fazy. Wyświetlacze oparte na fazie nematycznej są monochromatyczne i nie mogą posiadać skali szarości. Wyświetlacze oparte na fazie SmC* mogą być w pełni kolorowe i posiadać szeroką skalę szarości.
- w pamięciach masowych do komputerów, w których zapis informacji odbywa się przez generowanie zmian kierunku uporządkowania przez przyłożenie pola elektrycznego, a kasowanie poprzez proste ogrzanie nośnika powyżej temperatury izotropizacji – tego rodzaju pamięci masowe, ze względu na komplikacje sprzętowe, przegrały jednak z płytami CD w latach 80. XX w.
- w optoelektronice wykorzystuje się tzw. zjawiska nieliniowe – ciekłe kryształy są wykorzystywane jako bramki logiczne oraz generatory i analizatory wyższych harmonicznych światła (SHG), które wielokrotnie zwiększają przepustowość informacyjną światłowodów.
- zastosowania własności termooptycznych – które oparte są na zjawisku zmiany koloru odbijanego światła przez mezofazę N* (cholesterolową) w zależności od temperatury:
- termometry bezrtęciowe – proste w użyciu, ale wciąż bardzo niedokładne termometry w kształcie paska folii.
- indykatory temperatury (zmieniające kolor przy ściśle określonej temperaturze)
- dodatki do farb i emulsji, zmieniających kolor pod wpływem temperatury – są one stosowane jako przyciemniacze szyb samochodowych, farby, którymi pokrywa się zabawki zmieniające barwę w trakcie kąpieli oraz do tworzenia termogramów ciał osób chorych. Chore organy zazwyczaj wykazują większe tempo metabolizmu, co objawia się wzrostem temperatury i uwidocznia poprzez zmianę barwy „pomalowanej” skóry.
Zobacz też
Przypisy
- ↑ kryształ ciekły, [w:] Encyklopedia PWN [online], Wydawnictwo Naukowe PWN [dostęp 2022-11-28].
Bibliografia
- J.W. Goodby, G.W. Gray, Handbook of Liquid Crystals, Wiley-VCH, 1998.
- S. Chandrasekhar, Liquid Crystals, wyd. 2, Cambridge Univ Pr Published, 1993.
- P.G. de Gennes, J. Prost, The Physics of Liquid Crystals, Claredon Press, 1993.
- Tomasz Ganicz, Podstawowe pojęcia, w: Ciekłokrystaliczne karbosilany, dysertacja doktorska, CBMiM PAN, 1995 (źródło większości zdjęć i grafik).


















