Clinfowiki
Innhald
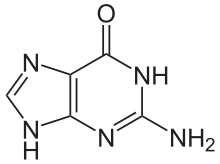
Guanin (ofte forkorta til G eller Gua) er ein av dei fire hovudnukleobasane som finst i nukleinsyrene DNA og RNA. Dei tre andre er adenin, cytosin og tymin (uracil i RNA). I eit DNA-molekyl har guanin parbindingar med cytosin. Guanin har kjemisk formel C5H5N5O, og er avleia av purin, som består av eit samansmelta pyrimidin-imidazol-ringsystem med konjugerte dobbeltbindingar. Nukleosiden til guanin blir kalla guanosin.
Grunnleggande prinsipp
Guanin, adenin og cytosin finst i både DNA og RNA. Tymin finst som regel berre i DNA, og uracil finst berre i RNA. Guanin har to tautomeriske former, den store ketoformen (sjå figurar under) og den sjeldne enolformen. Den bindar til cytosin gjennom tre hydrogenbindingar. I cytosin verkar aminogruppa som ein donor for hydrogenbindingar, og C2-karbonylet og N3-aminen verkar som akseptorar for hydrogenbindingar. Guanin har ei C6-karbonylgruppe som verkar som akseptor for hydrogenbindingar, meda ei gruppe på N1 og ei aminogruppe på C2 verkar som donorar.
Den fyrste isolasjonen av guanin blei rapportert i 1844, og stamma frå den oppsamla avføringa til sjøfuglar, som blei brukt som gjødsel. Guanin fekk namn etter dette stoffet, guano, i 1846.[1] I tida frå 1882 til 1906 klarte Emil Fischer å avleie strukturen, og kunne samstundes vise at urinsyre kunne omgjerast til guanin.[2]
Guanin kan hydrolyserast med sterke syrer til glysin, ammoniakk, karbondioksid og karbonmonoksid. Guanin blir fyrst deaminert til xantin.[3] Guanin oksiderar lettare enn adenin — den andre purinderiverte basen i DNA. Den har eit smeltepunkt på 350°C, og attspeglar med det den sterke intermolekylære hydrogenbindinga mellom okso- og aminogruppene i krystallmolekyla. På grunn av denne bindinga er guanin forholdsvis uløyseleg i vatn, men den kan løysast i fortynna syrer og basar.
Syntese
Spormengder av guanin blir forma ved polymeriseringa av ammoniumcyanid (NH4CN). To eksperiment viste at oppvarminga av 10 mol·L-1 NH4CN ved 80°C i 24 timar gav eit utbytte på 0,0007%, medan 0,1 mol·10-1 NH4CN fryst ved -20°C i 25 år gav eit utbytte på 0,0035%. Desse resultata tyda på at guanin kunne oppstå i frosne områder av den primitive jorda. I 1984 blei det meldt om eit utbytte på 0,00017% etter den elektriske utladinga av NH3, CH4, C2H6 og 50 mL vatn, etterfølgt av syrehydrolyse. Det er likevel ikkje kjent om nærværet av guanin endefram skuldast ei ureining i reaksjonen.[4]
- 10NH3 + 2CH4 + 4C2H6 → 2C5H8N5O (guanin) + 25H2
Ein Fischer-Tropsch-syntese kan brukast for å forme guanin, adenin, uracil og tymin. Oppvarminga av ei ekvimolar gassblanding av CO, H2 og NH3 til 700°C i 15—24 minutt, etterfølgt av snøgg nedkjøling og gjenopptatt oppvarming til 100—200°C i 16—44 timar med ein aluminiumoksidkatalysator, gav guanin og uracil:
- 10CO + H2 + 10NH3 → 2C5H8N5O (guanin) + 8H2O
Ei annan mogleg abiotisk rute blei utforska ved å bråkjøle ei 90% N2 — 10% CO-H2O gassblanding av høgtemperert plasma.[5]
Traubes syntese går ut på å varme 2,4,5-triamino-1,6-dihydro-6-oksypyrimidin (som sulfat) med maursyre i fleire timar.
Sjå òg
Kjelder
- Denne artikkelen bygger på «Guanine» frå Wikipedia på engelsk, den 17. januar 2015.
- Wikipedia på engelsk oppgav desse kjeldene:
- ↑ Guanin blei fyrste gong isolert av Prof. Magnus sin student, B. Unger i 1844. Sjå:
- Paul O. P. Ts'o, Basic Principles in Nucleic Acid Chemistry, vol. 1 (New York, New York: Academic Press, 1974), page 7.
- Magnus (1844) "Ueber das Vorkommen von Xanthicoxyd im Guano" (On the occurance of xanthic oxide in guano), Annalen der Chemie und Pharmacie, 51 : 395-397.
- B. Unger (1846) "Bemerkungen zu obiger Notiz" (Comments on the above notice), Annalen der Chemie und Pharmacie, 58 : 18-20. From page 20: " … desshalb möchte ich den Namen Guanin vorschlagen, welcher an seine Herkunft erinnert." ( … therefore I would like to suggest the name guanine, which is reminiscent of its origin.)
- B. Unger (1846) "Das Guanin und seine Verbindungen" (Guanine and its compounds), Annalen der Chemie und Pharmacie, 59 : 58-68.
- ↑ «Emil Fischer - Biographical».
- ↑ Angstadt. «Purines and pyrimidines». Henta 27. mars 2008.
- ↑ Levy, Matthew; Stanley L. Miller; John Oró (August 1999). «Production of Guanine from NH4CN Polymerizations». Journal of Molecular Evolution 49 (2): 165–8. - quotes the Yuasa paper and cites the possibility of there being a contaminant in the reaction.
- ↑ Miyakawa, S; Murasawa, K.; Kobayashi, K.; Sawaoka, AB. (Desember 2000). «Abiotic synthesis of guanine with high-temperature plasma». Orig Life Evol Biosph. 30 (6): 557–66.






















