Clinfowiki
L'elettronegatività, simbolo χ, è una proprietà chimica che descrive la tendenza di un atomo ad attrarre verso di sé elettroni condivisi.[1] Al livello più elementare, l'elettronegatività è determinata da fattori come la carica nucleare (più protoni ha un atomo, più attrarrà gli elettroni) e il numero e posizione degli altri elettroni presenti nei vari orbitali atomici (più elettroni ha un atomo, più sono lontani dal nucleo gli elettroni di valenza, che saranno quindi soggetti a una minor carica positiva, sia perché più lontani dal nucleo, sia perché schermati dagli altri elettroni presenti negli orbitali a energia inferiore).
Descrizione
L'opposto dell'elettronegatività è l'elettropositività, correlata alla capacità di un atomo di donare elettroni.
Il termine elettronegatività fu introdotto da Jöns Jacob Berzelius nel 1811,[2] sebbene il concetto fosse noto anche prima e fosse stato studiato da molti chimici tra cui Amedeo Avogadro.[2] Nonostante la sua lunga storia, una scala accurata di elettronegatività fu proposta solo nel 1932, quando Linus Pauling nello sviluppare la teoria del legame di valenza propose una scala di elettronegatività basata sulle energie dei legami.[3] È stato dimostrato che l'elettronegatività è correlata con varie altre proprietà chimiche. L'elettronegatività non si può misurare direttamente e deve essere determinata a partire da altre proprietà atomiche o molecolari. Sono stati proposti diversi metodi di calcolo e tutti i metodi danno risultati simili, sebbene con piccole differenze nei valori numerici di elettronegatività. I valori di elettronegatività più comunemente utilizzati restano comunque quelli di Pauling.
L'elettronegatività non è una proprietà di un solo atomo, ma piuttosto una proprietà di un atomo in una molecola.[4] Ci si può aspettare che l'elettronegatività di un elemento possa dipendere in parte dal suo intorno chimico, dal suo stato di ossidazione e dal numero di coordinazione,[5] ma di solito è considerata una proprietà trasferibile, vale a dire che manterrà valori simili anche in specie chimiche molto diverse.
Elettronegatività di Pauling
Nel 1932 Pauling fu il primo a proporre una scala di elettronegatività per spiegare il fatto che il legame covalente tra due atomi diversi (A–B) è più forte di quello che ci si aspetterebbe prendendo la media delle energie dei legami A–A e B–B. Secondo la teoria del legame di valenza, cui Pauling dette notevoli contributi, questa stabilizzazione addizionale dell'energia di un legame eteronucleare è dovuta al contributo di forme ioniche di risonanza, e viene collegata alla differenza di elettronegatività dei due atomi, definita come:
dove i valori di energia di dissociazione di legame Ed dei legami A–B, A–A e B–B sono espressi in elettronvolt, e il fattore (eV)−1⁄2 serve a ottenere un valore adimensionale. Ad esempio, la differenza di elettronegatività di Pauling tra idrogeno e bromo risulta 0,73 (le energie di dissociazione sono H–Br, 3,79 eV; H–H, 4,52 eV; Br–Br 2,00 eV). Dato che in questo modo sono definite solo differenze di elettronegatività, occorre scegliere un punto di riferimento arbitrario per costruire una scala assoluta. L'idrogeno fu scelto come riferimento, dato che forma legami covalenti con moltissimi elementi; il suo valore di elettronegatività fu dapprima fissato a 2,1.[3] In seguito, con la disponibilità di più dati termodinamici, Allred aggiornò i valori dell'elettronegatività di Pauling, ponendo il valore per l'idrogeno a 2,20.[6] Usando questo riferimento gli altri elementi assumono valori compresi tra 0,70 e 3,98. La scala di Pauling risultante è la scala di elettronegatività maggiormente utilizzata, ed è riportata nella tabella seguente:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodo (orizzontale) | |||||||||||||||||||
| 1 | H 2,20 |
He | |||||||||||||||||
| 2 | Li 0,98 |
Be 1,57 |
B 2,04 |
C 2,55 |
N 3,04 |
O 3,44 |
F 3,98 |
Ne | |||||||||||
| 3 | Na 0,93 |
Mg 1,31 |
Al 1,61 |
Si 1,90 |
P 2,19 |
S 2,58 |
Cl 3,16 |
Ar | |||||||||||
| 4 | K 0,82 |
Ca 1,00 |
Sc 1,36 |
Ti 1,54 |
V 1,63 |
Cr 1,66 |
Mn 1,55 |
Fe 1,83 |
Co 1,88 |
Ni 1,91 |
Cu 1,90 |
Zn 1,65 |
Ga 1,81 |
Ge 2,01 |
As 2,18 |
Se 2,55 |
Br 2,96 |
Kr 3,00 | |
| 5 | Rb 0,82 |
Sr 0,95 |
Y 1,22 |
Zr 1,33 |
Nb 1,60 |
Mo 2,16 |
Tc 1,90 |
Ru 2,20 |
Rh 2,28 |
Pd 2,20 |
Ag 1,93 |
Cd 1,69 |
In 1,78 |
Sn 1,80 |
Sb 2,05 |
Te 2,10 |
I 2,66 |
Xe 2,60 | |
| 6 | Cs 0,79 |
Ba 0,89 |
* |
Hf 1,30 |
Ta 1,50 |
W 2,36 |
Re 1,90 |
Os 2,20 |
Ir 2,20 |
Pt 2,28 |
Au 2,54 |
Hg 2,00 |
Tl 2,04 |
Pb 2,33 |
Bi 2,02 |
Po 2,00 |
At 2,20 |
Rn | |
| 7 | Fr 0,70 |
Ra 0,90 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og | |
| Lantanoidi | * |
La 1,10 |
Ce 1,12 |
Pr 1,13 |
Nd 1,14 |
Pm |
Sm 1,17 |
Eu |
Gd 1,20 |
Tb |
Dy 1,22 |
Ho 1,23 |
Er 1,24 |
Tm 1,25 |
Yb |
Lu 1,27 | |||
| Attinoidi | ** |
Ac 1,10 |
Th 1,30 |
Pa 1,50 |
U 1,38 |
Np 1,36 |
Pu 1,28 |
Am 1,30 |
Cm 1,30 |
Bk 1,30 |
Cf 1,30 |
Es 1,30 |
Fm 1,30 |
Md 1,30 |
No 1,30 |
Lr | |||
| (giallo = elemento poco elettronegativo, rosso = elemento molto elettronegativo) | |||||||||||||||||||
Elettronegatività di Mulliken

Nel 1934 Robert Mulliken propose che l'elettronegatività si potesse valutare come media dei valori della prima energia di ionizzazione (Ei) e dell'affinità elettronica (Eea):[8][9]
Questa è una scala assoluta, e i valori assumono le dimensioni dei valori di energia utilizzati per il calcolo. Nella figura a fianco i valori di elettronegatività di Mulliken sono espressi in kJ/mol. Tuttavia è più comune riportarli nella scala di Pauling tramite una trasformazione lineare. Ad esempio, se Ei e Eea sono noti in elettronvolt, si possono convertire le elettronegatività di Mulliken nella scala di Pauling tramite la:[10]
L'elettronegatività di Mulliken ha lo svantaggio che si può calcolare solo per gli elementi di cui sia nota l'affinità elettronica, una grandezza difficile da ottenere. Nel 1988 i valori di elettronegatività di Mulliken sono stati rivisti ed estesi a 50 elementi; questi valori, riportati alla scala di Pauling, sono utilizzati nella tabella seguente.[11]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodo (orizzontale) | |||||||||||||||||||
| 1 | H 2,25 |
He 3,49 | |||||||||||||||||
| 2 | Li 0,97 |
Be 1,54 |
B 2,04 |
C 2,48 |
N 2,90 |
O 3,41 |
F 3,91 |
Ne 4,49 | |||||||||||
| 3 | Na 0,91 |
Mg 1,37 |
Al 1,61 |
Si 1,90 |
P 2,19 |
S 2,69 |
Cl 3,10 |
Ar 3,49 | |||||||||||
| 4 | K 0,73 |
Ca 1,08 |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu 1,49 |
Zn 1,68 |
Ga 2,01 |
Ge 2,33 |
As 2,26 |
Se 2,60 |
Br 2,95 |
Kr 3,00 | |
| 5 | Rb 0,69 |
Sr 1,00 |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag 1,47 |
Cd 1,53 |
In 1,76 |
Sn 2,21 |
Sb 2,12 |
Te 2,41 |
I 2,74 |
Xe 2,73 | |
| 6 | Cs 0,62 |
Ba 0,88 |
* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au 1,87 |
Hg 1,81 |
Tl 1,96 |
Pb 2,41 |
Bi 2,15 |
Po 2,48 |
At 2,85 |
Rn 2,59 | |
| 7 | Fr 0,68 |
Ra 0,92 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og | |
| Lantanoidi | * |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu | |||
| Attinoidi | ** |
Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr | |||
| (giallo = elemento poco elettronegativo, rosso = elemento molto elettronegativo) | |||||||||||||||||||
Elettronegatività di Allred-Rochow

Nel 1958 A. Louis Allred e Eugene G. Rochow proposero di correlare l'elettronegatività alla carica nucleare percepita da un elettrone di valenza (nello strato più esterno di un atomo).[12] La carica nucleare efficace, Zeff, percepita da un elettrone di valenza si può stimare usando le regole di Slater, e l'area superficiale di un atomo si può considerare proporzionale al quadrato del raggio covalente, rcov. Esprimendo rcov in picometri l'elettronegatività di Allred-Rochow si calcola come:[13]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodo (orizzontale) | |||||||||||||||||||
| 1 | H 2,20 |
He 5,50 | |||||||||||||||||
| 2 | Li 0,97 |
Be 1,47 |
B 2,01 |
C 2,50 |
N 3,07 |
O 3,50 |
F 4,10 |
Ne 4,84 | |||||||||||
| 3 | Na 1,01 |
Mg 1,23 |
Al 1,47 |
Si 1,74 |
P 2,06 |
S 2,44 |
Cl 2,83 |
Ar 3,20 | |||||||||||
| 4 | K 0,91 |
Ca 1,04 |
Sc 1,20 |
Ti 1,32 |
V 1,45 |
Cr 1,56 |
Mn 1,60 |
Fe 1,64 |
Co 1,70 |
Ni 1,75 |
Cu 1,75 |
Zn 1,66 |
Ga 1,82 |
Ge 2,02 |
As 2,20 |
Se 2,48 |
Br 2,74 |
Kr 2,94 | |
| 5 | Rb 0,89 |
Sr 0,99 |
Y 1,11 |
Zr 1,22 |
Nb 1,23 |
Mo 1,30 |
Tc 1,36 |
Ru 1,42 |
Rh 1,45 |
Pd 1,35 |
Ag 1,42 |
Cd 1,46 |
In 1,49 |
Sn 1,72 |
Sb 1,82 |
Te 2,01 |
I 2,21 |
Xe 2,40 | |
| 6 | Cs 0,86 |
Ba 0,97 |
* |
Hf 1,23 |
Ta 1,33 |
W 1,40 |
Re 1,46 |
Os 1,52 |
Ir 1,55 |
Pt 1,44 |
Au 1,42 |
Hg 1,44 |
Tl 1,44 |
Pb 1,55 |
Bi 1,67 |
Po 1,76 |
At 1,90 |
Rn 2,06 | |
| 7 | Fr 0,86 |
Ra 0,97 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og | |
| Lantanoidi | * |
La 1,08 |
Ce 1,08 |
Pr 1,07 |
Nd 1,07 |
Pm 1,07 |
Sm 1,07 |
Eu 1,01 |
Gd 1,11 |
Tb 1,10 |
Dy 1,10 |
Ho 1,10 |
Er 1,11 |
Tm 1,11 |
Yb 1,06 |
Lu 1,14 | |||
| Attinoidi | ** |
Ac 1,00 |
Th 1,11 |
Pa 1,14 |
U 1,22 |
Np 1,22 |
Pu 1,28 |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr | |||
| (giallo = elemento poco elettronegativo, rosso = elemento molto elettronegativo) | |||||||||||||||||||
Elettronegatività di Sanderson

Nel 1952 R. T. Sanderson propose una scala di elettronegatività basata sulla densità elettronica relativa.[14][15] Conoscendo le distanze di legame, il modello di Sanderson permette di stimare le energie di legame di varie tipologie di composti,[16][17] ed è stato usato per calcolare la geometria molecolare, le costanti di accoppiamento spin-spin in RMN e altri parametri di composti organici.[18][19] Nonostante ciò, il metodo di Sanderson non ha mai ricevuto grandi consensi.[10]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodo (orizzontale) | |||||||||||||||||||
| 1 | H 2,59 |
He | |||||||||||||||||
| 2 | Li 0,67 |
Be 1,81 |
B 2,28 |
C 2,75 |
N 3,19 |
O 3,65 |
F 4,00 |
Ne | |||||||||||
| 3 | Na 0,56 |
Mg 1,32 |
Al 1,71 |
Si 2,14 |
P 2,52 |
S 2,96 |
Cl 3,48 |
Ar | |||||||||||
| 4 | K 0,45 |
Ca 0,95 |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu 2,03 |
Zn 2,22 |
Ga 2,42 |
Ge 2,62 |
As 2,82 |
Se 3,01 |
Br 3,22 |
Kr | |
| 5 | Rb 0,31 |
Sr 0,72 |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag 1,83 |
Cd 1,98 |
In 2,14 |
Sn 2,30 |
Sb 2,46 |
Te 2,62 |
I 2,78 |
Xe | |
| 6 | Cs 0,22 |
Ba 0,65 |
* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg 2,29 |
Tl 2,25 |
Pb 2,29 |
Bi 2,34 |
Po |
At |
Rn | |
| 7 | Fr |
Ra |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og | |
| Lantanoidi | * |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu | |||
| Attinoidi | ** |
Ac |
Th |
Pa v |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr | |||
| (giallo = elemento poco elettronegativo, rosso = elemento molto elettronegativo) | |||||||||||||||||||
Elettronegatività di Allen

Nel 1989 Leland C. Allen propose una nuova scala di elettronegatività, correlata all'energia media degli elettroni di valenza nell'atomo libero:[20][21][22]
dove εs e εp sono le energie monoelettroniche degli elettroni s e p nell'atomo libero e ns e np sono il numero di elettroni s e p nello strato di valenza. Per ottenere valori numerici di elettronegatività simili a quelli di Pauling si applica un fattore scala, moltiplicando i risultati per 1,75×10−3 se si utilizzano valori di energia in kilojoules, o per 0,169 se i valori di energia sono dati in elettronvolt.
Le energie monoelettroniche si possono determinare direttamente da misure spettroscopiche, e quindi i valori calcolati in questo modo sono chiamati elettronegatività spettroscopica. I dati necessari sono disponibili per quasi tutti gli elementi, e quindi è possibile stimare l'elettronegatività di elementi come il francio, per i quali non sono possibili altri metodi di determinazione. D'altra parte non è chiaro quali siano gli elettroni di valenza degli elementi del blocco d e del blocco f, e quindi la loro elettronegatività di Allen è calcolata in modo ambiguo. In questa scala l'elemento più elettronegativo non è il fluoro, bensì il neon.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodo (orizzontale) | |||||||||||||||||||
| 1 | H 2,300 |
He 4,160 | |||||||||||||||||
| 2 | Li 0,912 |
Be 1,576 |
B 2,051 |
C 2,544 |
N 3,066 |
O 3,610 |
F 4,193 |
Ne 4,787 | |||||||||||
| 3 | Na 0,869 |
Mg 1,293 |
Al 1,613 |
Si 1,916 |
P 2,253 |
S 2,589 |
Cl 2,869 |
Ar 3,242 | |||||||||||
| 4 | K 0,734 |
Ca 1,034 |
Sc 1,19 |
Ti 1,38 |
V 1,53 |
Cr 1,65 |
Mn 1,75 |
Fe 1,80 |
Co 1,84 |
Ni 1,88 |
Cu 1,85 |
Zn 1,59 |
Ga 1,756 |
Ge 1,994 |
As 2,211 |
Se 2,424 |
Br 2,685 |
Kr 2,966 | |
| 5 | Rb 0,706 |
Sr 0,963 |
Y 1,12 |
Zr 1,32 |
Nb 1,41 |
Mo 1,47 |
Tc 1,51 |
Ru 1,54 |
Rh 1,56 |
Pd 1,58 |
Ag 1,87 |
Cd 1,52 |
In 1,656 |
Sn 1,824 |
Sb 1,984 |
Te 2,158 |
I 2,359 |
Xe 2,582 | |
| 6 | Cs 0,659 |
Ba 0,881 |
* |
Hf 1,16 |
Ta 1,34 |
W 1,47 |
Re 1,60 |
Os 1,65 |
Ir 1,68 |
Pt 1,72 |
Au 1,92 |
Hg 1,76 |
Tl 1,789 |
Pb 1,854 |
Bi 2,01 |
Po 2,19 |
At 2,39 |
Rn 2,60 | |
| 7 | Fr 0,67 |
Ra 0,89 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og | |
| Lantanoidi | * |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu | |||
| Attinoidi | ** |
Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr | |||
| (giallo = elemento poco elettronegativo, rosso = elemento molto elettronegativo) | |||||||||||||||||||
Correlazioni tra l'elettronegatività e altre proprietà

Le varie scale di elettronegatività mostrano tutte un analogo andamento nonostante siano determinate in modi diversissimi. Ciò suggerisce che i valori di elettronegatività possano influenzare altre proprietà chimiche, e possano essere utilizzati per discuterne. La prima e più semplice applicazione dell'elettronegatività fu introdotta da Pauling per discutere della polarità di legame. In genere, maggiore è la differenza di elettronegatività tra due atomi legati, maggiore sarà la polarità del loro legame, con l'atomo più elettronegativo che costituisce l'estremità negativa del dipolo. Pauling propose un'equazione (oggi poco usata) per correlare il "carattere ionico" di un legame alla differenza di elettronegatività dei due atomi.[4]
Sono state trattate varie correlazioni tra le frequenze di stiramento di alcuni legami e le elettronegatività degli atomi coinvolti;[23] ciò non sorprende dato che le frequenza di stiramento dipendono parzialmente dalla forza del legame, che serve a calcolare l'elettronegatività di Pauling. Più interessanti sono le correlazioni tra elettronegatività e chemical shift in spettroscopia NMR[24] e tra elettronegatività e spostamento isomerico in spettroscopia Mössbauer (vedi figura).[25] Entrambe queste misure dipendono dalla densità elettronica s sul nucleo, e quindi possono indicare che le differenze di elettronegatività stanno realmente descrivendo "la capacità dell'atomo di attrarre a sé elettroni."[1][4]
Andamenti dell'elettronegatività
Variazioni lungo la tavola periodica
Indipendentemente dalla scala prescelta i valori di elettronegatività mostrano un andamento abbastanza regolare lungo la tavola periodica degli elementi. L'elettronegatività è quindi un esempio di proprietà periodica. In generale i valori di elettronegatività aumentano procedendo da sinistra a destra lungo un periodo, come esemplificato dai seguenti dati relativi agli elementi del periodo 2:
| Elemento | Pauling | Mulliken | Allred-Rochow |
|---|---|---|---|
| Li | 0,98 | 0,97 | 0,97 |
| Be | 1,57 | 1,54 | 1,47 |
| B | 2,04 | 2,04 | 2,01 |
| C | 2,55 | 2,63 | 2,50 |
| N | 3,04 | 2,33 | 3,07 |
| O | 3,44 | 3,17 | 3,50 |
| F | 3,98 | 3,91 | 4,10 |
I valori di elettronegatività inoltre calano procedendo dall'alto verso il basso lungo un gruppo, come illustrato dai seguenti dati relativi agli alogeni:
| Elemento | Pauling | Mulliken | Allred-Rochow |
|---|---|---|---|
| F | 3,98 | 3,91 | 4,10 |
| Cl | 3,16 | 3,00 | 2,83 |
| Br | 2,96 | 2,74 | 2,74 |
| I | 2,66 | 2,21 | 2,21 |
Di conseguenza il fluoro è l'elemento più elettronegativo (escludendo i gas nobili), e il cesio è quasi sempre quello meno elettronegativo. Questo porta spesso a considerare che il fluoruro di cesio sia il composto dove il legame ha il maggior carattere ionico.
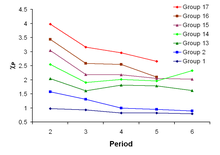
Come mostrato dalla figura, questi andamenti generali presentano delle eccezioni. Gallio e germanio sono più elettronegativi di alluminio e silicio, rispettivamente, a causa della contrazione del blocco d. Gli elementi del periodo 4 subito dopo i metalli di transizione hanno raggi più piccoli di quanto atteso perché gli elettroni 3d non sono molto efficaci nello schermare la carica nucleare crescente, e le dimensioni atomiche piccole portano a valori elevati di elettronegatività (vedi sopra Elettronegatività di Allred-Rochow, Elettronegatività di Sanderson).[7] Anche il piombo presenta un'elettronegatività alta in modo anomalo nelle scale di Pauling e di Mulliken, rispetto a tallio e bismuto, mentre tale anomalia non è presente nelle altre scale.
Variazioni con il numero di ossidazione
In chimica inorganica si considera che ad un dato elemento si possa applicare un singolo valore di elettronegatività, valido nella maggior parte delle situazioni "normali". Questo approccio ha il vantaggio della semplicità, ma va ricordato che l'elettronegatività di un elemento non è una proprietà atomica invariante, e in particolare dipende dalla carica e dallo stato di ossidazione dell'elemento. Come ci si può attendere, ioni positivi sono più elettronegativi del corrispondente atomo neutro, mentre ioni negativi sono meno elettronegativi del corrispondente atomo neutro.[15] Analogamente, l'elettronegatività di un elemento cresce al crescere del suo stato di ossidazione.[5] Attribuire valori numerici precisi è però difficile. Allred usò il metodo di Pauling per calcolare l'elettronegatività per i diversi stati di ossidazione di alcuni elementi (inclusi stagno e piombo) per i quali erano disponibili dati adeguati.[6] Tuttavia per la maggior parte degli elementi questo calcolo non è possibile, dato che non ci sono abbastanza composti covalenti differenti di cui siano note le energie di dissociazione. Questo è il caso in particolare degli elementi di transizione, per i quali i valori di elettronegatività riportati sono inevitabilmente una media su diversi stati di ossidazione, e di conseguenza i rispettivi andamenti dell'elettronegatività sono poco significativi.
Variazioni con l'ibridazione
L'elettronegatività di un atomo cambia anche con l'ibridazione degli orbitali utilizzati nel legame. Gli elettroni in orbitali s sono più legati al nucleo rispetto a elettroni in orbitali p. Quindi, un atomo che utilizza un ibrido spx sarà sempre più polarizzabile al crescere del contributo p. Di conseguenza l'elettronegatività di un atomo in funzione dello schema di ibridazione utilizzato calerà nell'ordine χ(sp) > χ(sp2) > χ(sp3). In generale queste considerazioni valgono per qualsiasi elemento dei gruppi principali, ma vengono utilizzate per lo più per il carbonio (vedi tabella successiva). In chimica organica questi valori di elettronegatività sono invocati per predire o razionalizzare la polarità di legame in composti organici contenenti doppi e tripli legami al carbonio.
| Ibridazione | χ (Pauling)[26] |
|---|---|
| C(sp3) | 2,3 |
| C(sp2) | 2,6 |
| C(sp) | 3,1 |
| C "generico" | 2,5 |
Elettronegatività di gruppo
In chimica organica l'elettronegatività viene associata più a differenti gruppi funzionali che non a singoli atomi.[27][28][29] I termini "elettronegatività di gruppo" o "elettronegatività dei sostituenti" sono usati come sinonimi. In genere si usa distinguere tra effetto induttivo ed effetto di risonanza, che possono essere descritti rispettivamente come elettronegatività σ e π. Esistono varie relazioni con l'energia libera utilizzate per quantificare questi effetti; la più nota è l'equazione di Hammett.
Elettropositività
L'elettropositività è una misura della capacità di un elemento di donare elettroni, formando ioni positivi. È quindi l'opposto dell'elettronegatività. Normalmente questa caratteristica è attribuita ai metalli, considerando che in genere maggiore è il carattere metallico di un elemento, maggiore è la sua elettropositività. Di conseguenza i metalli alcalini sono i più elettropositivi, dato che hanno un singolo elettrone nel livello più esterno e lo possono perdere facilmente. In altre parole questi elementi hanno un'energia di ionizzazione bassa.
Per quanto riguarda gli andamenti nella tavola periodica, l'elettropositività si comporta al contrario dell'elettronegatività. L'elettropositività infatti cala procedendo da sinistra a destra lungo i periodi, e cresce procedendo dall'alto verso il basso lungo i gruppi.
Note
- ^ a b McNaught e Wilkinson 1997
- ^ a b Jensen 1996
- ^ a b Pauling 1932
- ^ a b c Pauling 1960
- ^ a b Greenwood e Earnshaw 1997
- ^ a b Allred 1961
- ^ a b c Wulfsberg 2000
- ^ Mulliken 1934
- ^ Mulliken 1935
- ^ a b Huheey et al. 1999, p. 188.
- ^ a b Bratsch 1988
- ^ Allred e Rochow 1958
- ^ Housecroft e Sharpe 2008
- ^ Sanderson 1952
- ^ a b Sanderson 1954
- ^ a b Sanderson 1983
- ^ Sanderson 1983b
- ^ Zefirov et al. 1987
- ^ Trofimov e Smolenskii 2005
- ^ a b Allen 1989
- ^ a b Mann et al. 2000
- ^ a b Mann et al. 2000
- ^ Bellamy 1958
- ^ Spieseke e Schneider 1961
- ^ Clausen III e Good 1970
- ^ Fleming 2009
- ^ Marriott et al. 1984
- ^ Mullay 1985
- ^ Bratsch 1985
Bibliografia
- (EN) L. C. Allen, Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms, in J. Am. Chem. Soc., vol. 111, n. 25, 1989, pp. 9003-9014, DOI:10.1021/ja00207a003.
- (EN) A. L. Allred e E. G. Rochow, A scale of electronegativity based on electrostatic force, in Journal of Inorganic and Nuclear Chemistry, vol. 5, n. 4, 1958, pp. 264-268, DOI:10.1016/0022-1902(58)80003-2.
- (EN) A. L. Allred, Electronegativity values from thermochemical data, in Journal of Inorganic and Nuclear Chemistry, vol. 17, n. 3-4, 1961, pp. 215-221, DOI:10.1016/0022-1902(61)80142-5.
- (EN) L. J. Bellamy, The Infra-Red Spectra of Complex Molecules, New York, Wiley, 1958, ISBN 978-0-412-13850-8.
- (EN) S. G. Bratsch, A group electronegativity method with Pauling units, in J. Chem. Educ., vol. 62, n. 2, 1985, p. 101, DOI:10.1021/ed062p101.
- (EN) S. G Bratsch, Revised Mulliken electronegativities: I. Calculation and conversion to Pauling units, in J. Chem. Educ., vol. 65, n. 1, 1988, pp. 34-41, DOI:10.1021/ed065p34.
- (EN) C. A. Clausen III e M. L. Good, Interpretation of the Moessbauer spectra of mixed-hexahalo complexes of tin(IV), in Inorg. Chem., vol. 9, n. 4, 1970, pp. 817-820, DOI:10.1021/ic50086a025.
- (EN) I. Fleming, Molecular orbitals and organic chemical reactions, Chichester, Wiley, 2009, ISBN 978-0-4707-4660-8.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica inorganica - principi, strutture, reattività, 2ª ed., Padova, Piccin, 1999, ISBN 88-299-1470-3.
- (EN) W.B. Jensen, Electronegativity from Avogadro to Pauling: Part 1: Origins of the Electronegativity Concept, in J. Chem. Educ., vol. 73, n. 1, 1996, pp. 11-20, DOI:10.1021/ed073p11.
- (EN) J. B. Mann, T. L. Meek e L. C. Allen, Configuration Energies of the Main Group Elements, in J. Am. Chem. Soc., vol. 122, n. 12, 2000, pp. 2780-2783, DOI:10.1021/ja992866e.
- (EN) J. B. Mann, T. L. Meek, E. T. Knight, J. F. Capitani e L. C. Allen, Configuration Energies of the d-Block Elements, in J. Am. Chem. Soc., vol. 122, n. 21, 2000, pp. 5132-5137, DOI:10.1021/ja9928677.
- (EN) S. Marriott, W. F. Reynolds, R. W. Taft e R. D. Topsom, Substituent electronegativity parameters, in J. Org. Chem., vol. 49, n. 6, 1984, pp. 959-965, DOI:10.1021/jo00180a002.
- (EN) J. Mullay, Calculation of group electronegativity, in J. Am. Chem. Soc., vol. 107, n. 25, 1985, pp. 7271-7275, DOI:10.1021/ja00311a008.
- (EN) R. S. Mulliken, A New Electroaffinity Scale; Together with Data on Valence States and on Valence Ionization Potentials and Electron Affinities, in J. Chem. Phys., vol. 2, n. 11, 1934, pp. 782-793, DOI:10.1063/1.1749394.
- (EN) R. S. Mulliken, Electronic Structures of Molecules XI. Electroaffinity, Molecular Orbitals and Dipole Moments, in J. Chem. Phys., vol. 3, n. 9, 1935, pp. 573-585, DOI:10.1063/1.1749731.
- (EN) A. D. McNaught e A. Wilkinson (a cura di), electronegativity, in IUPAC. Compendium of Chemical Terminology (the "Gold Book"), 2ª ed., Oxford, Blackwell Scientific Publications, 1997, DOI:10.1351/goldbook.E01990, ISBN 0-9678550-9-8. Versione online (2019-) di S. J. Chalk
- (EN) L. Pauling, The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms, in J. Am. Chem. Soc., vol. 54, n. 9, 1932, pp. 3570-3582, DOI:10.1021/ja01348a011.
- (EN) L. Pauling, Nature of the Chemical Bond, 3ª ed., New York, Cornell University Press, 1960, ISBN 0-8014-0333-2.
- (EN) R. T. Sanderson, Electronegativities in Inorganic Chemistry, in J. Chem. Educ., vol. 29, n. 11, 1952, pp. 539-544, DOI:10.1021/ed029p539.
- (EN) R. T. Sanderson, Electronegativities in Inorganic Chemistry. (II), in J. Chem. Educ., vol. 31, n. 1, 1954, pp. 2-7, DOI:10.1021/ed031p2.
- (EN) R. T. Sanderson, Electronegativity and bond energy, in J. Am. Chem. Soc., vol. 105, n. 8, 1983, pp. 2259-2261, DOI:10.1021/ja00346a026.
- (EN) R. T. Sanderson, Polar Covalence, New York, Academic Press, 1983, ISBN 978-0-12-618080-0.
- (EN) H. Spieseke e W. G. Schneider, Effect of Electronegativity and Magnetic Anisotropy of Substituents on C13 and H1 Chemical Shifts in CH3X and CH3CH2X Compounds, in J. Chem. Phys., vol. 35, n. 2, 1961, pp. 722-730, DOI:10.1063/1.1731992.
- (EN) M. I. Trofimov e E. A. Smolenskii, Application of the electronegativity indices of organic molecules to tasks of chemical informatics, in Russian Chemical Bulletin, vol. 54, n. 9, 2005, pp. 2235-2246, DOI:10.1007/s11172-006-0105-6.
- (EN) G. Wulfsberg, Inorganic Chemistry, Sausalito, University Science Books, 2000, ISBN 978-1-891-38901-6.
- (EN) N. S. Zefirov, M. A. Kirpichenok, F. F. Izmailov e M. I. Trofimov, Calculation schemes for atomic electronegativities in molecular graphs within the framework of Sanderson principle, in Doklady Akademii Nauk SSSR, vol. 296, 1987, pp. 883-887.
Altri progetti
 Wikizionario contiene il lemma di dizionario «elettronegatività»
Wikizionario contiene il lemma di dizionario «elettronegatività» Wikimedia Commons contiene immagini o altri file sull'elettronegatività
Wikimedia Commons contiene immagini o altri file sull'elettronegatività
Collegamenti esterni
- Elettronegatività, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- Elettronegativita, in Dizionario delle scienze fisiche, Istituto dell'Enciclopedia Italiana, 1996.
- Elettronegatività, su Vocabolario Treccani, Istituto dell'Enciclopedia Italiana.
- elettronegatività, su sapere.it, De Agostini.
- (EN) electronegativity, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Opere riguardanti Electronegativity, su Open Library, Internet Archive.
| Controllo di autorità | LCCN (EN) sh85042246 · GND (DE) 4192165-3 · J9U (EN, HE) 987007538463605171 |
|---|

















![{\displaystyle \chi =0,336\left[{\frac {E_{\rm {i}}+E_{\rm {ea}}}{2}}\ -0,615\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca64a9f16e760aa196514624a4ba6a338147669e)



