Trends in LIMS
Spis treści
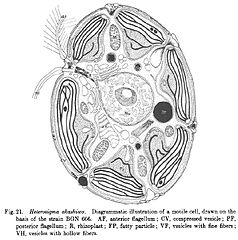 Heterosigma akashiwo | |
| Systematyka[1] | |
| Domena | |
|---|---|
| Supergrupa | |
| Królestwo | |
| Gromada | |
| Klasa |
Rafidofity |
| Nazwa systematyczna | |
| Raphidophyceae Chadefaud ex P.C.Silva Silva, P.C. (1980). Names of classes and families of living algae: with special reference to their use in the Index Nominum Genericorum (Plantarum). Regnum Vegetabile 103: 1-156 | |
Rafidofity, chloromonady (Raphidophyceae) – gromada (klasa) glonów z supergrupy Chromalveolata (Chromista).
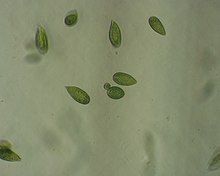
Biologia
Jednokomórkowe organizmy o budowie wiciowca i stosunkowo dużym rozmiarze (50–100 μm). Komórki są spłaszczone grzbieto-brzusznie z wypukłą stroną grzbietową i wypłaszczoną brzuszną z płytką bruzdą. Z wgłębienia pod szczytem komórki wyrastają dwie wici. Wić skierowana ku przodowi pokryta jest mastygonemami, podczas gdy skierowana do tyłu jest gładka. Ta wić umieszczona jest bruździe brzusznej. Jądro komórkowe zawiera bardzo liczne chromosomy i jest otoczone gęstą warstwą cytoplazmy, a tuż nad nim znajduje się aparat Golgiego. Dalej od jądra cytoplazma staje się bardziej płynna i zanurzone są w niej elipsoidalne, spłaszczone chloroplasty z kolistym nukleoidem. Mają one barwę od zielonej do żółtozielonej lub brązowozielonej. Zawierają chlorofile a, c1 i c2 oraz różne ksantofile. Pod błoną komórkową znajdują się pałeczkowate pęcherzyki lub trichocysty wydzielające śluz. Ich błona komórkowa nie tworzy ściany komórkowej[2] i jest bywa bardzo podatna na zniszczenie[3].
Od typowych rafidofitów odróżniają się przedstawiciele podklasy Raphopoda, które są pozbawione chloroplastów[4].
Rozmnażanie przez podział komórki różnego typu, a także płciowe (izogamia)[5].
Ekologia
Glony słodkowodne lub morskie. Obie grupy nieco różnią się m.in. zestawem ksantofili. Słodkowodne rafidofity często występują w wodach kwaśnych[2]. Jeden z pierwszych opisanych i najpowszechniej występujących rafidofitów, Gonyostomum semen, żyje w Europie i Ameryce Północnej, głównie w jeziorach lobeliowych i dystroficznych[3]. Ze względu na wydzielany śluz jest on niechętnie zjadany przez zooplankton, przez co stając się dominantem w fitoplanktonie, powoduje zaburzenie sieci troficznej. Wywoływane przez niego zakwity nie są toksyczne[6], ale kontakt z nimi może wywoływać alergię[5]. Przedstawiciele rodzaju Chatonella zimują w postaci komórek przetrwalnych, z których wczesnym latem kiełkują komórki uwicione. Morskie gatunki mogą tworzyć toksyczne zakwity, jeden z rodzajów czerwonego przypływu, zwłaszcza w częściowo zamkniętych akwenach (lagunach i zatokach). To dotyczy zwłaszcza mórz oblewających Japonię czy Morza Śródziemnego[2]. Zakwity powodowane przez Heterosigma akashiwo wyrządzają szkody w akwakulturze[7].
Systematyka i nazewnictwo
Nieliczna grupa. W systemie AlgaeBase jesienią 2022 r.[a] zarejestrowano 44 gatunki zgrupowane w trzy rzędy lub o nieznanej przynależności do rzędu[1]:
- klasa: Raphidophyceae
- podklasa: Raphopoda
- rząd: Actinophryida
- rząd: Commatiida
- podklasa: (brak wyróżnionej)
- rząd: Chattonellales
- rząd: (brak wyróżnionego, incertae sedis)
- rodzina: Thaumatomastigaceae
- podklasa: Raphopoda
Wśród nich najliczniejszy w gatunki (35) jest rząd Chattonellales, a w nim najliczniejsza jest rodzina Vacuolariaceae licząca 31 gatunków[1].
W XX w. grupę tę określano wymiennie jako chloromonady[8] lub rafidofity. Rzadko stosowana jest forma rafidomonady[9]. Zwykle była traktowana jako grupa wyraźnie wyodrębniona i o niejasnych powiązaniach z innymi grupami glonów w obrębie tzw. wiciowców. Z czasem zauważono podobieństwa niektórych cech do złotowiciowców i różnowiciowców[2]. Nadawano jej różną rangę taksonomiczną, np. rzędu Chloromonadales[10] lub gromady (w ujęciu botanicznym) Chloromonadophyta[8]. Thomas Cavalier-Smith wyróżniał klasę Raphidophyceae, którą następnie przemianował na Raphidomonadea z podklasami Raphidophycidae i Raphopoda[4], umieszczając ją obok chryzofitów i brunatnic, później zaś dodając nadklasę Raphidoistia o takim samym zakresie, co klasa Raphidomonadea[11]. Od końca XX w. grupa ta umieszczana jest w taksonach Ochrophyta i Heterokonta.
Uwagi
- ↑ System ten jest na bieżąco aktualizowany, przez co przedstawiona w nim taksonomia może znacząco, nawet na poziomie przynależności do królestw, się różnić w zależności od daty.
Przypisy
- ↑ a b c M.D. Guiry, Taxonomy Browser Class: Raphidophyceae [online], AlgaeBase.
- ↑ a b c d 10. Heterokontophyta: Class Raphidophyceae, [w:] Christiaan van den Hoek, D.G. Mann, H.M. Jahns, Algae. An introduction to phycology, Cambridge: Cambridge University Press, 1995, s. 160–162, ISBN 0-521-30419-9, OCLC 28182088 [dostęp 2022-09-23].
- ↑ a b Andrzej Hutorowicz i inni, Występowanie Gonyostomum semen (Raphidophyceae) w Polsce, „Fragmenta Floristica et Geobotanica Polonica”, 13 (2), 2006, s. 399–407.
- ↑ a b Thomas Cavalier-Smith, Josephine Margaret Scoble, Phylogeny of Heterokonta: Incisomonas marina, a uniciliate gliding opalozoan related to Solenicola (Nanomonadea), and evidence that Actinophryida evolved from raphidophytes, „European Journal of Protistology”, 49 (3), 2013, s. 328–353, DOI: 10.1016/j.ejop.2012.09.002 [dostęp 2022-09-26] (ang.).
- ↑ a b Rosa Isabel Figueroa, Karin Rengefors, Life cycle and sexuality of the freshwater Raphydophyte Gonyostomum semen (Raphidophyceae), „Journal of Phycology”, 42 (4), 2006, s. 859–871, DOI: 10.1111/j.1529-8817.2006.00240.x [dostęp 2022-09-24] (ang.).
- ↑ Karin S.L. Johansson i inni, Community structure in boreal lakes with recurring blooms of the nuisance flagellate Gonyostomum semen, „Aquatic Sciences”, 75 (3), 2013, s. 447–455, DOI: 10.1007/s00027-013-0291-x, ISSN 1015-1621 [dostęp 2022-09-24] (ang.).
- ↑ Ecophysiology and Toxicity of the Toxic Alga Heterosigma akashiwo in Puget Sound: A Living Laboratory Ecosystem Approach [online], National Centers for Coastal Ocean Science, 2017.
- ↑ a b chloromonady [online], Słownik terminów biologicznych pwn.pl.
- ↑ Joanna Czerwik-Marcinkowska, Algologia. Praktyczny przewodnik, Warszawa: Wydawnictwo Naukowe PWN, 2019, s. 65, ISBN 978-83-01-20457-0, OCLC 1150479781 [dostęp 2022-09-24].
- ↑ Richard Harder, Systematyka [Glony], [w:] Eduard Strasburger (red.), Botanika: podręcznik dla szkół wyższych, wyd. 2 pol. według 28 oryg, Warszawa: Państwowe Wydawnictwo Rolnicze i Leśne, 1967, s. 534.
- ↑ Thomas Cavalier-Smith, Kingdom Chromista and its eight phyla: a new synthesis emphasising periplastid protein targeting, cytoskeletal and periplastid evolution, and ancient divergences, „Protoplasma”, 255 (1), 2018, s. 297–357, DOI: 10.1007/s00709-017-1147-3, ISSN 0033-183X, PMID: 28875267, PMCID: PMC5756292 [dostęp 2022-09-26] (ang.).

















