The US FDA’s proposed rule on laboratory-developed tests: Impacts on clinical laboratory testing
Conteúdo
| Glutationa Alerta sobre risco à saúde | |
|---|---|
| |

| |
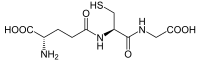
| Outros nomes | * 2-Amino-5-[1-(carboxymethylcarbamoyl)-2-mercapto- ethyl]amino-5-oxo-pentansäure * γ-L-Glutamyl-L-cysteinyl-glycin * GSH |
| Identificadores | |
| Número CAS | |
| PubChem | |
| MeSH | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C10H17N3O6S |
| Massa molar | 307.325 |
| Ponto de fusão |
185–195 °C [1] |
| Solubilidade em água | pouco solúvel em água (100 g/l a 20 °C), praticamente insolúvel em etanol [1] |
| Riscos associados | |
| LD50 | 5000 mg/kg (camundongo, oral)[2] |
| Compostos relacionados | |
| Aminoácidos relacionados | Ácido glutâmico Cisteína Glicina |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
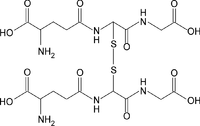
Glutationa, glutationo ou glutatião (γ-glutamilcisteinilglicina) é um tripeptídeo linear, com uma ligação 'Y-amida incomum, constituído por três aminoácidos: ácido glutâmico, cisteína e glicina, sendo o grupo tiol da cisteína o local ativo responsável pelas suas propriedades bioquímicas. É um antioxidante hidrossolúvel que está profusamente distribuída em tecidos animais, vegetais e em microrganismos, existe, na maioria das células, em concentrações compreendidas entre 1 e 8 mM, estando, geralmente, na sua maior quantidade no fígado. É o tiol mais prevalente e o mais abundante peptídeo de baixo peso molecular. Ao longo dos processos evolutivos foi adaptada para realizar uma gama diversa de funções, participando de vários processos metabólicos[3].
A Glutationa pode ser encontrada na forma reduzida (GSH) ou oxidada (GSSG, forma dimerizada da GSH). A razão GSH/GSSG é normalmente utilizada para estimar o estado redox dos sistemas biológicos, sendo extremamente importante. Em situações normais a GSSG representa apenas uma pequena fracção da glutationa total (menos de 10%).
Descoberta
Foi descrito pela primeira vez, em 1888 por Rey-Pailhade, como “philothion”, designando simplesmente algo que continha enxofre, posteriormente cristalizado por diversos investigadores, onde se verificou a presença relevante deste elemento, sendo assim designado de glutationa (L-gama-glutamil-L-cisteinilglicina)[4].
Função
A glutationa está omnipresente na célula, onde:
- participa em reações que envolvem a síntese de proteínas e ácidos nucleicos;
- participa também em reações de metabolização de peróxidos (na metabolização da água-oxigenada (H2O2), e de outros peróxidos de hidrogênio)[5];
- ajuda na desintoxicação de antidepressivos e benzodiazepinas;
- participa da inativação de radicais livres[4];
- é frequente a formação de conjugados de glutationa com uma grande variedade de compostos de origem, tanto endógena quanto exógena[6];
- atua como cofator para diversas enzimas como glutationa-peroxidase;
- atua na metabolização de xenobióticos como cofator da glutationa-S-transferase[6];
- está envolvida no metabolismo do ácido ascórbico;
- tem um papel determinante na resposta imune[7];
- importante para a síntese de DNA, síntese proteínas, síntese de prostaglandinas, para o transporte de aminoácidos, e ativações enzimáticas[8];
- está envolvida na manutenção da comunicação entre as células, na prevenção da oxidação dos grupos tiol presentes nas proteínas e no transporte do cobre intracelular[9].
A mitocôndria e o núcleo têm a sua própria reserva de GSH, de importância crucial na proteção destas estruturas contra a ação das espécies reativas de oxigênio.
Síntese e Catabolismo (degradação)
A glutationa é sintetizada no fígado em dois passos, catalisados pela γ-glutamil-cisteina-sintetase (GCS) e pela glutationa-sintetase, usando o glutamato e a cisteína como substratos, formando o dipeptídeo γ-GluCys, o qual se combina com a glicina numa reação catalisada pela glutationa sintetase (GS) para a geração de GSH. A adenosina trifosfato (ATP) é co-substrato para ambas as enzimas. O nível intracelular de GSH é regulado por feedback, sendo a atividade da GCS inibida pelo seu produto final[10]. A GSH é distribuída, através da circulação sanguínea, para todos os tecidos.
A degradação da GSH e GSSG ocorre ao nível extracelular e, especialmente, ao nível renal, numa reação catalisada pela γ-glutamiltranspeptidase (GGT) e pela cisteinil-glicina-dipeptidase[11]. As etapas da degradação são: (1) Catabolismo extenso internamente nos espaços apicais, bem como no interior de compartimentos sinusoidais de algumas espécies; (2) Recaptação celular de alguns produtos de degradação; (3) Utilização intracelular destes produtos de degradação, ou conversão de conjugados de cisteína (Cys-SR) em ácido mercaptúrico. O catabolismo de conjugados de glutationa leva à formação de conjugados com a cisteína. Estes conjugados são transportados de novo para as células, onde podem funcionar como substrato para as N-acetiltransferases, com o intuito de gerar conjugados com a N-acetilcisteína (N-Acetil-Cys-SR), ou ácidos mercaptúricos. Estes ácidos são depois exportados a partir de células com a finalidade de eliminá-los através da urina ou fezes[12].
Defesa Antioxidante
A ação antioxidante consiste na neutralização de radicais livres e redução do peróxido de hidrogênio. A glutationa é a primeira linha de defesa contra ROS, que o organismo humano concretiza a favor da sua homeostasia[13]. Na célula existem duas formas principais de defesa antioxidante: enzimática e não enzimática. A defesa enzimática compreende várias enzimas do ciclo redox da glutationa (glutationa redutase e glicose-6-fosfato-desidrogenase), sendo mais importante a GPx (Glutationa peroxidase). Existem ainda outros sistemas enzimáticos na defesa antioxidante, que inserem no seu mecanismo a enzima superóxido dismutase (SOD) e a catalase. A primeira faz com que ocorra a dismutação do radical superóxido em peróxido de hidrogênio e oxigênio, já a segunda converte o peróxido de hidrogênio em água e oxigênio molecular. É através destes sistemas que muitas das reações prejudiciais são evitadas ou alteradas[14].
Destoxificação
O metabolismo de xenobióticos manifesta-se em duas etapas: funcionalização (fase I), onde o componente a ser excretado sofre uma alteração química da molécula, que pode ser provocada por oxidação, redução ou hidrólise; conjunção (fase II), onde a molécula vai ser preparada para poder ser expulsa pelo organismo, para isso acopla-se a molécula que servirá como meio de transporte. A fase II só é funcional caso haja um grupo reativo adequado para a conjugação, esse grupo reativo necessário à fase II é adquirido com a primeira fase[15]. A conjugação dos xenobióticos com a glutationa, efetuando a destoxificação, é catalisada por uma família de GST (Glutationa-S-transferase). Estas enzimas estão presentes na maioria dos tecidos, embora em concentrações mais elevadas no fígado, intestino, rim, testículos, glândula supra-renal e pulmão, onde se localizam no citoplasma numa percentagem de 95%, e no retículo endoplasmático cerca de 5%[16].
Na saúde
A glutationa é uma molécula determinante em diversos processos celulares e como tal, qualquer alteração na sua homeostasia pode influenciar a etiologia e/ou progressão de diversas doenças humanas[17]. Diversos estudos descrevem o decréscimo dos níveis de glutationa com o aumento da idade de uma pessoa, estando assim implicado com o aparecimento de certas doenças associadas ao envelhecimento[18]. Os níveis de glutationa são um indicador muito sensível da funcionalidade e viabilidade celular[19].
Características físicas
- Aspecto - cristais incolores ou pó cristalino ou branco;
- Solubilidade: pouco solúvel no etanol a 96% e no cloreto de metilo, porém facilmente solúvel na água.
Ligações externas
Referências
- ↑ a b Sicherheitsdatenblatt Merck
- ↑ Sicherheitsdatenblatt Carl Roth
- ↑ Tapiero, H., Tew, K.D. (2003) The importance of glutathione in human disease. Elsevier, Biodedecine & Pharmacotherapy, 57(3-4), pp. 145-155
- ↑ a b Penninckx, M. (1999) A short review on the role of glutathione in the response of yeasts to nutritional, environmental, and oxidative stresses. Elsevier, Enzyme and Microbial Techonology, 26(9-10), pp. 737-739
- ↑ Bonnefoy, M., Drai, J., Kostka, T. (2002) Antioxidants to slow aging, facts an perspectives. Presse Med, 31(25), pp. 1174-84
- ↑ a b Huber, P. C., Almeida, W. P., & Fátima, Â. de. (2008). Glutationa e enzimas relacionadas: papel biológico e importância em processos patológicos. Química Nova, 31(5), 1170–1179. doi:10.1590/s0100-40422008000500046
- ↑ Carolis, C., Perricone, C. Perricone R. (2009) Glutathione: A key player in autoimmunity. Elsevier, Autoimmunity Reviews, 8(8), pp.697-701
- ↑ Park, W.H., You, B.R. (2010) Gallic acid induced lung cancer cell death is related to glutathione; depletion as well as reactive oxygen species increase. Toxicology in Vitro, 24(5), pp. 1356-1362
- ↑ Sies, H. (1999) Glutathione and its role in celular functions. Elsevier, Free Radical Biology & Medicine, 27(9), pp. 916-920.
- ↑ Misra, I., Griffith, O.W. (1998) Expression and Purification of Human γ-Glutamylcysteine Synthetase. Elsevier, Protein Expression and Purification, 13(2), pp. 268-275
- ↑ Bertini, E., Federici, G., Pastore, A., Piemonte, F. (2003) Analysis of glutathione: implication in redox and detoxification. Elsevier, Clinica Chimica Acta, (333),pp.19-36
- ↑ Bonnefoy, M., Drai, J., Kostka, T. (2002) Antioxidants to slow aging, facts an perspectives. Presse Med, 31(25), pp. 1174-84.
- ↑ Franklin, C.C. (2010) Enhanced glutathione: biosynthetic capacity promotes resistence to AS3+- induced apoptosis. Toxicology Letters, 193(1), 33-40
- ↑ Beattie, M.C., et alii. (2010) Effect of glutathione: redox state on Leydig ceel susceptibility to acute oxidative stress. Molecular and Cellular Endocrinology, 323(2), pp. 147-154
- ↑ Flanagan, R.J., Taylor, A., Watson, I.D., Whelpton, R. (2007) Fundamentals of analytical toxicology. Londres, Wiley
- ↑ Höehr, N.F., Júnior, L.R., Kubota, L.T. (2001) Sistema antioxidante envolvendo o ciclo metabólico da glutationa associado a métodos electroanalíticos na avaliação do stresse oxidativo. Quimica Nova, 24(1), pp.112-119
- ↑ Ballatori, N., et alii. (2009) Glutathione dysregulation and the etiology and progression of human diseases. The Journal of Biological Chemistry, 390,pp. 191-214
- ↑ Forman, H.J., Rinna, A., Zhang, H. (2009) Glutathione: Overview of its protective roles, measurement, and biosynthesis. Molecular Aspects of Medicine, 30, pp.1-12
- ↑ Anazetti, M.C., Melo, P.,S. (2007) Morte celular por Apoptose : uma visão bioquímica e molecular. Metrocamp Pesquisa, 1 (1), pp. 37-58

















