The US FDA’s proposed rule on laboratory-developed tests: Impacts on clinical laboratory testing

In chimica, le proteine (o protidi) sono macromolecole biologiche costituite da catene di amminoacidi legati uno all'altro da un legame peptidico (ovvero un legame tra il gruppo amminico di un amminoacido e il gruppo carbossilico dell'altro amminoacido creato attraverso una reazione di condensazione con perdita di una molecola d'acqua). Le proteine svolgono una vasta gamma di funzioni all'interno degli organismi viventi, tra cui la catalisi delle reazioni metaboliche, funzione di sintesi come replicazione del DNA, la risposta agli stimoli e il trasporto di molecole da un luogo ad un altro. Le proteine differiscono l'una dall'altra soprattutto nella loro sequenza di amminoacidi, la quale è dettata dalla sequenza nucleotidica conservata nei geni e che di solito si traduce in un ripiegamento proteico e in una struttura tridimensionale specifica che determina la sua attività.
Descrizione
In analogia con altre macromolecole biologiche come i polisaccaridi e gli acidi nucleici, le proteine costituiscono una parte essenziale degli organismi viventi e partecipano praticamente in ogni processo che avviene all'interno delle cellule. Molte fanno parte della categoria degli enzimi, la cui funzione è catalizzare le reazioni biochimiche vitali per il metabolismo degli organismi. Le proteine hanno anche funzioni strutturali o meccaniche, come l'actina e la miosina nei muscoli e le proteine che costituiscono il citoscheletro, che formano una struttura che permette di mantenere la forma della cellula. Altre sono fondamentali per la trasmissione di segnali inter ed intracellulari, nella risposta immunitaria, per l'adesione cellulare e per il ciclo cellulare. Le proteine sono elementi necessari anche nell'alimentazione degli animali, dal momento che essi non possono sintetizzare tutti gli amminoacidi di cui hanno bisogno e devono ottenere quelli essenziali attraverso il cibo. Grazie al processo della digestione, gli animali scindono le proteine ingerite nei singoli amminoacidi, che poi vengono utilizzati nel metabolismo.
Una volta sintetizzate nell'organismo, le proteine esistono solo per un certo periodo di tempo per poi venire degradate e riciclate attraverso i meccanismi cellulari per il processo di turnover proteico. La durata di una proteina è misurata in termini di emivita e può essere molto varia. Alcune possono esistere per solo alcuni minuti, altre fino ad alcuni anni, tuttavia la durata media nelle cellule di un mammifero è tra 1 e 2 giorni. Proteine anomale e mal ripiegate possono causare instabilità se non vengono degradate più rapidamente.
Le proteine possono essere purificate da altri componenti cellulari utilizzando una varietà di tecniche come l'ultracentrifugazione, la precipitazione, l'elettroforesi e la cromatografia; l'avvento dell'ingegneria genetica ha reso possibile una serie di metodi per facilitare tale purificazione. I metodi comunemente usati per studiare la struttura e la funzione delle proteine includono immunoistochimica, la mutagenesi sito specifica, la cristallografia a raggi X, la risonanza magnetica nucleare. Le proteine si differenziano principalmente per la sequenza degli amminoacidi che le compongono, la quale a sua volta dipende dalla sequenza nucleotidica dei geni che all'interno della cellula ne esprimono la sintesi.
Una catena lineare di residui amminoacidici è chiamata "polipeptide" (ovvero una catena di più amminoacidi legati da legami peptidici). Una proteina è generalmente costituita da uno o più polipeptidi lunghi eventualmente coordinati a gruppi non peptidici, chiamati gruppi prostetici o cofattori. Polipeptidi brevi, contenenti meno di circa 20-30 amminoacidi, vengono raramente considerati proteine e sono comunemente chiamati peptidi o talvolta oligopeptidi. La sequenza degli aminoacidi in una proteina è definita dalla sequenza presente in un gene, la quale è codificata nel codice genetico. In generale, il codice genetico specifica 20 amminoacidi standard; tuttavia, in alcuni organismi il codice può includere la selenocisteina (SEC), e in alcuni archaea, la pirrolisina ed infine un 23° amminoacido, la N-formilmetionina, un derivato della metionina, che inizia la sintesi proteica di alcuni batteri.
Poco dopo o anche durante la sintesi proteica, i residui di una proteina vengono spesso modificati chimicamente mediante la modificazione post traduzionale, che se presente altera le proprietà fisiche e chimiche, la piegatura, la stabilità, l'attività e, in ultima analisi, la funzione della proteina. Le proteine possono anche operare insieme per raggiungere una particolare funzione e spesso associarsi in complessi multiproteici stabili.
Proteine che contengono lo stesso tipo e numero di amminoacidi possono differire dall'ordine in cui questi sono situati nella struttura della molecola. Tale aspetto è molto importante perché una minima variazione nella sequenza degli amminoacidi di una proteina (cioè nell'ordine con cui i vari tipi di amminoacidi si susseguono) può portare a variazioni nella struttura tridimensionale della macromolecola che possono rendere la proteina non funzionale. Un esempio ben noto è il caso della catena beta dell'emoglobina umana, che nella sua normale sequenza porta un tratto formato da: valina-istidina-leucina-treonina-prolina-acido glutammico-lisina.
Classificazione
La formazione di copie duplicate di geni e l'alterazione della funzione di una proteina nel corso dell'evoluzione hanno portato alla formazione delle circa 500 famiglie proteiche identificate. All'interno di una famiglia, sebbene ciascuna proteina svolga una funzione leggermente diversa dall'altra, la sequenza di amminoacidi, in particolare presso i siti catalitici e in regioni conservate, è quasi identica. Non è tuttavia una legge che vale per tutte le proteine di una famiglia; esistono infatti alcune proteine dalla sequenza amminoacidica molto diversa e, tuttavia, dalla conformazione tridimensionale molto simile.
Si può quindi affermare che nel corso dell'evoluzione all'interno di una famiglia proteica si è conservata più la conformazione tridimensionale che non la sequenza degli amminoacidi. Generalmente, quando almeno un quarto della sequenza amminoacidica di due proteine corrisponde, esse hanno la stessa struttura generale. Due proteine diverse appartenenti a una stessa famiglia e dalla funzione simile sono dette "paraloghe", mentre la stessa proteina in due organismi diversi (per esempio uomo e topo) è detta "ortologa". La parentela tra due proteine è generalmente accettata quando almeno il 30% degli amminoacidi corrisponde, ma per verificarla è possibile ricorrere ai cosiddetti fingerprint, cioè brevi sequenze di amminoacidi comuni in quasi tutte le proteine di una data famiglia.

Alcune proteine si sono formate per rimescolamento dei domini proteici o per la loro duplicazione all'interno della stessa proteina a causa di unioni accidentali di DNA codificante; certi domini sono particolarmente diffusi e sono perciò chiamati moduli proteici. Questi domini hanno la caratteristica di avere gli N-terminali e C-terminali ai poli opposti della proteina, così che l'aggregazione ad altri domini e ad altre proteine per formare strutture più grandi è favorita rispetto a quanto accadrebbe se fossero entrambi verso lo stesso polo della proteina; un esempio è il modulo 1 della fibronectina. In tal caso i domini sono inseriti nelle anse proteiche di alcune proteine, per esempio il modulo kringle nell'urochinasi o il dominio SH2. Alcuni di questi domini non si ritrovano solo tra proteine paraloghe ma anche ortologhe, per esempio il dominio SH2 mostra una diffusione molto simile sia nel verme che nella mosca, eppure è ben poco frequente nei vegetali. Vi sono invece dei domini comuni a solo certe categorie di organismi come l'MHC, il complesso maggiore di istocompatibilità (major histocompatibility complex), presente nell'uomo ma assente negli insetti e nei vegetali, tuttavia questi costituiscono soltanto il 7% del totale. Si è osservato inoltre che, malgrado alcuni organismi viventi apparentemente semplici come la pianta Arabidopsis thaliana posseggano più geni di un essere umano, tendenzialmente le proteine umane sono formate da un numero maggiore di domini e quindi sono più complesse rispetto alle ortologhe in altri organismi.
La classificazione può essere dunque fatta in base alla composizione chimica, alla configurazione molecolare o alla solubilità. Si distinguono così proteine semplici (costituite da soli amminoacidi) e proteine coniugate (costituite da una proteina semplice e da un gruppo prostetico di natura non proteica).
Tra le proteine semplici vi sono le proteine fibrose, generalmente insolubili nei solventi acquosi ed a volte inattaccabili dagli enzimi proteolitici, come ad esempio: il collagene (costituente essenziale del tessuto connettivo), l'elastina (componente principale delle fibre elastiche e delle pareti vasali), la cheratina (componente essenziale dell'epidermide). Inoltre, sempre tra quelle semplici vi sono le proteine globulari, le albumine (assai diffuse nel mondo animale), le globuline (insolubili in acqua, si trovano nel sangue, nel muscolo, nei tessuti in genere e nei semi) e le prolamine (caratteristiche del mondo vegetale).
Tra le proteine coniugate (costituite almeno da apoproteina+gruppo prostetico): l'emoglobina, le clorofille e le opsine.
Un'ulteriore classificazione delle proteine è quella che le distingue in base alla loro funzione in cui possiamo distinguere le proteine strutturali che sono componenti delle strutture permanenti dell'organismo ed hanno principalmente una funzione meccanica, le proteine di trasporto che si legano a sostanze poco idrosolubili e ne consentono il trasporto nei liquidi corporei e gli enzimi che sono proteine catalitiche. Tra le altre funzioni delle proteine rientrano la regolazione dell'espressione dei geni, la duplicazione, trascrizione e traduzione del DNA, la regolazione delle reazioni metaboliche, la generazione e la ricezione degli impulsi nervosi. Molte tossine e molti allergeni sono anch'essi proteine.
Biochimica


La maggior parte delle proteine sono costituite da polimeri lineari costruiti dalla serie di 20 diversi L-α-aminoacidi. Tutti gli aminoacidi proteinogenici possiedono caratteristiche strutturali comuni, tra cui un carbonio α con un gruppo amminico, un gruppo carbossilico e una catena laterale variabile. Solo la prolina differisce da questa struttura di base in quanto contiene un anello insolito al gruppo amminico.[1] Le catene laterali degli amminoacidi standard, dettagliate nella lista degli amminoacidi standard, hanno una grande varietà di strutture e proprietà chimiche; è l'effetto combinato di tutte le catene laterali di aminoacidi in una proteina che determina infine la sua struttura tridimensionale e la sua reattività chimica.[2] Gli amminoacidi di una catena polipeptidica sono legati da legami peptidici. Una volta collegata nella catena proteica, un aminoacido individuo è chiamato un residuo e la serie collegata di carbonio, azoto e atomi di ossigeno sono noti come "catena principale" o "proteine backbone".[3]
Il legame peptidico ha due forme di risonanza che contribuiscono al doppio legame e inibiscono la rotazione attorno al suo asse, in modo che i carbonio α siano approssimativamente complanari. Gli altri due angoli diedri nel legame peptidico determinano la forma locale assunta dalla "proteina backbone. [4] La fine della proteina con un gruppo carbossilico libero è nota come dominio C-terminale, mentre l'estremità con un gruppo libero amminico è noto come la dominio N-terminale. I termini proteina, polipeptide e peptide sono un po' ambigui e possono sovrapporsi in alcuni significati. Il termine "proteina" è generalmente usato per riferirsi alla molecola biologica completa in una conformazione stabile, mentre il "peptide" è generalmente riconosciuto per essere un breve oligomero di aminoacidi spesso mancante una struttura tridimensionale stabile. Tuttavia, il confine tra i due composti non è ben definito e di solito il numero di residui che li differenzia è vicino ai 20-30.[5] Con "polipeptide" ci si può riferire a qualsiasi singola catena lineare di amminoacidi, di solito indipendentemente dalla lunghezza, ma spesso il termine implica l'assenza di una conformazione definita.
Gli amminoacidi
Gli amminoacidi di una proteina variano da 20 a 30 con 9 essenziali, quindi non sintetizzati dal corpo umano, perciò da assumere esternamente attraverso l'alimentazione.
Composizione
Le proteine hanno una struttura tridimensionale molto complessa a cui è associata sempre una funzione biologica. Da questa considerazione deriva uno dei dogmi fondamentali della biologia: "Struttura <--> Funzione", nel senso che ad ogni diversa organizzazione strutturale posseduta da una proteina (detta proteina nativa) è associata una specifica funzione biochimica. Da questo punto di vista le proteine possono essere classificate in due grandi famiglie: le proteine globulari e le proteine a struttura estesa o fibrosa. Queste due organizzazioni riflettono le due grosse separazioni funzionali che le contraddistinguono:
- Le proteine estese o fibrose svolgono funzioni generalmente biomeccaniche, esse rientrano nella costituzione delle ossa, unghie, peli, dello strato corneo dell'epidermide, dei muscoli (actina e miosina), fornendo sostegno strutturale e opponendo una valida difesa contro il mondo esterno.
- Al contrario, le proteine globulari sono coinvolte in specifiche e molteplici funzioni biologiche, spesso di fondamentale importanza per l'economia cellulare, sono proteine gli enzimi, i pigmenti respiratori, molti ormoni, le tossine, e gli anticorpi, responsabili della difesa immunitaria.
La loro composizione in amminoacidi è variabile e sotto il controllo genetico per cui il loro peso molecolare può essere molto variabile e dipende dal numero e dal tipo di amminoacidi (monomeri) di cui è costituita la molecola. Se la molecola è costituita da poche unità di amminoacidi (in genere non più di 10) viene definita un "oligopeptide". Molecole con più di 10 unità sono dette "polipeptidi"[6]. Una proteina è formata da uno o più polipeptidi eventualmente accompagnati da uno o più gruppi prostetici ed il suo peso molecolare è generalmente non inferiore a 10.000[7].
Una proteina nella sua organizzazione nativa, e quindi funzionalmente attiva, può esistere solo in soluzioni saline diluite (molto simili, per composizione, a quelle esistenti nei sistemi acquosi cellulari). La sua struttura dipende esclusivamente dalle caratteristiche chimico-fisiche della soluzione acquosa in cui si trova (pH, presenza di ioni salini, temperatura, pressione, presenza di composti organici come urea, alcoli, ecc.). Il variare di questi parametri può determinare delle modifiche strutturali che possono alterare le proprietà funzionali, fino ad annullarle (proteina denaturata).
La molecola proteica risulta costituita da atomi di carbonio, ossigeno, idrogeno e azoto; spesso contiene anche zolfo (presente negli amminoacidi metionina, cisteina e cistina) e, talvolta, fosforo e/o metalli come ferro, rame, zinco ed altri.
Proprietà chimico-fisiche
Le proprietà delle proteine si ricollegano a quelle dei loro costituenti, gli amminoacidi: sono elettroliti anfoteri, possono essere sottoposte ad elettroforesi, sono otticamente attive (levogire) e presentano il fenomeno di Tyndall. Il punto isoelettrico (o PI) di una proteina è rappresentato da quella concentrazione di idrogenioni del mezzo, che si comporta in modo da far assumere al protide una forma di anfoione. Per ottenere il peso molecolare (o PM) delle proteine si deve far ricorso a tecniche e metodologie di non sempre facile attuazione. Tra le tante, quella che fornisce i risultati più precisi è senza dubbio la spettrometria di massa. Dal punto di vista meccanico, la catena amminoacidica si comporta come un polimero semi-flessibile la cui estensione è descritta dal modello Worm-like chain, con una lunghezza di persistenza di 0.4 nm.
Struttura
Ripiegamento
Una proteina, essendo una macromolecola formata da decine di migliaia di atomi, potrebbe potenzialmente assumere un numero incredibilmente grande di possibili ripiegamenti. Tuttavia considerazioni fisiche limitano di molto i possibili ripiegamenti e dunque la conformazione finale di una proteina. Intanto gli atomi non si possono mai sovrapporre e si comportano a grandi linee come sfere con un raggio definito detto raggio di van der Waals, ciò limita non poco il numero di angoli ammessi in una catena polipeptidica. Ciascun amminoacido contribuisce alla formazione della catena polipeptidica con tre legami:
- Il legame peptidico (C-N) tra il carbonio di un gruppo chetonico di uno degli amminoacidi e l'azoto del gruppo amminico dell'adiacente.
- Il legame convenzionalmente chiamato Cα-C che è presente tra il carbonio centrale cui è attaccato il gruppo laterale R e il carbonio del gruppo carbossilico.
- Il legame Cα-N tra il carbonio centrale e l'azoto del gruppo amminico dello stesso amminoacido.
Il legame peptidico è planare ed impedisce una vera e propria rotazione, mentre gli altri due legami la consentono.
L'angolo di rotazione del legame Cα-C è detto ψ, quello del legame Cα-N è detto φ. La conformazione degli atomi della catena principale di una proteina è determinata dalla coppia di questi angoli di rotazione per ciascun amminoacido. Dal momento che non sono possibili collisione steriche tra gli amminoacidi gli angoli possibili sono limitati. Ramachandran in funzione delle possibili coppie di angoli di rotazioni compilò un grafico che oggi prende il suo nome dove è ben visibile come la maggior parte delle proteine assumano solo due grandi tipologie di conformazione: l'α-elica e il β-foglietto.
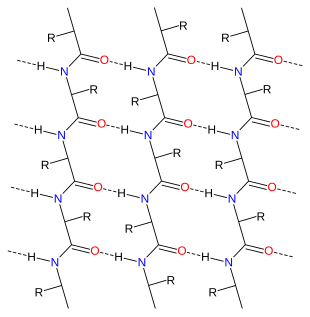
Tra gli atomi di una proteina si stabiliscono interazioni dette legami, che possono essere covalenti o non covalenti. I legami non covalenti, presi singolarmente, sono sempre più deboli dei covalenti nell'ordine di decine o centinaia di volte, tuttavia il loro numero all'interno di una proteina li rende fondamentali per comprenderne il ripiegamento. I legami non covalenti che si riscontrano nelle proteine sono i legami a idrogeno, le attrazioni elettrostatiche e le attrazioni di van der Waals.
- Il legame a idrogeno si effettua, per esempio, tra un atomo di ossigeno e uno vicino di idrogeno.
- Le attrazioni elettrostatiche avvengono tra gruppi laterali con carica periferica opposta.
- Le attrazioni di van der Waals si verificano tra dipoli molecolari istantanei indotti (forza di London), tra dipoli permanenti (forza di Keesom) o tra un dipolo permanente ed uno corrispondente indotto (forza di Debye).
A queste interazioni si deve aggiungere la tendenza dei gruppi di amminoacidi idrofobici (fenilalanina, leucina, isoleucina, triptofano, valina, cisteina, metionina, prolina, alanina e glicina) ad avvicinarsi e unirsi tra loro, formando delle tasche idrofobiche lontane dalla rete di legami idrogeno che deve essere immaginata sempre presente all'interno di un ambiente acquoso tra le molecole d'acqua. Generalmente i gruppi di amminoacidi idrofobici sono quasi sempre posti all'interno della proteina, dal momento che questa si trova tipicamente in un ambiente acquoso, mentre i suoi amminoacidi idrofili, polari e con carica, saranno tendenzialmente all'esterno. La struttura tridimensionale di una proteina è determinata dalla sola disposizione sequenziale dei suoi amminoacidi e la conformazione che assume è tendenzialmente quella con energia libera più bassa.
È stato possibile scoprire questa peculiarità delle proteine effettuando esperimenti di denaturazione (tramite solventi come l'urea) e rinaturazione di proteine in vitro. Si è notato che alcune proteine, una volta denaturate e rimosso il solvente si ripiegavano autonomamente. Tuttavia, non tutte le proteine una volta denaturate possono ripiegarsi spontaneamente nella loro conformazione originaria. La conformazione di una proteina, benché sia normalmente la più stabile possibile per la sequenza dei suoi amminoacidi, non è immutabile, e subisce piccole modificazioni dovute all'interazione con ligandi o altre proteine. Questa caratteristica è alla base della funzionalità della maggior parte delle proteine. La conformazione di una proteina può essere notevolmente aiutata ed affinata dagli chaperoni, delle proteine che si legano alle catene parzialmente ripiegate e le assistono sino a raggiungere la conformazione corretta. Spesso agiscono isolando tra loro le tasche idrofobiche di una proteina, che in caso contrario tenderebbero ad associarsi prematuramente.
Una porzione di proteina che si ripiega indipendentemente dal resto della catena polipeptidica è detta dominio proteico ed una proteina può averne anche più di uno. Si suppone che esistano in natura circa 2.000 domini proteici dalla struttura differente, circa 800 sono stati identificati, tuttavia la stragrande maggioranza dei domini proteici assume poche decine di conformazioni diverse.
L'α-elica e il β-foglio pieghettato
L'α-elica e il β-foglietto sono le conformazioni più comuni riscontrabili nelle catene polipeptidiche di una proteina. Una singola proteina può prevedere sia α-eliche che β-foglietti in numero variabile.
- L'α-elica è la conformazione più comune riscontrabile nelle proteine, particolarmente presente nei recettori cellulari, dov'è immersa nella membrana plasmatica della cellula, spesso con più α-eliche per singola proteina (unite da catene polipeptidiche ad U). In questo caso i gruppi idrofobici sono a contatto con la membrana plasmatica e i gruppi idrofili sono all'interno, oppure si affacciano al citoplasma e allo spazio extracellulare. L'elica è una delle conformazioni più favorevoli perché naturalmente riduce al minimo l'energia libera, può essere sinistrorsa o destrorsa. Fu scoperta per la prima volta nell'α-cheratina negli anni Sessanta. L'α-elica si forma quando una catena polipeptidica si ripiega su se stessa con formazione di legami idrogeno tra un legame peptidico e il quarto successivo, in particolare tra il gruppo chetonico C=O dell'uno e il gruppo N-H dell'altro, e il legame è tra O e H. Tutti i gruppi amminici di un'elica sono rivolti verso l'N-terminale della proteina, tutti quelli chetonici verso il C-terminale, così l'elica assume parziale carica positiva all'N-terminale e parziale carica negativa al C-terminale. L'elica che si forma ha un giro completo ogni 3,6 amminoacidi e la distanza media tra questi è 0,54 nm. In alcune proteine due o tre α-eliche si avvolgono l'una intorno all'altra formando il coiled coil. Generalmente questa conformazione è assunta quando ciascuna elica ha la maggior parte delle catene laterali di amminoacidi idrofobici da un lato, in questo modo, sfruttando le attrazioni idrofobiche, le eliche possono avvolgersi una intorno all'altra. L'α-cheratina è un esempio di proteina che assume questa particolare conformazione, preferita dalle proteine con funzione strutturale.
- Il β-foglio pieghettato è la seconda conformazione più comune nelle proteine, molto presente in alcuni enzimi e nelle proteine coinvolte nella difesa immunitaria. Fu scoperto negli anni Sessanta studiando la fibroina, la proteina principale costituente della seta. Il foglietto β pieghettato consiste in numerose catene polipeptidiche che si dispongono l'una adiacente all'altra, collegate in una struttura continua da brevi sequenze a U. Tali catene possono puntare nella stessa direzione (catene parallele) o in direzioni alternate (catene antiparallele). Ancora una volta le catene polipeptidiche adiacenti sono unite in una struttura rigida da legami idrogeno che connettono i legami peptidici di una catena con quella adiacente.
Livelli di organizzazione

Una proteina nel suo complesso è una molecola in cui vengono convenzionalmente distinti vari livelli di organizzazione, che possono essere tre o quattro a seconda della proteina.[8]
- La struttura primaria è formata dalla sequenza specifica degli amminoacidi, dalla catena peptidica e dal numero stesso delle catene, determina da sola il ripiegamento della proteina.
- La struttura secondaria consiste nella conformazione spaziale delle catene; ad esempio la conformazione a spirale (o ad alfa elica), mantenuta e consentita dai legami a idrogeno, quella planare (o a foglietto β), il coiled coil (collagene) o quelle globulari appartenenti al gruppo KEMF (cheratina, epidermina, miosina, fibrinogeno). All'interno di una singola proteina vi può essere una combinazione di sequenze di α eliche, foglietto β e sequenze non ripetitive, e sono ad un livello di complessità compreso tra la struttura secondaria e quella terziaria.
- Il dominio è un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte, costituiscono divisioni della struttura terziaria, ha la caratteristica di ripiegarsi più o meno indipendentemente rispetto al resto della proteina. Un dominio è generalmente compreso tra i 30 e i 350 amminoacidi. Molte delle proteine più complesse sono aggregazioni modulari di numerosi domini proteici. Tra i più comuni si citino SH2 o SH3; la proteina Src possiede un dominio SH2, un dominio SH3 e un dominio catalitico chinasico C-terminale.
- La struttura terziaria (dal punto di vista della termodinamica è la forma con la più bassa energia libera) è rappresentata dalla configurazione tridimensionale completa che la catena polipeptidica assume nell'ambiente in cui si trova.
Viene consentita e mantenuta da diversi fattori, come i ponti disolfuro, e le forze di Van der Waals. Fondamentali ai fini della sua formazione sono le chaperonine, proteine chiamate anche "dello stress" o "dello shock termico" (Hsp, “heat shock proteins”), per il loro ruolo nella rinaturazione delle proteine denaturate.
Gran parte delle strutture terziarie può essere classificato come globulare o fibrosa. - La struttura quaternaria è quella che deriva dall'associazione di due o più unità polipeptidiche, unite tra loro da legami deboli (e a volte ponti disolfuro) in un modo molto specifico, come ad esempio avviene nella costituzione dell'emoglobina, costituita da quattro subunità, due globuline α e due globuline β.
Le proteine che contengono anche una parte non polipeptidica, gruppo prostetico, sono dette proteine coniugate. Due proteine si dicono isoforme se, a parità di struttura primaria, differiscono in uno degli altri livelli di struttura. Denaturare una proteina significa distruggerne la conformazione spaziale, rompendo i legami idrogeno e ponti disolfuro per mezzo di acidi, basi, calore, radiazioni o agitazione (un esempio comune di denaturazione è la cottura di un uovo nel quale l'albumina, che costituisce la maggior parte dell'albume, viene denaturata). Una proteina denaturata, pur mantenendo intatta la sua struttura primaria, non è più in grado di esplicare la sua funzione, a meno che non si riesca a ristabilirne la struttura terziaria.
Proteine complesse
Le proteine, per quanto siano complesse anche prese singolarmente, negli organismi viventi possono aggregarsi ad altre proteine identiche oppure a proteine apparentemente molto differenti creando dei complessi proteici. Ciò che permette questo legame sono gli stessi legami non covalenti che permettono ad una proteina di assumere una determinata conformazione. In una proteina sono spesso presenti una o più zone caratteristiche capaci di interazioni non covalenti con altre proteine dette siti di legame. Quando una proteina, tramite un sito di legame, si lega ad un'altra proteina formando un complesso proteico ogni singola proteina del complesso prende il nome di subunità proteica.
Se le subunità che formano il complesso proteico sono due si dirà che è un dimero, se sono tre un trimero, se quattro un tetramero e così via. Esistono complessi proteici che contengono decine di subunità. Il legame fra le subunità può essere per esempio "testa-testa" (in tal caso sono favoriti i dimeri) o "testa-coda" (dove spesso le proteine sono globulari o ad anello).

Un esempio di proteina provvista di più subunità è l'emoglobina, una proteina globulare formata da quattro subunità, due α-globuline ad uno dei due poli e due β-globuline all'altro (le subunità non sono perciò alternate), con un gruppo prostetico (l'eme) legato a ciascuna subunità.
Altri complessi proteici sono formati da molte più subunità che permettono di realizzare dei filamenti dal momento che ad un polo possiedono un sito di legame e all'altro polo una struttura proteica complementare a quello stesso sito. Si creano così catene di filamenti proteici come l'actina-F, formata da centinaia di subunità globulari di actina-G che le conferiscono al microscopio elettronico un aspetto simile a quello di una collana elicoidale di perle. La ridondanza della struttura elicoidale e non retta è sempre dovuta all'affinità di una conformazione con la minore energia libera.
Una variante all'elica è il coiled coil, che coinvolge due o tre catene polipeptidiche, come nella cheratina o nel collagene. Si può dire, a grandi linee, che le proteine globulari tendono ad avere funzione enzimatica, mentre quelle che formano filamenti hanno funzione strutturale (formano ad esempio le miofibrille nelle fibre muscolari o le fibre della matrice extracellulare, o ancora il citoscheletro di una cellula).
Vi sono proteine la cui funzione è resa possibile proprio dalla loro struttura poco caratterizzabile e casuale, ne è un esempio l'elastina, che forma le fibre elastiche della parete delle arterie e di molti altri tessuti del corpo umano. Nell'elastina numerose catene polipeptidiche sono legate covalentemente tra loro senza una disposizione regolare e tale struttura disordinata ne determina la sua deformabilità. Proteine poco strutturate hanno svariate funzioni nella cellula, alcune ad esempio hanno funzione strutturale come l'elastina, altre però sono dei canali come le nucleoporine poste sulla membrana nucleare di ciascuna cellule, altre ancora fungono da proteine impalcatura, cioè proteine che raggruppano in stretta vicinanza altre proteine dalla funzione correlata, fondamentali nella segnalazione e nella comunicazione cellulare. Una caratteristica comune a tutte le proteine poco strutturate è una grande ridondanza di aminoacidi e la bassa presenza di amminoacidi idrofobici.
Certe proteine molto esposte alla degradazione nell'ambiente extracellulare sono stabilizzate da legami disolfuro (S-S) che si formano tra due proteine; questo legame agisce come una vera e propria graffetta sulla proteina, permettendole anche in ambienti ostili di mantenere la sua conformazione. All'interno del citoplasma è difficile riscontrare legami disolfuro a causa dell'ambiente riducente, per cui le cisteine mostrano gruppi (-SH).
L'evoluzione ha fatto inoltre in modo che vi fosse la possibilità di creare complessi proteici ancora più grandi di filamenti, coiled coil, o proteine globulari. Il vantaggio di tali strutture è che siccome sono spesso costituite dalla ripetizione di subunità identiche o simili, occorre poco materiale genetico per sintetizzare grandi complessi proteici, come, ad esempio, i capsidi dei virus. Inoltre l'associazione tra le subunità necessita generalmente di un'energia molto bassa, oppure, in certi casi, le subunità sono autoassemblanti (per esempio il ribosoma batterico). Il capside di molti virus è formato o da un tubo cavo (come nel virus del mosaico del tabacco) oppure assomiglia ad un icosaedro o ad una sfera cava, come per il poliovirus.
Generalmente tali strutture si rivelano sia molto stabili, date le numerose interazioni tra le subunità, sia adattabili, dal momento che per infettare una cellula devono permettere la fuoriuscita dell'acido nucleico, sia RNA o DNA.
Chiralità delle proteine
Tutti gli amminoacidi, ad eccezione della glicina presentano un carbonio legato a quattro sostituenti diversi che è un centro chirale. Tutti gli amminoacidi possono dunque esistere in due conformazioni: L o D, sintetizzandoli artificialmente si ottiene una miscela racema.
Tuttavia tutti gli amminoacidi dei composti biologici si trovano in natura soltanto conformazione L. Amminoacidi in conformazione D si rinvengono in alcune specie batteriche e vengono pure adoperati per la sintesi di farmaci. La gramicidina S, un peptide naturale con funzione antibatterica, nella sua struttura primaria contiene anche alcuni amminoacidi appartenenti alla conformazione D.
Sintesi
Sintesi biologica


Le proteine sono formate a partire dagli amminoacidi utilizzando le informazioni codificate nei geni. Ogni proteina possiede una propria sequenza amminoacidica che deriva dalla sequenza nucleotidica del gene che la codifica. Il codice genetico è costituito da triplette di nucleotidi dette codoni e ogni combinazione di tre nucleotidi designa un amminoacido, ad esempio AUG (adenina-uracile-guanina) è il codice per la metionina. Poiché il DNA contiene 4 diversi nucleotidi, il numero totale di possibili codoni è di 64; essendo gli amminoacidi standard solo 20 nel codice genetico vi è un certo grado di ridondanza e ad alcuni amminoacidi corrispondono più codoni.[9] I geni presenti nel DNA sono prima trascritti in pre-mRNA (pre-RNA messaggero) da proteine quali l'RNA polimerasi.
La gran parte degli organismi processa il pre-mRNA (anche noto come trascritto primario) mediante diverse forme di modifiche post-trascrizionali per formare l'mRNA maturo. L'RNA messaggero maturato è quindi usato come templato per la biosintesi proteica nel ribosoma. Nei procarioti l'mRNA può essere usato subito dopo essere stato prodotto o dopo essersi allontanato dal nucleoide. Al contrario gli eucarioti formano l'mRNA nel nucleo cellulare e successivamente lo traslocano attraverso la membrana nucleare nel citoplasma, dove avviene la biosintesi proteica. La velocità di sintesi delle proteine è maggiore nei procarioti rispetto agli eucarioti e può raggiungere i 20 residui amminoacidici per secondo.[10]
Il processo di sintesi di una proteina a partire da uno stampo di mRNA è noto come traduzione. L'mRNA è caricato nel ribosoma e letto tre nucleotidi per volta accoppiando ciascun codone con il corrispondente anticodone localizzato sull'RNA di trasporto che porta l'amminoacido corrispondente al codone riconosciuto. L'enzima amminoacil-tRNA sintetasi "carica" la molecola di tRNA con il corretto amminoacido. Le proteine sono sempre biosintetizzate a partire dall'estremità N-terminale in direzione di quella C-terminale.[9] Gli aminoacidi vengono poi legati tra loro tramite la rimozione di una molecola di acqua tramite la peptidil-trasferasi.
Le dimensioni di una proteina sintetizzata possono essere misurate dal numero di amminoacidi che contiene e dalla sua massa molecolare totale, la quale normalmente è misurata in dalton (sinonimo di unità di massa atomica) o nell'unità derivata kilodalton (kDa). Ad esempio le proteine del lievito sono lunghe in media 466 residui amminoacidici e pesano mediamente 53kDa.[5]
Sintesi artificiale
Le proteine più corte possono essere sintetizzate anche per via chimica mediante una serie di metodi di sintesi peptidica che si basano su tecniche di sintesi organica come la chemical legation per produrre peptidi in alte rese.[11]
La sintesi chimica permette l'introduzione nella sequenza di amminoacidi non naturali, come l'inserimento di sonde fluorescenti.[12] Questi metodi sono utili nei laboratori di biochimica e biologia cellulare, sebbene generalmente non abbiano applicazione commerciale.
La sintesi chimica è inefficiente (in termini di rese) per polipeptidi più lunghi di 300 residui amminoacidici, e le proteine sintetizzate possono avere problemi ad assumere rapidamente la struttura terziaria della conformazione nativa. La gran parte dei metodi di sintesi chimica procede dall'estremità C-terminale a quella N-terminale, in direzione opposta alla biosintesi naturale.[13]
Funzioni cellulari
Le proteine hanno un ruolo fondamentale internamente alla cellula, svolgendo i compiti specifici codificati nelle informazioni contenute nei geni.[5] Esse possono svolgere funzione strutturale, immunitaria, trasporto (di ossigeno, minerali, lipidi, di membrana), di identificazione dell'identità genetica, ormonale, enzimatica, contrattile, energetica. Con l'eccezione di alcuni tipi di RNA, la maggior parte delle altre molecole biologiche sono elementi relativamente inerti su cui agiscono le proteine. Le proteine rappresentano la metà del peso a secco di una cellula di Escherichia coli, mentre altre macromolecole, come il DNA e l'RNA, costituiscono rispettivamente solo il 3% e 20%.[14] L'insieme delle proteine espresse in un particolare tipo di cellula è noto come la sua proteoma.
La principale caratteristica delle proteine che permette a loro un insieme diversificato di funzioni è la capacità di legarsi altre molecole in modo specifico. La regione della proteina che permette il legame con l'altra molecola è conosciuta come il sito di legame ed è spesso una depressione o "tasca" sulla superficie molecolare. Questa capacità di legame è mediata dalla struttura terziaria della proteina, che definisce la tasca del sito di legame, e dalle proprietà chimiche delle catene laterali degli amminoacidi circostanti. I legami tra le proteine possono essere straordinariamente stretti e specifici; ad esempio, la proteina inibitrice della ribonucleasi si lega all'angiogenina umana con una costante di dissociazione sub-femtomolare (<10−15 M), ma non si lega affatto al suo omologo degli anfibio (> 1 M). Cambiamenti chimici estremamente minori, come l'aggiunta di un singolo gruppo metilico ad una proteina legante, a volte può essere sufficiente per eliminare questo vincolo: per esempio, l'amminoacil-tRNA sintetasi è specificata dall'amminoacido valina discriminandola dalla catena laterale molto simile della isoleucina.[15]
Le proteine possono legarsi ad altre proteine nonché a substrati piccole molecole. Le interazioni proteina-proteina regolano anche l'attività enzimatica, controllano la progressione del ciclo cellulare e permettono l'assemblaggio di grandi complessi di proteine che svolgono molte reazioni strettamente correlate con una funzione biologica comune. Le proteine possono anche legarsi, o anche essere integrate, nelle membrane cellulari. La capacità dei partner di legame di indurre cambiamenti conformazionali nelle proteine permette la costruzione di reti di segnalazione estremamente complesse.[16][17]
È importante sottolineare che le interazioni tra le proteine sono reversibili e dipendono fortemente dalla disponibilità di diversi gruppi di proteine partner per formare aggregati che sono in grado di effettuare insiemi discreti. Lo studio delle interazioni tra proteine specifiche è una chiave per comprendere gli aspetti importanti della funzione cellulare e, in ultima analisi, le proprietà che distinguono particolari tipi di cellule. [18]
Funzione enzimatica
Il ruolo più noto delle proteine all'interno della cellula è quello di operare come enzimi in grado di catalizzare reazioni chimiche. Quasi tutti i nomi degli enzimi terminano in "-asi" per convenzione. Gli enzimi sono generalmente altamente specifici e riescono ad accelerare solo una, o poche altre, reazioni. Essi sono fondamentali per la maggior parte delle reazioni coinvolte nel metabolismo, così come nei processi di manipolazione del DNA, quali la replicazione del DNA, la riparazione del DNA e la trascrizione. Alcuni enzimi agiscono su altre proteine aggiungendo o rimuovendo gruppi chimici in un processo noto come modificazione post-traslazionale. Sono note circa 4.000 reazioni catalizzate da enzimi. [19] L'accelerazione conferita dalla catalisi enzimatica è spesso enorme, fino a 1017 volte maggiore rispetto alla reazione non catalizzata nel caso di decarbossilasi orotato, che richiederebbe un tempo di 78 milioni di anni senza l'intervento dell'enzima, ma grazie al suo intervento questo tempo si riduce a soli 18 millisecondi.[20]
Il ligando di un enzima prende il nome di substrato ed è generalmente molto più piccolo dell'enzima stesso. Sebbene gli enzimi possono essere costituiti da centinaia di amminoacidi, solitamente solo una piccola frazione dei residui vengono a contatto con il substrato, e in media uno su quattro viene coinvolto direttamente nella catalisi ancora più piccolo di tre frazioni.[21] La regione dell'enzima che lega il substrato e contiene i residui catalitici è conosciuta come il sito attivo.
- idrolasi, gli enzimi che tagliano un substrato mediante idrolisi, ne fanno parte le proteasi (che tagliano altre proteine) e le nucleasi (che tagliano acidi nucleici, cioè DNA e RNA);
- sintasi, enzimi che sintetizzano una nuova molecola a partire da due substrati, generalmente per condensazione;
- isomerasi, enzimi che trasformano un ligando in un suo isomero modificandolo chimicamente a livello dei legami;
- polimerasi, enzimi che associano varie molecole costituendo un polimero, per esempio un acido nucleico;
- chinasi, enzimi che aggiungono gruppi fosfato ad alcune molecole;
- fosfatasi, enzimi che rimuovono gruppi fosfato da alcune molecole;
- ossidoreduttasi, enzimi che ossidano e riducono alcune molecole, ne fanno parte le ossidasi, le reduttasi e le deidrogenasi;
- ATPasi, enzimi che idrolizzano ATP liberandone l'energia.
Segnalazione cellulare e ligando

Molte proteine sono coinvolte nel processo di segnalazione cellulare e nella trasduzione del segnale. Alcune proteine, come l'insulina, operano in ambiente extracellulare trasmettendo un segnale proveniente dalla cellula in cui sono state sintetizzate ad altre cellule facenti parte di tessuti distanti. Altre, come le proteine di membrana, agiscono come recettori la cui funzione principale è quella di legare una molecola di segnalazione e indurre una risposta biochimica nella cellula. Molti recettori possiedono un sito di legame esposto sulla superficie cellulare e un dominio effettore che si trova invece internamente, il quale può avere un'attività enzimatica o può subire un cambiamento conformazionale che viene rilevato da altre proteine all'interno della cellula.[22]
La proteina di biopigmento criptocromo è nota per le sue proprietà di formare radicali liberi durante la sua interazione con la luce , per la sincronizzazione dei ritmi circadiani.
Gli anticorpi sono componenti proteiche del sistema immunitario adattativo la cui funzione principale è quella di legarsi gli antigeni o alle sostanze estranee nel corpo e quindi segnarle per essere distrutte. Gli anticorpi possono essere secreti nell'ambiente extracellulare o ancorati nelle membrane dei linfociti B, conosciuti come cellule del plasma. Se gli enzimi sono limitati nella loro affinità di legame per i loro substrati dalla necessità di condurre la reazione, gli anticorpi non hanno tali vincoli. L'affinità di legame di un anticorpo con il suo obiettivo è straordinariamente elevato.[23]
Quasi tutte le proteine conosciute interagiscono con altre proteine o con altri tipi di molecole, comunque detti ligandi, tramite i loro siti di legame, ciò sta alla base di gran parte delle interazioni presenti in una cellula. Una proteina di norma possiede un sito di legame che le permette di legarsi con uno o pochi ligandi, per cui la maggior parte delle proteine ha alta specificità. L'entità del legame può essere differente, vi sono proteine che si legano ai propri ligandi in modo molto tenace, altre invece che si legano debolmente e la tipologia di legame influenza la funzione della stessa proteina. Ad esempio, gli anticorpi legano strettamente i propri ligandi (detti antigeni), mentre certi enzimi per questioni di cinetica e per velocizzare le reazioni non legano così strettamente il proprio substrato.
La capacità di legame dipende sempre dalla capacità della proteine di stabilire legami non covalenti (legame idrogeno, attrazioni elettrostatiche, attrazioni idrofobiche e forze di van der Waals) con il ligando. Più legami si formano, più il legame con il ligando sarà complessivamente intenso. Il sito di legame di una proteina possiede una forma che è generalmente quasi complementare a quella del ligando che vi deve aderire, ciò ne determina la specificità. Le caratteristiche di ciascun sito di legame sono date dalle catene laterali degli amminoacidi che si affacciano in esso; gli amminoacidi che vi prendono parte sono spesso distanti lungo la catena polipeptidica della proteina. Mutazioni nel sito di legame generalmente determinano malfunzionamento o cessazione dell'attività catalitica o di legame originaria. Non è sorprendente pensare che i siti di legame siano alcuni degli amminoacidi più conservati all'interno di una proteina. I siti di legame sono isolati dall'ambiente acquoso in cui sono immersi dal momento che alcune catene laterali poste in prossimità del sito di legame tendono a respingere le molecole d'acqua; è inoltre sfavorevole per una molecola d'acqua dissociarsi dalla rete di legami idrogeno con cui è interconnessa alle altre molecole d'acqua per reagire con una catena laterale di un amminoacido del sito di legame. Il ligando può essere attratto mediante alcuni espedienti, come il raggruppamento in siti specifici di amminoacidi provvisti di carica, che sono quindi in grado di attrarre più facilmente ligandi di carica opposta e nel contempo di respingere quelli con la stessa carica. Le possibili interfacce tra una proteina e il suo ligando sono molti, tra le più comuni le interazioni superficie (sito di legame)-stringa (ligando), oppure elica-elica (comune nelle proteine regolatrici di geni), o ancora, più comunemente delle altre due, superficie-superficie (quanto avviene in moltissimi enzimi). La forza di legame di una proteina verso il suo ligando all'equilibrio, cioè nello stato in cui le associazioni e le dissociazioni tra la proteina e il ligando sono in egual numero, è misurata tramite la costante di equilibrio.
La velocità di dissociazione è calcolata tramite la formula: velocità associazione = koff[AB] dove [AB] è la concentrazione del complesso proteico in moli e koff è la costante di dissociazione.
La velocità di associazione è calcolata tramite la formula: velocità dissociazione = kon[A] [B], dove [A] e [B] sono le due molecole e kon è la costante di associazione.
Eguagliando le due velocità si ricava la costante di equilibrio (detta anche di affinità) Ka = [AB] / [A][B].
Maggiore è la costante di equilibrio, maggiore sarà la forza di legame, inoltre essa è una misura diretta della differenza di energia libera tra lo stato legato e dissociato della proteina. Un modello usato per determinare l'entità dell'affinità di un ligando per una proteina si basa sull'equazione di Scatchard.
Molte proteine legano particolari piccole molecole e le trasportano in altre zone di un organismo multicellulare. Queste proteine possiedono un'elevata affinità di legame quando il loro ligando è presente in alte concentrazioni, ma devono anche essere in grado di rilasciarlo quando è presente a basse concentrazioni nei tessuti bersaglio. L'esempio classico di una proteina-ligando è l'emoglobina, che trasporta in tutti i vertebrati l'ossigeno dai polmoni ad altri organi e ha stretti omologhi in ogni regno biologico.[24] Le lectine sono proteine altamente specifiche per determinati zuccheri. Svolgono un importante ruolo biologico nel processo di riconoscimento dei polisaccaridi presenti sulle membrane cellulari.[25] I recettori e gli ormoni sono proteine di legame altamente specifiche.
Le proteine transmembrana possono anche servire come proteine di trasporto del ligando alterando la permeabilità della membrana cellulare per le piccole molecole e gli ioni. La sola membrana ha un centro idrofobico attraverso il quale le molecole polari o cariche non possono diffondersi. Le proteine di membrana contengono canali interni che consentono tali molecole di entrare e uscire dalla cellula. Molte canali ionici proteici sono specializzati per selezionare solo un particolare di ioni; per esempio, i canali potassio e i canali del sodio spesso selezionano uno solo dei due ioni.[26]
Proteine strutturali
Le proteine strutturali conferiscono rigidità alle componenti biologiche che altrimenti sarebbero fluide. La maggior parte delle proteine strutturali sono proteine fibrose; per esempio, collagene ed elastina sono componenti fondamentali dei tessuti connettivi come la cartilagine mentre la cheratina si trova in strutture rigide o filamentose, come capelli, unghie, piume, zoccoli e alcune conchiglie.[27] Alcune proteine globulari possono anche svolgere una funzione strutturale, per esempio, l'actina e la tubulina sono globulari e solubili come monomeri, ma sono in grado di polimerizzare per formare fibre lunghe e rigide che compongono il citoscheletro, la struttura che permette alla cellula di mantenere la sua forma e dimensione.
Altre proteine che svolgono funzioni strutturali, sono le proteine motore come la miosina, la chinesina e la dineina, che sono in grado di generare forze meccaniche. Queste proteine sono fondamentali per la motilità cellulare degli organismi unicellulari e per gli spermatozoi di molti organismi multicellulari che si riproducono sessualmente. Esse permettono anche la contrazione dei muscoli[28] e svolgono un ruolo essenziale nel trasporto intracellulare.
Metodi di studio
Le attività e le strutture delle proteine possono essere esaminate in vitro, in vivo e in silico. Studi in vitro su proteine purificate in ambienti controllati sono utili per comprendere come una proteina svolga la sua funzione: per esempio, gli studi di cinetica enzimatica esplorano il meccanismo chimico di azione catalitica di un enzima e le relative affinità con le possibili molecole substrato. Per contro, gli esperimenti in vivo possono fornire informazioni sul ruolo fisiologico di una proteina nel contesto di una cellula o un intero organismo. Studi in silico utilizzano metodi computazionali per studiarle.
Purificazione della proteina
Per eseguire l'analisi in vitro, una proteina deve essere purificata, cioè isolata dalle altri componenti cellulari. Questo processo di solito inizia con la lisi cellulare, in cui la membrana di una cellula viene interrotta ed il suo contenuto interno rilasciato in una soluzione nota come lisato grezzo. La miscela risultante può essere purificata mediante ultracentrifugazione, che fraziona i vari componenti cellulari in parti contenenti proteine solubili; lipidi e proteine di membrana; organelli cellulari e acidi nucleici. Il fenomeno della precipitazione, con un metodo noto come salting out, può concentrare le proteine da questo lisato. Vari tipi di tecniche cromatografiche vengono poi utilizzate per isolare la proteina, o le proteine, di interesse sulla base di proprietà come il peso molecolare, carica netta e l'affinità di legame.[29] Il livello di depurazione può essere monitorato utilizzando vari tipi di gel di poliacrilammide se il peso molecolare e il punto isoelettrico della proteina desiderata sono noti, tramite spettroscopia se la proteina ha caratteristiche spettroscopiche distinguibili o mediante saggi enzimatici se la proteina possiede un'attività enzimatica. Inoltre, le proteine possono essere isolate secondo la loro carica grazie alla isoelettrofocalizzazione.[30]
Per quanto riguarda le proteine naturali, una serie di fasi di purificazione possono rendersi necessarie per ottenere proteine sufficientemente pure per le applicazioni di laboratorio. Per semplificare questo processo, l'ingegneria genetica viene spesso utilizzata al fine di aggiungere caratteristiche chimiche alle proteine che le rendano facili da isolare senza compromettere la loro struttura o attività. Si agisce inserendo un "tag" che consiste di una specifica sequenza di amminoacidi, spesso una serie di residui di istidina (un "His-tag"), vengono inserite in un terminale della proteina. Come risultato, quando il lisato viene passato su una colonna cromatografica contenente nichel, i residui di istidina legano il nichel e si aggregano alla colonna, mentre le componenti senza tag passano senza impedimenti. Un certo numero di tag diversi sono stati sviluppati per aiutare i ricercatori a isolare proteine specifiche da miscele complesse.[31]
Localizzazione cellulare

Lo studio delle proteine in vivo spesso riguarda la loro sintesi e localizzazione all'interno della cellula. Anche se molte proteine intracellulari sono sintetizzate nel citoplasma mentre quelle di membrana sono secrete nel reticolo endoplasmatico, il modo di come le proteine vengano mirate a organelli specifici o a strutture cellulari è spesso poco chiaro. Una tecnica utile per valutare la localizzazione cellulare utilizza l'ingegneria genetica per esprimere in una cellula una proteina di fusione o una chimera, costituita dalla proteina naturale di interesse legata a una "gene reporter", come la proteina fluorescente verde (GFP).[32] La posizione della proteina fusa all'interno della cellula può essere isolata ed efficacemente osservata con un microscopio[33], come mostrato nella figura a fianco.
Altri metodi per chiarire la localizzazione cellulare delle proteine richiede l'uso di marcatori per comparti noti come il reticolo endoplasmatico, il Golgi, i lisosomi o vacuoli, i mitocondri, i cloroplasti, la membrana plasmatica, ecc. Con l'uso di versioni fluorescenti di questi marcatori o tramite anticorpi markers noti, diventa molto più semplice identificare la localizzazione di una proteina di interesse. Ad esempio, l'immunofluorescenza indiretta consentirà di dimostrare la posizione. I coloranti fluorescenti sono usati per etichettare compartimenti cellulari per uno scopo simile.[34]
Esistono ulteriori possibilità. Ad esempio, l'immunoistochimica di solito utilizza un anticorpo di una o più proteine di interesse che sono coniugate ad enzimi che producono segnali sia luminescenti che cromogenici e che poi possono essere confrontati tra i campioni, consentendo di ottenere le informazioni di localizzazione. Un'altra tecnica applicabile è il confronto nel gradiente di saccarosio (o altro materiale) mediante centrifugazione isopicnica.[35] Questa tecnica è maggiormente utilizzata per studi di larga scala.
Infine, il metodo considerato il gold standard per la localizzazione cellulare è l'utilizzo del microscopio elettronico. Questa tecnica utilizza anche un anticorpo per la proteina di interesse, con tecniche di microscopia elettronica classiche. Il campione viene preparato per il normale esame al microscopio elettronico, e poi trattato con un anticorpo per la proteina di interesse che è coniugata ad un materiale estremamente elettro-denso, di solito oro. Ciò consente sia la localizzazione dei dettagli ultrastrutturali, sia della proteina di interesse.[36]
Attraverso un'altra applicazione dell'ingegneria genetica, nota come mutagenesi sito specifica, i ricercatori possono alterare la sequenza proteica e quindi la sua struttura, la sua localizzazione cellulare e la suscettibilità alla regolazione. Questa tecnica permette anche l'incorporazione di amminoacidi non naturali nelle proteine, utilizzando tRNA modificati[37] e può consentire la progettazione di nuove proteine con nuove proprietà.[38]
Proteomica
L'insieme di tutte le proteine in una cellula o in un tipo di cellule è chiamato proteoma, e lo studio di tali insiemi di dati su larga scala viene identificato come il campo della proteomica, in analogia con il nome del campo della genomica. Le tecniche chiave sperimentali della proteomica includono l'elettroforesi bidimensionale,[39] che consente la separazione di un gran numero di proteine, la spettrometria di massa,[40] che consente una rapida identificazione ad alto rendimento di proteine e il sequenziamento dei peptidi, la tecnica del microarray per le proteine,[41] che permette la determinazione dei livelli relativi a un gran numero di proteine presenti in una cellula e lo screening del doppio ibrido che consente l'analisi sistematica delle interazioni proteina-proteina.[42] Il complemento totale di tali interazioni biologicamente possibili è conosciuta come interattoma.[43] Un tentativo sistematico di determinare le strutture delle proteine che rappresentano tutte le possibili ripiegature è conosciuta come genomica strutturale.[44]
Bioinformatica
Una vasta gamma di metodi di calcolo sono stati sviluppati per analizzare la struttura, la funzione e l'evoluzione delle proteine.
Lo sviluppo di tali strumenti è stata guidata dalla grande quantità di dati genomici e proteomici disponibili per una varietà di organismi, compreso il genoma umano. È semplicemente impossibile studiare tutte le proteine sperimentalmente, quindi solo poche vengono sottoposte a esperimenti di laboratorio, mentre gli strumenti computazionali vengono utilizzati per estrapolare i dati delle proteine simili. Tali proteine omologhe possono essere efficacemente identificate in organismi imparentati alla lontana dall'allineamento di sequenze. Il genoma e la sequenza genetica possono essere determinati grazie ad una grande varietà di strumenti e sfruttando alcune proprietà. Strumenti di profiling di sequenza possono trovare i siti di enzimi di restrizione, gli open reading frame nelle sequenze nucleotidiche e prevedere le strutture secondarie. Alberi filogenetici possono essere costruiti e ipotesi evolutive sviluppate utilizzando il software speciali, come ClustalW, per quanto riguarda l'ascendenza degli organismi moderni e dei geni che esprimono. Il campo della bioinformatica è ormai indispensabile per l'analisi dei geni e delle proteine.
Previsione della struttura e simulazione

Complementare al campo della genomica strutturale, la previsione della struttura delle proteine mira a sviluppare modi efficaci per fornire modelli plausibili per le proteine la cui struttura non è ancora stata determinata sperimentalmente.[45] Il modo più efficace per prevedere una struttura, conosciuto come modellazione omologa, si basa sulla esistenza di una struttura "modello" con similarità di sequenza con la proteina che deve essere individuata; obiettivo della genomica strutturale è quello di fornire una rappresentazione sufficiente delle strutture risolte per modellare la maggior parte di quelle che non lo sono state. [46] Anche se la produzione di modelli accurati rimane una sfida in cui solo le strutture dei modelli correlati sono disponibili, è stato suggerito che l'allineamento della sequenza sia il "collo di bottiglia" di questo processo, infatti modelli molto accurati potrebbero essere realizzati se fosse noto un "perfetto" allineamento della sequenza.[47] Molti metodi di previsione della struttura sono serviti per informare il settore emergente dell'ingegneria delle proteine, in cui ripiegature della nuova proteina sono già state esaminate.[48] Un problema computazionale più complesso è la previsione delle interazioni intermolecolari, come in un docking molecolare e nelle previsioni delle interazioni proteina-proteina.[49]
I processi di ripiegamento di proteine e le interazioni possono essere simulati utilizzando tecniche di meccanica molecolare, in particolare, la dinamica molecolare e il metodo Monte Carlo, che si avvalgono sempre di più del calcolo parallelo e distribuito (progetto Folding@home;[50] modellazione molecolare su GPU). La piegatura di piccoli domini proteici alfa-elica, come la testata di villina[51] e la proteina accessorio dell'HIV[52] sono state simulate con successo al calcolatore, e metodi ibridi che combinano la dinamica molecolare standard con i calcoli della meccanica quantistica hanno permesso lo studio degli stati elettronici della rodopsina.[53]
Proteine disordinate
Molte proteine (tra il 20 e il 40% di molti proteomi) contengono grandi segmenti strutturati biologicamente funzionali e possono essere classificati come proteine intrinsecamente disordinate. Predire il disordine di una proteina è, quindi, una parte sempre più importante della caratterizzazione della loro struttura.
Utilizzo
Le proteine sono necessarie nella dieta degli animali, in quanto gli animali non possono sintetizzare tutti gli amminoacidi di cui necessitano e devono ottenere alcuni di essi (i cosiddetti amminoacidi essenziali) dal cibo. Attraverso il processo di digestione, gli animali spezzano le proteine ingerite in amminoacidi liberi, che sono successivamente impiegati nella creazione di nuove proteine strutturali, enzimi, ormoni, o come fonti di energia mediante la gluconeogenesi.
Le proteine possono essere purificate separandole dagli altri componenti cellulari utilizzando tecniche diverse, tra cui ultracentrifugazione, precipitazione, elettroforesi e cromatografia; l'avvento dell'ingegneria genetica ha reso possibili molti metodi che facilitano la purificazione proteica. I metodi comunemente usati per studiare la struttura e la funzione delle proteine includono l'immunoistochimica, la mutagenesi sito specifica, la risonanza magnetica nucleare e la spettrometria di massa.
Il ruolo nell'alimentazione


La maggior parte dei microorganismi e delle piante possono sintetizzare tutti e 20 gli amminoacidi standard, mentre gli animali (incluso l'uomo) devono ottenere alcuni di essi con la dieta.[54] Gli amminoacidi che l'organismo non può sintetizzare sono detti "amminoacidi essenziali".[55] Alcuni enzimi chiave che sintetizzano alcuni amminaocidi non sono presenti negli animali, tra cui l'aspartato chinasi, che catalizza il primo step nella sintesi di lisina, metionina e treonina a partire da aspartato. Se gli amminoacidi sono presenti nell'ambiente, i microorganismi possono risparmiare energia prelevandoli dall'ambiente circostante e limitando le proprie vie biosintetiche.
Negli animali gli amminoacidi sono ottenuti con il consumo di cibi contenenti proteine. Le proteine ingerite sono suddivise in amminoacidi tramite la digestione,[55] che generalmente prevede la denaturazione delle proteine nell'ambiente acido dello stomaco e l'idrolisi da parte di enzimi detti proteasi. Alcuni amminoacidi ingeriti sono usati nella biosintesi delle proteine, mentre altri sono convertiti in glucosio tramite la gluconeogenesi, o entrano a far parte del ciclo dell'acido citrico. Questo impiego di proteine come fonte energetica è particolarmente importante in condizioni di inedia in quanto permette di impiegare anche le proteine dell'organismo, in particolare quelle presenti a livello muscolare, come substrato per mantenere la vita.[56]
Valori nutrizionali
I due principali indici nutrizionali per gli alimenti che contengono proteine sono:
- Coefficiente di utilizzazione digestiva (C.U.D.) = (azoto assorbito / azoto introdotto con la dieta)
- Utilizzazione proteica netta (N.P.U.) = N trattenuto dall'organismo / N introdotto con la dieta. L'indice tiene conto sia dell'efficienza digestiva che del pattern di amminoacidi.
- Valore biologico (VB): indica la quantità di azoto effettivamente assorbito e utilizzato al netto delle perdite (urinarie, fecali, cutanee ecc.). Per uova e siero di latte è pari al 100%, un perfetto equilibrio tra aminoacidi assorbiti e tra amminoacidi ritenuti.
Storia ed etimologia
Le proteine sono state riconosciute come una classe distinta di molecole biologiche a partire dal XVIII secolo grazie agli studi condotti da Antoine Fourcroy ed altri, sulla base della capacità di tali sostanze di coagulare o flocculare sotto un trattamento con il calore o con l'acido.[57] In tale epoca, alcuni celebri esempi comprendevano l'albume, l'albumina del sangue, la fibrina e il glutine del frumento.
Le proteine sono state descritte dal chimico olandese Gerardus Johannes Mulder e gli fu attribuito il nome dal chimico svedese Jöns Jacob Berzelius nel 1838.[58][59] Mulder effettuò analisi elementari sulle proteine comuni e scoprì che quasi tutte avevano la stessa formula empirica, C400H620N100O120P1S1.[60] Egli giunse alla conclusione erronea che esse fossero composte da un solo tipo, ma molto grande, di molecola. Il termine "proteina" per descrivere queste molecole è stata proposta da Berzelius, collega di Mulder; il termine deriva dalla parola greca (proteios, πρώτειος), che significa "primario",[61] "in testa" o "in piedi davanti",[62] Mulder continuò a identificare i prodotti dellai degradazione delle proteine, come l'aminoacido leucina di cui calcolò un peso molecolare, quasi corretto, di 131 Da.[60]
I primi scienziati nutrizionali, come il tedesco Carl von Voit, ritenevano che la proteina fosse il nutriente più importante per il mantenimento della struttura del corpo, poiché si pensava che "carne fa carne".[63] Karl Heinrich Ritthausen estese le forme proteiche note con la scoperta dell'acido glutammico. Al Connecticut Agricultural Experiment Station fu eseguito un dettagliato esame delle proteine vegetali da parte dello scienziato Thomas Osborne Burr. Lavorando con Lafayette Mendel e applicando la legge del minimo all'alimentazione dei ratti di laboratorio, fu possibile stabilire quali fossero gli amminoacidi essenziali. Lo studio fu continuato da William Cumming Rose. Fu grazie all'opera di Franz Hofmeister e Hermann Emil Fischer che si riuscì a identificare le proteine come polipeptidi. Il ruolo centrale delle proteine come enzimi negli organismi viventi non è stato pienamente accettato fino al 1926, quando James Batcheller Sumner dimostrò che l'ureasi era in realtà una proteina.[64]
La difficoltà di isolare proteine in grandi quantità rendeva molto difficile ai primi biochimici lo studio delle proteine. Quindi, i primi esperimenti erano focalizzate su quelle che potevano essere purificate più facilmente, come quelle del sangue, l'albume d'uovo, le varie tossine e enzimi metabolici/digestivi ottenuti nei macelli. Nel 1950, la Armour and Company purificò 1 kg di ribonucleasi A dal pancreas di un bovino e lo rese disponibile gratuitamente agli scienziati; ciò fece diventare la ribonucleasi A uno strumento importante per lo studio della biochimica per i decenni successivi.[60]

Linus Pauling è riconosciuto per aver previsto le regolari strutture secondarie proteiche a base di legami idrogeno, un'idea che era già stata proposta da William Astbury nel 1933.[65] Il successivo lavoro di Walter Kauzmann sulla denaturazione,[66][67] basato in parte sul precedente studi di Kaj Linderstrøm-Lang,[68] ha contribuito una comprensione del ripiegamento delle proteine e della struttura mediata da interazioni idrofobiche.
La prima proteina sequenziata fu l'insulina nel 1949, grazie al lavoro di Frederick Sanger. Sanger determinò correttamente la sequenza di amminoacidi dell'insulina e quindi dimostrò definitivamente che le proteine sono costituite da polimeri lineari di amminoacidi anziché catene ramificate o colloidi.[69] Questa scoperta gli valse il Premio Nobel nel 1958.
Le prime strutture proteiche risolte furono quelle dell'emoglobina e della mioglobina, rispettivamente per merito di Max Perutz e Sir John Cowdery Kendrew, nel 1958.[70][71] A partire dal 2014 la Protein Data Bank possiede oltre 90.000 strutture proteiche a livello atomico.[72] In tempi più recenti, la criomicroscopia elettronica di grandi assiemi macromolecolari[73] e la predizione computazionale delle strutture proteiche dei piccoli domini proteici[74] sono due metodi di approccio alla risoluzione atomica.
Note
- ^ Gutteridge A, Thornton JM, Understanding nature's catalytic toolkit, in Trends in Biochemical Sciences, vol. 30, n. 11, 2005, pp. 622–29, DOI:10.1016/j.tibs.2005.09.006, ISSN 0968-0004, PMID 16214343.
- ^ Murray et al., p. 31.
- ^ Murray et al., p. 19.
- ^ Nelson DL, Cox MM, Lehninger's Principles of Biochemistry, 4th, New York, New York, W. H. Freeman and Company, 2005.
- ^ a b c Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipurksy SL, Darnell J, Molecular Cell Biology, 5th, New York, New York, WH Freeman and Company, 2004.
- ^ (EN) IUPAC Gold Book, "poltypeptides"
- ^ (EN) IUPAC Gold Book, "proteins"
- ^ Murray et al., pp. 30–34.
- ^ a b vanHolde1996, pp. 1002–42.
- ^ Dobson CM, The nature and significance of protein folding, in Pain RH (ed.) (a cura di), Mechanisms of Protein Folding, Oxford, Oxfordshire, Oxford University Press, 2000, pp. 1–28, ISBN 0-19-963789-X.
- ^ Thomas Bruckdorfer, Oleg Marder, Fernando Albericio, From Production of Peptides in Milligram Amounts for Research to Multi-Tons Quantities for Drugs of the Future, in Current Pharmaceutical Biotechnology, vol. 5, n. 1, 2004, pp. 29–43, DOI:10.2174/1389201043489620.
- ^ Dirk Schwarzer, Philip A Cole, Protein semisynthesis and expressed protein ligation: chasing a protein's tail, in Current Opinion in Chemical Biology, vol. 9, n. 6, 2005, pp. 561–569, DOI:10.1016/j.cbpa.2005.09.018.
- ^ Stephen B. H. Kent, Total chemical synthesis of proteins, in Chemical Society Reviews, vol. 38, n. 2, 2009, p. 338, DOI:10.1039/b700141j.
- ^ Voet D, Voet JG. (2004). Biochemistry Vol 1 3rd ed. Wiley: Hoboken, NJ.
- ^ Sankaranarayanan R, Moras D, The fidelity of the translation of the genetic code, in Acta Biochimica Polonica, vol. 48, n. 2, 2001, pp. 323–35, PMID 11732604.
- ^ van Holde and Mathews, pp. 830–49.
- ^ Copland JA, Sheffield-Moore M, Koldzic-Zivanovic N, Gentry S, Lamprou G, Tzortzatou-Stathopoulou F, Zoumpourlis V, Urban RJ, Vlahopoulos SA, Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible?, in BioEssays: news and reviews in molecular, cellular and developmental biology, vol. 31, n. 6, 2009, pp. 629–41, DOI:10.1002/bies.200800138, PMID 19382224.
- ^ Samarin S, Nusrat A, Regulation of epithelial apical junctional complex by Rho family GTPases, in Frontiers in bioscience: a journal and virtual library, vol. 14, n. 14, 2009, pp. 1129–42, DOI:10.2741/3298, PMID 19273120.
- ^ Bairoch A, The ENZYME database in 2000 (PDF), in Nucleic Acids Research, vol. 28, n. 1, 2000, pp. 304–305, DOI:10.1093/nar/28.1.304, PMC 102465, PMID 10592255 (archiviato dall'url originale il 1º giugno 2011).
- ^ Radzicka A, Wolfenden R, A proficient enzyme, in Science, vol. 267, n. 5194, 1995, pp. 90–93, Bibcode:1995Sci...267...90R, DOI:10.1126/science.7809611, PMID 7809611.
- ^ EBI External Services, The Catalytic Site Atlas at The European Bioinformatics Institute, su ebi.ac.uk, 20 gennaio 2010. URL consultato il 16 gennaio 2011 (archiviato dall'url originale il 7 maggio 2019).
- ^ Branden and Tooze, pp. 251–81.
- ^ van Holde and Mathews, pp. 247–50.
- ^ van Holde and Mathews, pp. 220–29.
- ^ Rüdiger H, Siebert HC, Solís D, Jiménez-Barbero J, Romero A, von der Lieth CW, Diaz-Mariño T, Gabius HJ, Medicinal chemistry based on the sugar code: fundamentals of lectinology and experimental strategies with lectins as targets, in Current Medicinal Chemistry, vol. 7, n. 4, 2000, pp. 389–416, DOI:10.2174/0929867003375164, PMID 10702616.
- ^ Branden and Tooze, pp. 232–34.
- ^ van Holde and Mathews, pp. 178–81.
- ^ van Holde and Mathews, pp. 258–64; 272.
- ^ Murray et al., pp. 21–24.
- ^ Hey J, Posch A, Cohen A, Liu N, Harbers A, Fractionation of complex protein mixtures by liquid-phase isoelectric focusing, in Methods in Molecular Biology, Methods in Molecular Biology™, vol. 424, 2008, pp. 225–39, DOI:10.1007/978-1-60327-064-9_19, ISBN 978-1-58829-722-8, PMID 18369866.
- ^ Terpe K, Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems, in Applied Microbiology and Biotechnology, vol. 60, n. 5, 2003, pp. 523–33, DOI:10.1007/s00253-002-1158-6, PMID 12536251.
- ^ Stepanenko OV, Verkhusha VV, Kuznetsova IM, Uversky VN, Turoverov KK, Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes, in Current Protein & Peptide Science, vol. 9, n. 4, 2008, pp. 338–69, DOI:10.2174/138920308785132668, PMC 2904242, PMID 18691124.
- ^ Yuste R, Fluorescence microscopy today, in Nature Methods, vol. 2, n. 12, 2005, pp. 902–904, DOI:10.1038/nmeth1205-902, PMID 16299474.
- ^ Margolin W, Green fluorescent protein as a reporter for macromolecular localization in bacterial cells, in Methods (San Diego, Calif.), vol. 20, n. 1, 2000, pp. 62–72, DOI:10.1006/meth.1999.0906, PMID 10610805.
- ^ Walker JH, Wilson K, Principles and Techniques of Practical Biochemistry, Cambridge, UK, Cambridge University Press, 2000, pp. 287–89, ISBN 0-521-65873-X.
- ^ Mayhew TM, Lucocq JM, Developments in cell biology for quantitative immunoelectron microscopy based on thin sections: a review, in Histochemistry and Cell Biology, vol. 130, n. 2, 2008, pp. 299–313, DOI:10.1007/s00418-008-0451-6, PMC 2491712, PMID 18553098.
- ^ Hohsaka T, Sisido M, Incorporation of non-natural amino acids into proteins, in Current Opinion in Chemical Biology, vol. 6, n. 6, 2002, pp. 809–15, DOI:10.1016/S1367-5931(02)00376-9, PMID 12470735.
- ^ Cedrone F, Ménez A, Quéméneur E, Tailoring new enzyme functions by rational redesign, in Current Opinion in Structural Biology, vol. 10, n. 4, 2000, pp. 405–10, DOI:10.1016/S0959-440X(00)00106-8, PMID 10981626.
- ^ Görg A, Weiss W, Dunn MJ, Current two-dimensional electrophoresis technology for proteomics, in Proteomics, vol. 4, n. 12, 2004, pp. 3665–85, DOI:10.1002/pmic.200401031, PMID 15543535.
- ^ Conrotto P, Souchelnytskyi S, Proteomic approaches in biological and medical sciences: principles and applications, in Experimental Oncology, vol. 30, n. 3, 2008, pp. 171–80, PMID 18806738.
- ^ Joos T, Bachmann J, Protein microarrays: potentials and limitations, in Frontiers in Bioscience, vol. 14, n. 14, 2009, pp. 4376–85, DOI:10.2741/3534, PMID 19273356.
- ^ Koegl M, Uetz P, Improving yeast two-hybrid screening systems, in Briefings in Functional Genomics & Proteomics, vol. 6, n. 4, 2007, pp. 302–12, DOI:10.1093/bfgp/elm035, PMID 18218650 (archiviato dall'url originale il 14 aprile 2009).
- ^ Plewczyński D, Ginalski K, The interactome: predicting the protein–protein interactions in cells, in Cellular & Molecular Biology Letters, vol. 14, n. 1, 2009, pp. 1–22, DOI:10.2478/s11658-008-0024-7, PMID 18839074.
- ^ Zhang C, Kim SH, Overview of structural genomics: from structure to function, in Current Opinion in Chemical Biology, vol. 7, n. 1, 2003, pp. 28–32, DOI:10.1016/S1367-5931(02)00015-7, PMID 12547423.
- ^ Zhang Y, Progress and challenges in protein structure prediction, in Current Opinion in Structural Biology, vol. 18, n. 3, 2008, pp. 342–48, DOI:10.1016/j.sbi.2008.02.004, PMC 2680823, PMID 18436442.
- ^ Xiang Z, Advances in homology protein structure modeling, in Current Protein and Peptide Science, vol. 7, n. 3, 2006, pp. 217–27, DOI:10.2174/138920306777452312, PMC 1839925, PMID 16787261.
- ^ Zhang Y, Skolnick J, The protein structure prediction problem could be solved using the current PDB library, in Proceedings of the National Academy of Sciences U.S.A., vol. 102, n. 4, 2005, pp. 1029–34, Bibcode:2005PNAS..102.1029Z, DOI:10.1073/pnas.0407152101, PMC 545829, PMID 15653774.
- ^ Kuhlman B, Dantas G, Ireton GC, Varani G, Stoddard BL, Baker D, Design of a novel globular protein fold with atomic-level accuracy, in Science, vol. 302, n. 5649, 2003, pp. 1364–68, Bibcode:2003Sci...302.1364K, DOI:10.1126/science.1089427, PMID 14631033.
- ^ Ritchie DW, Recent progress and future directions in protein–protein docking, in Current Protein and Peptide Science, vol. 9, n. 1, 2008, pp. 1–15, DOI:10.2174/138920308783565741, PMID 18336319.
- ^ Scheraga HA, Khalili M, Liwo A, Protein-folding dynamics: overview of molecular simulation techniques, in Annual Review of Physical Chemistry, vol. 58, 2007, pp. 57–83, Bibcode:2007ARPC...58...57S, DOI:10.1146/annurev.physchem.58.032806.104614, PMID 17034338.
- ^ Zagrovic B, Snow CD, Shirts MR, Pande VS, Simulation of folding of a small alpha-helical protein in atomistic detail using worldwide-distributed computing, in Journal of Molecular Biology, vol. 323, n. 5, 2002, pp. 927–37, DOI:10.1016/S0022-2836(02)00997-X, PMID 12417204.
- ^ Herges T, Wenzel W, In silico folding of a three helix protein and characterization of its free-energy landscape in an all-atom force field, in Physical Review Letters, vol. 94, n. 1, 2005, p. 018101, Bibcode:2005PhRvL..94a8101H, DOI:10.1103/PhysRevLett.94.018101, PMID 15698135.
- ^ Hoffmann M, Wanko M, Strodel P, König PH, Frauenheim T, Schulten K, Thiel W, Tajkhorshid E, Elstner M, Color tuning in rhodopsins: the mechanism for the spectral shift between bacteriorhodopsin and sensory rhodopsin II, in Journal of the American Chemical Society, vol. 128, n. 33, 2006, pp. 10808–18, DOI:10.1021/ja062082i, PMID 16910676.
- ^ Donald Voet, Judith G. Voet; Charlotte W. Pratt, Fundamentals of Biochemistry: Life at the Molecular Level, John Wiley & Sons, 1º aprile 2008, p. 1264, ISBN 978-0-470-23396-2.
- ^ a b Briggs.
- ^ JT. Brosnan, Interorgan amino acid transport and its regulation., in J Nutr, vol. 133, 6 Suppl 1, giugno 2003, pp. 2068S-2072S, PMID 12771367.
- ^ Thomas Burr Osborne (1909): The Vegetable Proteins, History pp 1 to 6, from archive.org
- ^ Bulletin des Sciences Physiques et Naturelles en Néerlande (1838). pg 104. SUR LA COMPOSITION DE QUELQUES SUBSTANCES ANIMALES
- ^ Hartley Harold, Origin of the Word 'Protein.', in Nature, vol. 168, n. 4267, 1951, pp. 244–244, DOI:10.1038/168244a0.
- ^ a b c Perrett D, From 'protein' to the beginnings of clinical proteomics, in Proteomics: Clinical Applications, vol. 1, n. 8, 2007, pp. 720–38, DOI:10.1002/prca.200700525, PMID 21136729.
- ^ Reynolds JA, Tanford C, Nature's Robots: A History of Proteins (Oxford Paperbacks), New York, New York, Oxford University Press, 2003, p. 15, ISBN 0-19-860694-X.
- ^ New Oxford Dictionary of English
- ^ (DE) Bischoff TLW, Voit, C, Die Gesetze der Ernaehrung des Pflanzenfressers durch neue Untersuchungen festgestellt, Leipzig, Heidelberg, 1860.
- ^ Sumner JB, The isolation and crystallization of the enzyme urease. Preliminary paper (PDF), in Journal of Biological Chemistry, vol. 69, n. 2, 1926, pp. 435–41.
- ^ Pauling L, Corey RB, Branson HR, The structure of proteins: two hydrogen-bonded helical configurations of the polypeptide chain (PDF), in Proceedings of the National Academy of Sciences U.S.A., vol. 37, n. 5, 1951, pp. 235–40, Bibcode:1951PNAS...37..235P, DOI:10.1073/pnas.37.5.235, PMC 1063348, PMID 14834145.
- ^ Kauzmann W, Structural factors in protein denaturation, in Journal of Cellular Physiology. Supplement, vol. 47, Suppl 1, 1956, pp. 113–31, DOI:10.1002/jcp.1030470410, PMID 13332017.
- ^ Kauzmann W, Some factors in the interpretation of protein denaturation, in Advances in Protein Chemistry, Advances in Protein Chemistry, vol. 14, 1959, pp. 1–63, DOI:10.1016/S0065-3233(08)60608-7, ISBN 978-0-12-034214-3, PMID 14404936.
- ^ Kalman SM, Linderstrom-Lang K, Ottesen M, Richards FM, Degradation of ribonuclease by subtilisin, in Biochimica et Biophysica Acta, vol. 16, n. 2, 1955, pp. 297–99, DOI:10.1016/0006-3002(55)90224-9, PMID 14363272.
- ^ Sanger F, The terminal peptides of insulin, in Biochemical Journal, vol. 45, n. 5, 1949, pp. 563–74, PMC 1275055, PMID 15396627.
- ^ Muirhead H, Perutz M, Structure of hemoglobin. A three-dimensional fourier synthesis of reduced human hemoglobin at 5.5 Å resolution, in Nature, vol. 199, n. 4894, 1963, pp. 633–38, Bibcode:1963Natur.199..633M, DOI:10.1038/199633a0, PMID 14074546.
- ^ Kendrew J, Bodo G, Dintzis H, Parrish R, Wyckoff H, Phillips D, A three-dimensional model of the myoglobin molecule obtained by X-ray analysis, in Nature, vol. 181, n. 4610, 1958, pp. 662–66, Bibcode:1958Natur.181..662K, DOI:10.1038/181662a0, PMID 13517261.
- ^ RCSB Protein Data Bank, su rcsb.org. URL consultato il 5 aprile 2014 (archiviato dall'url originale il 18 aprile 2015).
- ^ Zhou ZH, Towards atomic resolution structural determination by single-particle cryo-electron microscopy, in Current Opinion in Structural Biology, vol. 18, n. 2, 2008, pp. 218–28, DOI:10.1016/j.sbi.2008.03.004, PMC 2714865, PMID 18403197.
- ^ Keskin O, Tuncbag N, Gursoy A, Characterization and prediction of protein interfaces to infer protein-protein interaction networks, in Current Pharmaceutical Biotechnology, vol. 9, nº 2, 2008, pp. 67–76, DOI:10.2174/138920108783955191, PMID 18393863.
Bibliografia
- (EN) Christopher K. Mathews, Kensal Edward Van Holde, Biochemistry: Guide, Benjamin-Cummings Publishing Company, 1996, ISBN 978-0-8053-3931-4.
- (EN) Dobson CM, The nature and significance of protein folding, in Pain RH (ed.) (a cura di), Mechanisms of Protein Folding, Oxford, Oxfordshire, Oxford University Press, 2000, ISBN 0-19-963789-X.
- (EN) Walker JH, Wilson K, Principles and Techniques of Practical Biochemistry, Cambridge, UK, Cambridge University Press, 2000, ISBN 0-521-65873-X.
- (EN) Donald Voet, Judith G. Voet; Charlotte W. Pratt, Fundamentals of Biochemistry: Life at the Molecular Level, John Wiley & Sons, 2008, ISBN 978-0-470-23396-2.
- (EN) Reynolds JA, Tanford C, Nature's Robots: A History of Proteins (Oxford Paperbacks), New York, New York, Oxford University Press, 2003, ISBN 0-19-860694-X.
- (EN) David Briggs, Mark Wahlqvist, Visionary Voyager, Food Facts - Protein, Penguin Books, 1998. URL consultato il 17 novembre 2016 (archiviato dall'url originale il 7 ottobre 2016).
Voci correlate
Altri progetti
 Wikiquote contiene citazioni sulle proteine
Wikiquote contiene citazioni sulle proteine Wikibooks contiene testi o manuali sulle proteine
Wikibooks contiene testi o manuali sulle proteine Wikizionario contiene il lemma di dizionario «proteina»
Wikizionario contiene il lemma di dizionario «proteina» Wikimedia Commons contiene immagini o altri file sulle proteine
Wikimedia Commons contiene immagini o altri file sulle proteine
Collegamenti esterni
- proteina, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- proteina, su sapere.it, De Agostini.
- (EN) Felix Haurowitz e Daniel E. Koshland, protein, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Opere riguardanti Proteine, su Open Library, Internet Archive.
- Esperienze in laboratorio - Le proteine, su itchiavari.org.
- Purificazione di proteine e dosaggio quantitativo: descrizione delle tecniche di purificazione delle proteine, principio ed esempi di dosaggio quantitativo.
- Il cibo e le proteine, su my-personaltrainer.it.
| Controllo di autorità | Thesaurus BNCF 51 · LCCN (EN) sh85107666 · GND (DE) 4076388-2 · BNF (FR) cb11936447p (data) · J9U (EN, HE) 987007541252605171 · NDL (EN, JA) 00572676 |
|---|

















