The US FDA’s proposed rule on laboratory-developed tests: Impacts on clinical laboratory testing
Indice
Legame peptidico
In natura rivestono enorme importanza i polimeri costituiti dagli amminoacidi uniti con legame peptidico: i peptidi (costituiti da meno di 100 amminoacidi) e le proteine. Questi sono caratterizzati da una sequenza ben precisa di amminoacidi (la così detta struttura primaria). Da alcune caratteristiche del legame peptidico dipendono molte delle proprietà di tali polimeri. Risulta perciò opportuno descriverlo nel dettaglio.
| Legame peptidico | Un peptide |
 |
 |
 |
Il legame peptidico può essere considerato derivato dall'attacco nucleofilo del gruppo amminico di un amminoacido al carbonio carbossilico di un altro amminoacido. Ne risulta un gruppo ammidico, efficacemente descritto mediante due strutture limite di risonanza, come mostrato nella prima figura. La seconda fa intuire come il legame tra carbonio ed azoto abbia un parziale carattere di doppio legame, che porta ad una rotazione non libera di un residuo amminoacidico rispetto all'altro. Secondo alcune stime[1] la seconda struttura ha un peso del 40% nella descrizione del gruppo ammidico. Per ragioni di ingombro sterico la configurazione trans (E) è favorita di circa 1000 volte rispetto alla cis in tutti gli amminoacidi, con l'eccezione della prolina.[2] Solomons[1] definisce transoide questa configurazione.
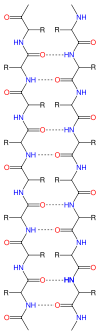
Gli atomi di carbonio e azoto legati con legame peptidico costituiscono la catena principale di peptidi (STRUTTURA PRIMARIA delle proteine). La costituzione degli amminoacidi fa sì che tale catena presenti ad una estremità un amminoacido con un gruppo carbossilico libero, detto C terminale e all'altra un amminoacido con un gruppo amminico libero, detto N terminale. I residui "R" di ciascun amminoacido costituiscono le catene laterali.
| Il contenuto di questa sezione è da raffinare | |
| Di-terzbutilcarbonato | Allontanamento del gruppo boc |
|---|---|

|

|
La sintesi in laboratorio di un peptide è basata sull'attacco nucleofilo da parte di un gruppo amminico di un amminoacido nei confronti del gruppo carbossilico di un secondo amminoacido. Per evitare che il gruppo amminico della seconda molecola attacchi quello carbossilico della prima, è necessario trasformarlo in uno meno nucleofilo. Tipicamente lo si trasforma nel gruppo Boc (terz-Butil ossi carbonilico) o nel gruppo Fmoc (Fluorenil-metossi-carbonilico). L'introduzione del gruppo Boc risulta particolarmente comoda poiché può avvenire in acqua leggermente basificata con bicarbonato di sodio. È introdotto mediante l'utilizzo di Di-terz-butil bicarbonato.
Perché l'attacco nucleofilo avvenga in condizioni blande è opportuno "attivare" il gruppo carbossilico, sostituendo il gruppo -OH con un miglior gruppo uscente. Questa trasformazione può essere effettuata con l'impiego di DCC (Dicicloesil-carbodiimmide), secondo il seguente schema

Esiste anche la possibilità di generare peptidi che hanno le caratteristiche opportune per autoconcatenarsi. La ricerca di peptidi caratterizzati da queste insolite proprietà non è solamente una curiosità, ma riveste importanza nella ricerca delle reazioni chimiche che hanno (eventualmente) portato alla nascita di molecole complesse a partire da molecole più semplici agli albori della vita sulla terra. [1]
- Bibliografia della scheda
Struttura secondaria
Col termine di struttura secondaria si indicano cumulativamente le conformazioni della catena proteica determinate dalle interazioni tra gli atomi della catena principale. Tali conformazioni sono solitamente raggruppate per tipologia, come riportato nello schema sotto.
| Schema delle possibili strutture secondarie delle proteine | ||
|---|---|---|
| Eliche: | α-eliche | 310 eliche | π-eliche | β-eliche | Eliche proliniche | Eliche del collagene | |
| Estese: | Fogli-β | Turns | Beta arpine | Beta bulge | Fglio-α | |
| Super-secondarie: | Coiled coil | Helix-turn-helix | EF hand | |
| Ruolo degli amminoacidi nelle strutture secondarie | ||
| Pro-Eliche: | Metionina | Alanina | Leucina | Acido Glutamico | Glutammina | Lisina | |
| Pro-Estesa: | Treonina | Isoleucina | Valina | Fenilalanina | Tirosina | Triptofano | |
| Pro-Disordinata: | Serina | Prolina | Asparagina | acido Aspartico | |
| Senza preferenza: | Istidina | Arginina | |
foglio-β
Tra le catene principali di alcuni tratti di peptidi e proteine si possono stabilire legami ponte a idrogeno, che costringono le catene a giacere sullo stesso piano. Sono noti peptidi a proteine in cui le catene risultano orientate nella stessa direzione o in direzioni opposte. La perfetta coplanarità di due amminoacidi legati da un legame peptidico risulta energeticamente sfavorita dalla repulsione di tipo sterico tra i rispettivi gruppi R. È per questo che il piano identificato dalle catene risulta in realtà pieghettato, a dare il così detto foglio β rappresentato sotto.
α-elica
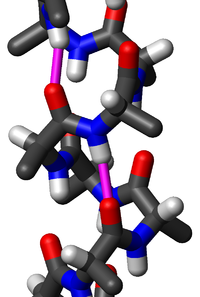
Quando i gruppi R sono particolarmente voluminosi può risultare più stabile un'altra configurazione, quella ad α-elica. Si tratta di un arrangiamento elicoidale destrogiro causato da legami tipo ponte idrogeno tra il gruppo N-H di residui amminoacidici e il gruppo C=O degli amminoacidi distanti 3 residui. Le eliche possono comprendere da 4 a più di 40 residui. Le strutture tridimensionali foglio-β e α-elica prendono cumulativamente il nome di strutture secondarie delle proteine.
Le strutture secondarie possono essere convertite le une nelle altre da modifiche all'ambiente nel quale la proteina o il polipeptide si trovano. Ad esempio Wu, [3], mediante microspettroscopia FT-IR (trasformata di Fourier di spettri all'infrarosso) nota come una veloce cottura della carne faccia sì che le strutture ad α-elica delle proteine si riarrangino in parte a fogli-β.
Struttura terziaria
Tra le catene laterali si stabiliscono interazioni che portano a ripiegamenti ulteriori rispetto a quelli dati da fogli-β e α-eliche eccetera, la così detta struttura terziaria. Tali interazioni sono di tipo debole tra amminoacidi idrofobici, interazioni dipolari tra amminoacidi con carica opposta, legami ponte idrogeno o legami a ponte disolfuro. Complessivamente questo insieme di legami porta ad esporre al solvente (in condizioni fisiologiche l'acqua) le parti polari della catena, ospitando all'interno della proteina o del peptide le parti non polari.
Suddivisione in proteine fibrose e globulari :
Hart[4] propone una eccessiva (si veda poco oltre perché) ma efficace suddivisione delle proteine in base alla loro struttura terziaria.
- Le proteine fibrose sono insolubili in acqua e costituiscono gli elementi strutturali dei tessuti animali. Hart identifica tre categorie: le cheratine, che costituiscono la pelle, i capelli, le piume e, in generale, i tessuti protettivi; i collageni, che troviamo nei tessuti connettivi, ad esempio nelle cartilagini e nei tendini; le sete, delle quali le ragnatele e i bozzoli dei bachi da seta sono un esempio.
- Le proteine globulari sono generalmente solubili in acqua, di forma approssimativamente sferica e specializzate nello svolgere funzioni biologiche. Ormoni, proteine di trasporto e di deposito ne sono un esempio.
Questa suddivisione è senza dubbio eccessiva. Horne[5] afferma che "Una larga porzione del codice genetico codifica [...] lunghe catene amminoacidiche che probabilmente non sono foldate in soluzione o che adottano strutture non globulari dall'ignota conformazione. [...] La loro mancata strutturazione facilita una risposta rapida e accurata a cambiamenti ambientali."
Legami disolfuro :
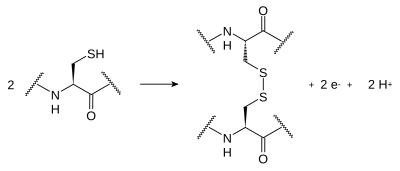
I legami disolfuro si formano tra atomi di zolfo facenti parte delle catene laterali di due cisteine. Ciò che avviene può essere descritto come una ossidazione reversibile che porta ad un legame covalente (S-S). Il legame, che prende il nome di "ponte disolfuro", tipicamente non si forma sulla superficie della proteina, a causa della presenza nel citoplasma di agenti riducenti. questi legami sono fondamentali nella determinazione della forma della proteina. È interessante notare come molte proteine strutturali, che richiedono una elevata stabilità, siano caratterizzate da un alto numero di legami di questo tipo. Un esempio è dato della cheratina, che si trova nelle unghie.
Struttura quaternaria
La struttura quaternaria di una proteina è quella dovuta a modifiche, cofattori (tipo vitamine e nucleotidi), gruppi prostetici (gruppo EME, legami con ioni metallici), glicosilazione (il legame con residui zuccherini attraverso residui di serina e asparagina), e l'agglomerazione di catene polipeptidiche a dare proteine multicatena.
Curiosità
Bibliografia
- ↑ 1,0 1,1 T.W.G. Solomons. Amminoacidi e Proteine. In Chimica Organica. Ed. Editoriale Grasso. Bologna.
- ↑ http://www.sciencecollege.co.uk/SC/biochemicals.html
- ↑ Z. Wu, H.C. Bertram, U. Bocker, R. Ofstad and A. Kohler. Myowater Dynamics and Protein Secondary Structural Changes As Affected by Heating Rate in Three Pork Qualities: A Combined FT-IR Microspectroscopic and 1H NMR Relaxometry Study. J. Agric. Food Chem. 55(10):3990 -3997 (2007)
- ↑ H. Hart, L.E. Craine and D.J. Hart. Amminoacidi, Peptidi e Proteine. In:Chimica Organica, quarta edizione italiana. Ed. Zanichelli. (2003).
- ↑ D.S. Horne. Casein structure, self-assembly and gelation. Current Opinion in Colloid & Interface Science 7:456-461 (2002)