The US FDA’s proposed rule on laboratory-developed tests: Impacts on clinical laboratory testing
Sommaire
| Pentafluorure de brome | |
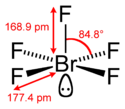  |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.234 |
| No CE | 232-157-8 |
| No RTECS | EF9350000 |
| PubChem | 24606 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à l'odeur piquante |
| Propriétés chimiques | |
| Formule | BrF5 [Isomères] |
| Masse molaire[1] | 174,896 ± 0,001 g/mol Br 45,69 %, F 54,31 %, |
| Propriétés physiques | |
| T° fusion | −60,5 °C[2] |
| T° ébullition | 40,76 °C[2] |
| Solubilité | Se décompose au contact de l'eau |
| Masse volumique | 2,466 g·cm-3[2] à 25 °C |
| Pression de vapeur saturante | 41,3 kPa[2] à 20 °C |
| Précautions | |
| SGH[2] | |
| H271, H301, H311, H314 et H330 |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| |
|
Le pentafluorure de brome est un interhalogène de formule chimique BrF5. Il s'agit d'un liquide incolore à l'odeur très piquante et formant des fumées au contact de l'air. Il se décompose de manière explosive au contact de l'eau et attaque pratiquement tous les matériaux. La réaction avec les matières organiques est souvent violente, voire explosive. Il attaque lentement le verre à température ambiante, mais n'attaque pratiquement pas le quartz. Il n'est pas combustible mais peut déclencher des incendies par réaction violente avec des matières combustibles et attiser des incendies préexistants. C'est un puissant agent de fluoration. Il a été produit pour la première fois en 1931 par réaction directe du brome Br2 avec le fluor F2[3]. Cette réaction permet d'en produire de grandes quantités et est réalisée à 150 °C avec un excès de fluor :
La préparation de quantités plus réduites passe par le bromure de potassium[3] :
Cette voie de synthèse produit un pentafluorure de brome quasiment entièrement dépourvu de trifluorures et d'autres impuretés[3].
Le pentafluorure de brome est utilisé en analyse isotopique de l'oxygène. Les silicates solides sont traités par ablation laser en présence de BrF5, ce qui libère de l'oxygène O2 pour analyse ultérieure[4]. Il a également été étudié comme oxydant pour propergols liquides en astronautique ainsi que comme agent de fluoration dans le traitement de l'uranium.
Le pentafluorure de brome réagit de manière explosive au contact de l'eau, mais peut former, lorsqu'il est dissous dans l'acétonitrile CH3CN, de l'acide bromique HBrO3 et de l'acide fluorhydrique HF(aq) par simple hydrolyse :
C'est un agent de fluoration très efficace, qui convertit la plupart des composés de l'uranium en hexafluorure d'uranium UF6 à température ambiante.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Bromine pentafluoride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 mai 2017 (JavaScript nécessaire)
- (en) Gene A. Hyde et Max M. Boudakian, « Synthesis routes to chlorine and bromine pentafluorides », Inorganic Chemistry, vol. 7, no 12, , p. 2648-2649 (DOI 10.1021/ic50070a039, lire en ligne)
- (en) Robert N. Clayton et Toshiko K. Mayeda, « The use of bromine pentafluoride in the extraction of oxygen from oxides and silicates for isotopic analysis », Geochimica et Cosmochimica Acta, vol. 27, no 1, , p. 43-62 (DOI 10.1016/0016-7037(63)90071-1, Bibcode 1963GeCoA..27...43C, lire en ligne)























