Sigma metrics as a valuable tool for effective analytical performance and quality control planning in the clinical laboratory: A retrospective study
Садржај
Катализа је процес повећања брзине хемијске реакције додавањем супстанце познате као катализатор.[1][2] Другим речима, катализатор је хемијска супстанција, која се додаје реакционом систему да би убрзала реакцију.[3][4][5] Катализатори се не троше у катализованој реакцији, али могу деловати више пута. Често су потребне само врло мале количине катализатора.[6] Глобална потражња за катализаторима у 2010. процењена је на приближно 29,5 милијарди америчких долара.[7]
Техничка перспектива
У присуству катализатора, мање слободне енергије је неопходно да се постигне прелазно стање, док се тотална слободна енергија од реактаната до производа не мења.[1] Катализатор може да учествује у вишеструким хемијским трансформацијама. Ефекат катализатора може да варира услед присуства других супстанци познатих као инхибитори или отрови (које редукују каталитичку активност), или промотори (који повећавају активност). Материја са супротним дејством од катализатора, супстанца која редукује брзину реакције, је инхибитор.[1]
Катализоване реакције имају нижу енергију активације (слободну енергију активације која ограничава брзину) него кореспондирајуће некатализоване реакције, што доводи до већих брзина реакције на датој температури и концентрацијама реактаната. Међутим, детаљна механика катализе је комплексна. Катализатори могу повољно да утичу на реакционо окружење, или да вежу реагенсе и поаризују везе, нпр. кисели катализатори за реакције карбонилних једињења, или да формирају специфичне интермедијере који се природно не формирају, као што су осмијумски естри у осмијум тетроксидом катализованој дихидроксилацији алкена, или да узрокују дисоцијацију реагенаса до реактивних форми, као што је хемисорбовани водоник и каталитичкој хидрогенацији.
Кинетички, каталитичке реакције су типичне хемијске реакције; тј. брзина реакције зависи од учесталости контакта реактаната у кораку који одређује брзину. Обично, катализатор учествује у том најспоријем кораку, и брзине су ограничене количином катализатора и његовом „активношћу“. У хетерогеној катализи, дифузија реагенаса до порвшине и дифузија продуката са површине могу да одређују брзину. Катализатор базиран на наноматеријалу је пример хетерогеног катализатора. Аналогни догађаји везани за везивање субстрата и дисоцијацију продукта важе за хомогену катализу.
Мада се катализатори не троше у самој реакцији, може да дође до њихове инхибиције, деактивације, или уништења секундарним процесима. У хетерогеној катализи, типични секундарни процес је кокинг, при коме катализатор постаје покривен полимерним нуспродуктима. Додатно, може доћи до растварања хетерогених катализатора у систему са чвстом и течном фазом или сублимације у чврстом-гасовитом систему.
Залеђина
Продукција већине индустријски важнијих хемикалија обухвата катализаторе. Слично томе, већина биохемијски значајних процеса је катализована. Истраживање катализе је значајно поље примењене науке које обухвата многе области хемије, као што су органометална хемија и наука о материјалима. Катализа је релевантна за многе аспекте науке о животној средини, e.g. за каталитички конвертер у аутомобилима и за динамику озонских рупа. Каталитичке реакције су преферентне у еколошки настројеној зеленој хемији, због умањених количина генерисаног отпада,[8] за разлику од стехиометријских реакција у којима се сви реактанти конзумирају и више нуспроизвода се формира. Најзаступљенији катализатор је јон водоника (H+). Многи прелазни метали и комплекси прелазних метала се исто тако користе у катализи. Катализатори звани ензими су важни у биологији.
Катализатор делује путем пружања алтернативног реактивног пута до реакционог продукта. Брзина реакције се повећава пошто та алтернативна рута има нижу енергију активације од реакционог пута који није посредован катализатором. Диспропорционацијом водоник пероксида креира се вода и кисеоник, као што је приказано испод.
- 2 H2O2 → 2 H2O + O2
Ова реакција је преферентна у смислу да су реакциони продукти стабилнији од полазног материјала, мада је некатализована реакција спора. Заправо, декомпозиција водоник пероксида је толико спора да су водени раствори водоник пероксида комерцијално доступни. На ову реакцију моћно утичу катализатори као што је манган диоксид, или ензим пероксидаза у организмима. Након адиције мале количине манган диоксида, водоник пероксид брзо реагује. Тај ефекат се лако може запазити по отпуштању мехура кисеоника.[9] Манган диоксид се не конзумира у реакцији, и може се повратити у непромењеном стању, и поновно користити.[10]
Општи принципи
Реакција без катализатора:
Реакција са катализатором:
Механизам деловања катализатора је такав да он смањује енергију активације (енергију потребну довести споља систему да би дошло де реакције) градећи са реактантима прелазни комплекс (у датом примеру то би био нестабилни [ABK] комплекс) мањег енергетског садржаја него што је он за прелазни комплекс реактаната без везаног катализатора. Како је пут криве на одговарајућем енергетском дијаграму краћи и сама реакција је бржа иако ће енергија коначних производа бити иста за катализовану и за некатализовану реакцију.
Катализатор не утиче на положај повратне реакције, јер у истом степену убрзава реакцију у оба смера. Катализатор само убрзава постизање термодинамичке равнотеже. Катализатор може да повећа селективност реакције уколико убрзава стварање главног продукта, а не убрзава (или мање убрзава) споредне реакције. Иако учествује у хемијској реакцији, катализатор после завршене реакције остаје хемијки непромењен, али може доћи до физичке промене (нпр. промена агрегатног стања).
Посебно важна група катализатора су биокатализатори односно ензими које катализују биохемијске реакције у организмима. Ензими су посебно ефикасни катализатори специфичног дејства. То значи да делују на тачно одређену супстанцу (супстрат), катализујући тачно одређену реакцију коју убрзавају и неколико хиљада пута.
Тврдња која се јавља у неким школским уџбеницима да катализатор нема удео у хемијској реакцији је потпуно нетачна.
Јединице
Каталитичка активност се обично означава симболом z[11] и мери се у mol/s, јединици која се назива катал и чиме се дефинише СИ јединица за каталитичку активност од 1999. године. Каталитичка активност није тип реакционе брзине, него својство катализатора под одређеним условима, у контексту специфичне хемијске реакције. Каталитичка активност од једног катала (Симбол 1 кат = 1 mol/s) катализатора означава количину катализатора (супстанце у моловима) која доводи до нето реакције од једног мола у секонди реактанта, до резултујућег реагенса, или другог ишода који се остварује том хемијском реакцијом. Катализаторм може да и обично има различиту каталитичку активност за различите реакције.
Постоје додатне изведене СИ јединице везане за каталитичку активност; погледајте горњу референцу за детаље.
Типични механизам
Катализатори генерално реагују са једним или више реактаната и формирају интермедијере, који затим дају финалне реакционе продукте, чиме се регенерише катализатор. Ово је типична реакциона шема, где C представља катализатор, X у Y су реактанти, а Z је продукт реакције X и Y:
- X + C → XC (1)
- Y + XC → XYC (2)
- XYC → CZ (3)
- CZ → C + Z (4)
Мада се катализатор конзумира у реакцији 1, он се накнадно формира у реакцији 4, тако да се не јавља у свеукупној реакционој једначини:
- X + Y → Z
Пошто је катализатор регенерисан у реакцији, често су само мале количине неопходне да би се повећала брзина реакције. У пракси, међутим, понекад долази до конзумирања катализатора у секундарним процесима.
Катализатор се обично не јавља у једначини брзине. На пример, ако је корак који одређује брзину у горњој реакционој шеми први корак, X + C → XC, катализовна реакција ће бити другог реда са једначином брзине v = kcat[X][C], која је пропорционална концентрацији катализатора [C]. Међутим [C] остаје константан током реакције тако да је катализована реакција псеудо-првог реда: v = kobs[X], где је kobs = kcat[C].
Као један пример детаљног механизма на микроскопском нивоу, 2008. године су дански истраживачи први открили секвенцу догађаја кад се кисеоник и водоник комбинују на површини титанијум диоксида (TiO2, или титанија) да произведу воду. Помоћу серије успорених снимака сканирајућом тунелном микроскопијом, они су одредили да молекули подлежу адсорпцији, дисоцијацији и дифузији пре него што реагују. Интермедијарна реакциона стања су: HO2, H2O2, затим H3O2 и коначни реакциони продукт (димери молекула воде), након чега се молекул воде десорбује из површине катализатора.[12][13]
Реакциона енергетика
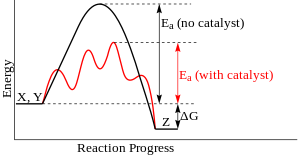
Катализатори делују тако што пружају (алтернативни) механизам у коме се јавља различито прелазно стање и нижа енергија активације. Консеквентно, већи број молекулских колизија има неопходну енергију да досегне до прелазног стања. Катализатори могу да омогуће одвијање реакција које би иначе биле блокиране или успорене кинетичком баријером. Катализотор може да повећа брзину реакције или селективност, или да омогући одвијање реакције на нижим температура. Тај ефекат се може илустровати дијаграмом енергетског профила.
У катализованој елементарној реакцији, катализатори не мењају свеукопни принос реакције: они не утичу на хемијску равнотежу реакције, пошто у једнакој мери утичу на брзине директне и повратне реакције (погледајте исто тако термодинамику). Други закон термодинамике описује зашто катализатор не мења хемијску равнотежу реакције. Претпоставимо да постоји такав катализатор који помера равнотежу. Увођење катализатора у систем би доволо до померања реакције до нове реавнотеже, чиме се производи енергија. Продукција енергије је неопходна пошто су реакције спонтане ако и само ако се ослобађа Гибсова слободна енергија, а ако нема енергетске баријере, нема ни потребе за катализатором. Даље, уклањање катализатора такође може да доведе до реакције, производећи енергију; тј. адиција и њен реверзни процес, би обе производиле енергију. Стога, катализатор који мења равнотежу би био машина перпетуалног кретања, контрадикција законима термодинамике.[14]
Ако катализатор мења равнотежу, онда се он мора конзумирати са током реакције, и стога је исто тако реактант. Илустрација тога је базом катализована хидролизаестара, у којој произведена карбоксилна киселина одмах реагује са катализатором и стога се реакциона равнотежа помера ка хидролизи.
СИ изведена јединица за мерење каталитичке активности катализатора је катал, тј. мол по секунди. Продуктивност катализатора се може описати бројем преокрета (TON - енгл. turn over number),[15] а каталитичка активност фреквенцијом преокрета (TOF - енгл. turn over frequency), која је TON по јединици времена. Биохемијски еквивалент је ензимска јединица.[16]
Катализатор стабилизује прелазно стање у већој мери него што ставилизује почетни материјал. Он снижава кинетичку баријеру снижавањем разлике енергије измежу почетног материјала и прелазног стања. Он не мења енергетску разлику између почетног материјала и продуката (термодонамичку баријеру), или доступну енергију (она долази из окружења у облику топлоте или светлости).
Види још
Референце
- ^ а б в „Catalyst”. IUPAC Compendium of Chemical Terminology. Oxford: Blackwell Scientific Publications. 2009. ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.C00876.
- ^ Masel, Richard I.: Chemical Kinetics and Catalysis. Wiley-Interscience, New York. 2001. ISBN 0-471-24197-0.
- ^ House, James E. (13. 9. 2007). Principles of Chemical Kinetics, Second Edition (2. изд.). Academic Press. ISBN 978-0-12-356787-1.
- ^ Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (20. 8. 1998). Chemical Kinetics and Dynamics (2. изд.). Prentice Hall. ISBN 978-0-13-737123-5.
- ^ Masel, Richard I. “Chemical Kinetics and Catalysis” Wiley-Interscience. . New York. 2001. ISBN 978-0-471-24197-3.
- ^ 7 things you may not know about catalysis Louise Lerner, Argonne National Laboratory (2011)
- ^ „Market Report: Global Catalyst Market” (2nd изд.). Acmite Market Intelligence.
- ^ „The 12 Principles of Green Chemistry”. United States Environmental Protection Agency. Приступљено 2012-04-30.
- ^ „Genie in a Bottle”. University of Minnesota. 2005-03-02.
- ^ Richard I. Masel “Chemical Kinetics and Catalysis” Wiley-Interscience, New York. 2001. ISBN 0-471-24197-0..
- ^ Dybkaer, R. (2001). „UNIT "KATAL" FOR CATALYTIC ACTIVITY (IUPAC Technical Report)”. Pure Appl. Chem. 73 (6): 929. doi:10.1351/pac200173060927.
- ^ Jacoby, Mitch (16. 2. 2009). „Making Water Step by Step”. Chemical & Engineering News. стр. 10.
- ^ Matthiesen J, Wendt S, Hansen JØ, Madsen GK, Lira E, Galliker P, Vestergaard EK, Schaub R, Laegsgaard E, Hammer B, Besenbacher F (2009). „Observation of All the Intermediate Steps of a Chemical Reaction on an Oxide Surface by Scanning Tunneling Microscopy”. ACS Nano. 3 (3): 517—526. ISSN 1520-605X. PMID 19309169. doi:10.1021/nn8008245.
- ^ A.J.B. Robertson Catalysis of Gas Reactions by Metals. Logos Press, London, 1970.
- ^ Hagen, J. (2006). Industrial Catalysis: A Practical Approach. Weinheim, Germany: Wiley-VCH.
- ^ . Nomenclature Committee of the International Union of Biochemistry (NC-IUB). „Units of Enzyme Activity”. Eur. J. Biochem. 97 (2): 319—20. 1979. doi:10.1111/j.1432-1033.1979.tb13116.x.
Литература
- House, James E. (13. 9. 2007). Principles of Chemical Kinetics, Second Edition (2. изд.). Academic Press. ISBN 978-0-12-356787-1.
- Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (20. 8. 1998). Chemical Kinetics and Dynamics (2. изд.). Prentice Hall. ISBN 978-0-13-737123-5.
- B. Cornils, Wolfgang A. Herrmann, M. Muhler, C. Wong: Catalysis from A to Z: A Concise Encyclopedia. Verlag Wiley-VCH. 2007. ISBN 978-3-527-31438-6..
- J. Hagen: Technische Katalyse. Eine Einführung. Wiley-VCH. 1996. ISBN 978-3-527-28723-9..
- Manfred Baerns: Basic Principles in Applied Catalysis. Springer, Berlin . 2004. ISBN 3-540-40261-6..
- A. Behr (2008). Angewandte homogene Katalyse. Wiley-VCH Verlag. ISBN 978-3-527-31666-3..
- D. Steinborn: Grundlagen der metallorganischen Komplexkatalyse. Vieweg+Teubner. 2007. ISBN 978-3-8351-0088-6..
- P. Kripylo, K.-P. Wendlandt, F. Vogt: Heterogene Katalyse in der chemischen Technik. Deutscher Verlag für Grundstoffindustrie, Leipzig . 1993. ISBN 3-342-00666-8..
- Gabor A. Somorjai (1994). Introduction to Surface Chemistry and Catalysis. New York: Wiley. ISBN 0-471-03192-5.
- Gerhard Ertl, Helmut Knözinger, Ferdi Schüth, Jens Weitkamp: Handbook of Heterogeneous Catalysis. Wiley-VCH, Weinheim . 2008. ISBN 978-3-527-31241-2..
- Gerhard Ertl: Reaktionen an Oberflächen: vom Atomaren zum Komplexen (Nobel-Vortrag). (englisch) (PDF-Datei; 666 kB)
- G. E. Jeromin, M. Bertau: Bioorganikum: Praktikum der Biokatalyse. Wiley-VCH. 2005. ISBN 3-527-31245-5..
Спољашње везе
- Science Aid: Catalysts Архивирано на сајту Wayback Machine (30. мај 2008) Page for high school level science
- W.A. Herrmann Technische Universität presentation Архивирано на сајту Wayback Machine (28. октобар 2005)
- Alumite Catalyst, Kameyama-Sakurai Laboratory, Japan
- Inorganic Chemistry and Catalysis Group, Utrecht University, The Netherlands
- Centre for Surface Chemistry and Catalysis Архивирано на сајту Wayback Machine (5. октобар 2008)
- Carbons & Catalysts Group, University of Concepcion, Chile
- Center for Enabling New Technologies Through Catalysis, An NSF Center for Chemical Innovation, USA
- "Bubbles turn on chemical catalysts" Архивирано на сајту Wayback Machine (22. јул 2012), Science News magazine online, April 6, 2009.

















![{\displaystyle {\ce {A + B + K -> [ABK]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/119a10089886b9efc9fa62768ddcdae01adc813b)
![{\displaystyle {\ce {[ABK] -> AB + K}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b972f990f1c7d3fe9c984ec9a1c3a61419a28212)

