Potency and safety analysis of hemp-derived delta-9 products: The hemp vs. cannabis demarcation problem
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | HU-210 | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C25H38O3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 386.567 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
HU-210 ist ein synthetisches Cannabinoid. Das Kürzel HU steht für Hebrew University, wo die Verbindung von der Arbeitsgruppe von Raphael Mechoulam synthetisiert wurde. HU-210 ist 100 bis 800 mal wirksamer als das natürliche Tetrahydrocannabinol aus der Hanfpflanze und besitzt eine längere Wirkungsdauer.[2] HU-210 ist das (–)-1,1-Dimethylheptyl-Analogon des 11-Hydroxy-Δ8-tetrahydrocannabinol und wird auch 1,1-Dimethylheptyl-11-hydroxytetrahydrocannabinol genannt.
Chemie
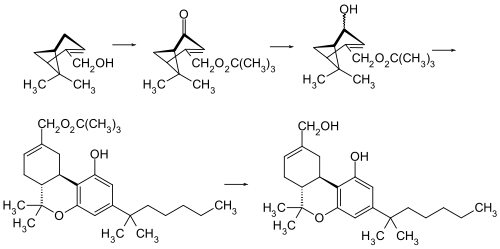
HU-210 ist das Enantiomer von HU-211 (Dexanabinol), welches jedoch keine cannabinoide Wirkung zeigt. Die ursprüngliche Synthese von HU-210 basiert auf einer säure-katalysierten Kondensation von (–)-Myrtenol und 1,1-Dimethylheptylresorcinol (3,5-Dihydroxy-1-(1,1-dimethylheptyl)benzol).[3]
Pharmakologie
HU-210 aktiviert sowohl den Cannabinoid-Rezeptor CB1, wie auch CB2, es hat höhere Affinität zum CB1-Rezeptor. Im Gegensatz zu Δ9-Tetrahydrocannabinol, dem Hauptwirkstoff des Cannabis, ist HU-210 jedoch ein voller Agonist.[4]
Verwendung
HU-210 wird zur Erforschung der Rolle des Cannabinoidsystems verwendet.[5] Nach Angaben der United States Customs and Border Protection wurde HU-210 in Spice Gold nachgewiesen, das 2009 an der US-Grenze beschlagnahmt wurde.[6] 2009 wurde HU-210 in drei weiteren Spice-Produkten in England nachgewiesen.[7]
Literatur
- Razdan, K.: The Total Synthesis of Natural Products. Hrsg.: John Apsimon. Wiley Interscience, 1981, ISBN 978-0-471-05460-3, The Total Synthesis of Cannabinoids, S. 245.
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Little PJ, Compton DR, Mechoulam R, Martin BR: Stereochemical effects of 11-OH-delta 8-THC-dimethylheptyl in mice and dogs. In: Pharmacol Biochem Behav. 32. Jahrgang, Nr. 3, März 1989, S. 661–6, PMID 2544901.
- ↑ R. Mechoulam, N. Lander, A. Breuer, J. Zahalka: In Synthesis of the Individual, Pharmacologically Distinct, Enantiomers of a Tetrahydrocannabinol Derivative. Tetrahedron: Asymmetry 1990, 5, 315–318.
- ↑ Felder CC, Joyce KE, Briley EM, et al.: Comparison of the pharmacology and signal transduction of the human cannabinoid CB1 and CB2 receptors. In: Mol Pharmacol. 48. Jahrgang, Nr. 3, September 1995, S. 443–50, PMID 7565624.
- ↑ Ottani A, Giuliani D: Hu 210: a potent tool for investigations of the cannabinoid system. In: CNS Drug Rev. 7. Jahrgang, Nr. 2, 2001, S. 131–45, PMID 11474421.
- ↑ Lab Results Confirm CBP in Ohio Discover Synthetic Narcotics in Incense Packets. CBP, archiviert vom am 26. Februar 2013; abgerufen am 2. Januar 2011.
- ↑ EMCDDA Action on new drugs briefing paper: Understanding the ‘Spice’ phenomenon. (PDF; 563 kB) Abgerufen am 2. Januar 2011.
















