Potency and safety analysis of hemp-derived delta-9 products: The hemp vs. cannabis demarcation problem
Contingut
 | |
| Dades clíniques | |
|---|---|
| Grup farmacològic | aromatic polyketide (en) |
| Dades químiques i físiques | |
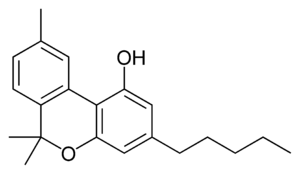
| Fórmula | C21H26O2 |
| Massa molecular | 310,193 Da |
| Identificadors | |
| Número CAS | 521-35-7 |
| PubChem (SID) | 2543 |
| IUPHAR/BPS | 740 |
| DrugBank | DB14737 |
| ChemSpider | 2447 |
| UNII | 7UYP6MC9GH |
| KEGG | C07580 |
| ChEBI | 3360 |
| ChEMBL | CHEMBL74415 |
| AEPQ | 100.216.772 |
El cannabinol (CBN) és un cannabinoide lleugerament psicoactiu (per exemple, CBD) que actua com a agonista parcial de baixa afinitat tant als receptors CB1 com als CB2. Aquesta activitat als receptors CB1 i CB2 constitueix la interacció del CBN amb el sistema endocannabinoide (ECS).
El 1896 el cannabinol va ser descobert per primera vegada al cànnabis per Thomas Barlow Wood, WT Newton Spivey i Thomas Easterfield.[1] A principis de la dècada de 1930, l'estructura dels CBN va ser identificada per Robert Sidney Cahn,[2][3] marcant el primer desenvolupament d'un extracte de cànnabis. La seva estructura i síntesi química es van aconseguir el 1940, seguit d'alguns dels primers estudis de recerca bàsica per determinar els efectes dels compostos individuals derivats del cànnabis in vivo. Tot i que el CBN comparteix el mateix mecanisme d'acció que altres fitocannabinoides (per exemple, Delta-9-tetrahidrocannabinol, Δ9-THC), té una menor afinitat pels receptors CB1, el que significa que es necessiten dosis molt més altes de CBN per experimentar efectes, com una sedació lleu.
Estructura química
Els agonistes dels receptors cannabinoides es classifiquen en quatre grups segons l'estructura química. El CBN, com un dels molts fitocannabinoides derivats de Cannabis Sativa L, es considera un cannabinoide clàssic. Altres exemples de compostos d'aquest grup inclouen derivats de dibenzopiran com el Δ9-THC, coneguts per subjacent al "alt" subjectiu que experimenten els usuaris de cànnabis, així com el Δ8-THC, i els seus anàlegs sintètics. En canvi, els cannabinoides produïts de manera endògena (és a dir, endocannabinoides), que també exerceixen efectes a través de l'agonisme CB, es consideren eicosanoides, que es distingeixen per notables diferències en l'estructura química.
En comparació amb Δ9-THC, un anell aromàtic addicional confereix al CBN un perfil metabòlic més lent i limitat (vegeu Cannabinol § Notes). A diferència del THC, el CBN no té isòmers de doble enllaç ni estereoisòmers. El CBN es pot degradar a HU-345 per oxidació. En el cas de l'administració oral de CBN, el metabolisme de primer pas al fetge implica l'addició d'un grup hidroxil a C9 o C11, augmentant l'afinitat i l'especificitat del CBN per als receptors CB1 i CB2 (vegeu 11-OH-CBN).


Síntesi i metabolisme
Aquest diagrama representa les vies biosintètiques i metabòliques per les quals es creen els fitocannabinoides (per exemple, CBD, THC, CBN) a la planta de cànnabis. Començant amb CBG-A, les formes àcides de certs fitocannabinoides es generen mitjançant la conversió enzimàtica. A partir d'aquí, la descarboxilació (és a dir, catalitzada per la combustió o la calor) produeix els metabòlits més coneguts presents a la planta de cànnabis. El CBN és únic perquè no sorgeix d'una forma àcida preexistent, sinó que es genera mitjançant l'oxidació del THC.
El CBN és únic entre els fitocannabinoides, ja que la seva via biosintètica implica la conversió directament de Δ9-THC, en lloc d'una forma àcida precursora de CBN (per exemple, Δ9-THC sorgeix mitjançant la descarboxilació de THC-A). El CBN es pot trobar en petites quantitats a la planta de cànnabis, que es troba principalment en el cànnabis envellit i emmagatzemat, cosa que permet la formació de CBN mitjançant l'oxidació del principal químic psicoactiu i embriagador de la planta de cànnabis, el tetrahidrocannabinol (THC). Aquest procés d'oxidació es produeix mitjançant l'exposició a la calor, l'oxigen i/o la llum. Tot i que els informes són limitats, el CBN-A també s'ha mesurat a nivells molt baixos a la planta de cànnabis, que es creu que es va formar mitjançant la hidrolització de THC-A (vegeu el diagrama de biosíntesi de fitocannabinoides, a continuació).
Quan s'administra per via oral, el CBN demostra un metabolisme similar al Δ9-THC, amb el metabòlit actiu primari produït mitjançant la hidrolització de C9 com a part del metabolisme de primer pas al fetge. El metabòlit actiu generat mitjançant aquest procés s'anomena 11-OH-CBN, que és 2 vegades més potent que el CBN, i ha demostrat activitat com a antagonista feble de CB2. Aquest metabolisme contrasta clarament amb el del Δ 9 -THC en termes de potència, atès que s'ha informat que l'11-OH-THC té 10 vegades la potència del Δ9-THC.
A causa de l'alta lipofilia i el metabolisme de primer pas, hi ha una baixa biodisponibilitat de CBN i altres cannabinoides després de l'administració oral. El metabolisme del CBN està mediat en part per les isoformes 2C9 i 3A4 del CYP450. El metabolisme del CBN pot ser catalitzat per les UGT (UDP-glucuronosiltransferases), amb un subconjunt d'isoformes UGT (1A7, 1A8, 1A9, 1A10, 2B7) identificades com a substrats potencials associats a la glucuronidació del CBN. La biodisponibilitat del CBN després de l'administració per inhalació (per exemple, fumar o vaporitzar) és d'aproximadament un 40% de la de l'administració intravenosa.
Interaccions dels neurotransmissors
Al cervell, el mecanisme canònic d'activació del receptor CB1 és una forma de plasticitat sinàptica a curt termini iniciada mitjançant senyalització retrògrada d'agonistes endògens de CB1 com 2AG o AEA (dos endocannabinoides primaris). Aquest mecanisme d'acció s'anomena supressió de la inhibició induïda per despolarització (DSI) o supressió de l'excitació induïda per despolarització (DSE),[4] depenent de la classificació de la neurona presinàptica sobre la qual actua el missatger retrògrad (vegeu el diagrama a l'esquerra ). En el cas de l'agonisme CB1R a la membrana presinàptica d'una interneurona GABAèrgica, l'activació condueix a un efecte net d'augment de l'activitat, mentre que la mateixa activitat en una neurona glutamatèrgica condueix a l'efecte net contrari. L'alliberament d'altres neurotransmissors també es modula d'aquesta manera, especialment dopamina, dinorfina, oxitocina i vasopressina.[4]
Referències
- ↑ Wood, Thomas Barlow; Spivey, W. T. Newton; Easterfield, Thomas Hill J. Chem. Soc., Trans, 75, 1899, pàg. 20–36. DOI: 10.1039/CT8997500020.
- ↑ Cahn, Robert Sidney Journal of the Chemical Society (Resumed), 1932, pàg. 1342–1353. DOI: 10.1039/JR9320001342.
- ↑ Pertwee, Roger G. British Journal of Pharmacology, 147, 2006. DOI: 10.1038/sj.bjp.0706406. PMC: 1760722. PMID: 16402100.
- ↑ 4,0 4,1 British Journal of Pharmacology, 142, 1, 5-2004, pàg. 9–19. DOI: 10.1038/sj.bjp.0705726. PMC: 1574919. PMID: 15100161.

















