Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
Penicilini so skupina antibiotikov, ki so naravni produkti nekaterih gliv (iz rodu čopičastih plesni (Penicillium)) ali pa so polsintetičnega izvora. Delujejo predvsem na grampozitivne bakterije. Protibakterijski učinek je posledica zaviranja prečnega povezovanja peptidoglikanov v celičnih stenah rastočih bakterij.[1][2]. Gre za prve učinkovine, za katere so ugotovili učinkovitost proti večini prej življenjsko ogrožajočih bakterijskih bolezni (sifilis, stafilokokne okužbe ...). Tudi v sedanjosti so pogosto uporabljene učinkovine, vendar pa so se pojavile številne bakterije, ki so razvile odpornost proti penicilinom. Penicilini spadajo med betalaktamske antibiotike.
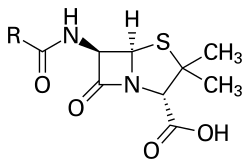
Molekulska formula penicilinov je R-C9H11N2O4S, kjer je R spremenljiva stranska veriga.
Penicilini imajo običajno molsko maso med 313[3] in 334[4][5] g/mol (slednja vrednost velja za penicilin G). Pri penicilinskih antibiotikih z večjo stransko verigo pa je lahko molekulska masa tudi okrog 500. Na primer, kloksacilin ima molsko maso 476 g/mol in dikloksacilin 492 g/mol.[6]

Pri biosintezi penicilina G (benzilpenicilina) so tri poglavitne stopnje:
1. V prvi stopnji pride do kondenzacije treh aminokislin L-α-aminoadipinske kisline, L-cisteina in L-valina, pri čemer nastane tripeptid.[7][8][9] Pred nastankom tripeptida se L-valin pretvori v D-valin.[10][11] Nastali tripeptid se imenuje δ-(L-α-aminoadipil)-L-cistein-D-valin, okrajšano kot ACV. Za reakcijo je potrebna prisotnost encima ACVS (δ-(L-α-aminoadipil)-L-cistein-D-valin sintetaza), ki omogoči aktivacijo aminokislin in epimerizacijo L-valina v D-izoobliko.
2. V naslednji stopnji poteče reakcija, s katero se ACV pretvori v izopenicilin N, pri tem pa sodeluje encim izopenicilin N sintetaza. Tripeptid se oksidira in pride do tvorbe obročnega sistema.[12][8] Izopenicilin N ne izkazuje antibiotičnega učinka.[10]
3. V zadnjem koraku pride do zamenjave stranske verige in iz izopenicilina N naposled nastrane penicilin G. Koencim izopenicilin N aciltransferaza katalizira odstranitev α-aminoadipilne stranske verige iz molekule izopenicilina N; na to mesto se pripne fenilacetilna skupina. Omenjeni encim je zapisan na genu penDE.[7]

Penicilin je odkril leta 1928 škotski znanstvenik in dobitnik Nobelove nagrade Alexander Fleming.[13] Dokazal je, da gliva Penicillium notatum v ustreznem gojišču proizvaja protibakterijsko snov, ki jo je poimenoval penicilin. Šlo je za slučajno odkritje, ki pa je bilo povod za moderno dobo odkritij antibiotikov. Za razvoj penicilina za uporabo pri ljudeh so zaslužni avstralski Nobelov nagrajenec Howard Walter Florey, nemški Nobelov nagrajenec Ernst Chain in angleški biokemik Norman Heatley.
Že pred Flemingovim odkritjem so drugi poročali o bakteriostatičnem učinku čopičaste plesni. Že od srednjega veka so v Evropi v tradicionalni medicini uporabljali kruh z modro plesnijo (domnevno čopičasta plesen) za zdravljenje zagnojenih ran. Prvi objavljen vir se je leta 1875 pojavil v reviji Philosophical Transactions of the Royal Society angleške Kraljeve družbe, avtorja Johna Tyndalla.[14] Ernest Duchesne je o tem pisal leta 1897, vendar Pasteurjev inštitut zaradi njegove mladosti članka ni sprejel. Marca 2000 so doktorji bolnišnice v kostariškem San Josu objavili dva rokopisa kostariškega zdravnika in znanstvenika Clodomira Picada Twighta (1887–1944). Poročali so o njegovih opazovanjih zaviralnega učinka gliv iz rodu čopičastih plesni med letoma 1915 in 1927. Svoje odkritje je sporočil tudi pariški akademiji znanosti, vendar ga ni patentiral. Njegove raziskave so se začele več let pred Flemingovim odkritjem.
Fleming je kasneje preračunal, da naj bi do odkritja prišel petkovega jutra 28. septembra 1928.[15] Šlo je za srečno naključje, ko je v laboratoriju v londonski bolnišnici St. Mary's Hospital v petrijevki gojil stafilokoke. Ker je petrijevko pustil po nesreči odprto, se je gojišče okužilo tudi s plesnijo iz rodu čopičastih plesni in ta je tvorila s prostim očesom vidno kolonijo. Okoli plesni se je pojavil kolobar zaradi zaviraja rasti stafilokokov. Fleming je predpostavil, da plesen izloča snov, ki zavira rast bakterij in povzroča njihovo lizo. Plesen je nacepil na drugo gojišče in iz čiste kulture je ugotovil, da gre za čopičasto plesen. Danes to vrsto plesni poznamo pod imenom Penicillium notatum. Fleming je vzorec poslal Charlesu Thomu, v tistih časih priznanemu ameriškemu strokovnjaku. Fleming je tudi skoval izraz penicilin, s čimer je poimenoval filtrat, pridobljen iz čopičaste plesni. Že kmalu so ugotovili, da je penicilin učinkovit zoper grampozitivne bakterije, a neučinkovit proti gramnegativnim bakterijam in glivicam. Fleming je predpostavljal, da se lahko penicilin uporablja kot učinkovito razkužilo, ki je zelo učinkovito in v primerjavi z drugimi antiseptiki tistega časa minimalno toksično. Zapisal je tudi njegovo laboratorijsko uporabnost pri osamitvi bakterije Bacillus influenzae (danes poimenovana Haemophilus influenzae).[16] Po nadaljnjih raziskavah je bil prepričan, da je penicilin premalo obstojen v človeškem organizmu, da bi lahko bil učinkovit proti patogenim bakterijam. Leta 1931 je prekinil raziskovanje. S kliničnimi raziskavami je nadaljeval leta 1934 ter do leta 1940 iskal nekoga, ki bi znal penicilin ustrezno prečistiti.[17]
Leta 1930 je Cecil George Paine, patolog v bolnišnici v Sheffildu, poskusil uporabiti penicilin pri zdravljenju stafilokokne okužbe lasnih mešičkov na bradi (sycosis barbae), vendar neuspešno. Vzrok neučinkovitega zdravljenja je bil verjetno ta, da penicilin ne prodre dovolj globoko v kožo. Prvo uspešno zdravljenje je dosegel pri oftalmiji novorojenčkov (gonokokna okužba veznice pri novorojenčkih) novembra 1930. Nato je s penicilinom pozdravil še 4 bolnike (1 odraslega in 3 dojenčke) z okužbami oči; pri petem pa zdravljenje ni bilo učinkovito.[18]
Leta 1939 je avstralski znanstvenik Howard Florey z ekipo razikovalcev (Ernst Boris Chain, A. D. Gardner, Norman Heatley, M. Jennings, J. Orr-Ewing in G. Sanders) na oksfordski univerzi dosegel znaten napredek pri dokazovanju baktericidnega učinka penicilina in vivo. Sicer so bili poskusi zdravljenja bolnikov zaradi premajhnih količin penicilina neuspešni, vendar so dokazali neškodljivost in učinkovitost pri miših.[19]
Nekatere od prvih raziskav penicilina so potekale v oksfordski bolnišnici Radcliffe Infirmary; nekateri viri navajajo te raziskave kot prve, ki so ugotavljale uspešnost zdravljenja s penicilinom, vendar so Painove raziskave potekale prej.[18] 14. marca 1942 sta John Bumstead in Orvan Hess rešila življenje umirajočemi bolniku, tako da sta mu dala penicilin.[20][21]
Kemijsko zgradbo penicilina je v začetku 40-ih let določila Dorothy Hodgkin. Penicilin je postal najbolj pogosto uporabljan antibiotik in še danes se uporablja za številne okužbe z grampozitivnimi bakterijami. Delovna skupina oksfordskih raziskovalcev, na čelu z Avstralcem Howardom Floreyjem (sodelovala sta tudi Ernst Boris Chain in Norman Heatley), je razvila postopek za množično proizvodnjo zdravila. Florey in Chain sta za svoje delo leta 1945 prejela Nobelovo nagrado za medicino (skupaj s Flemingom). Po drugi svetovni vojni je Avstralija postala prva država, ki je dala penicilin tudi na razpolago civilnem prebivalstvu. Kemik John C. Sheehan je na Tehnološkem inštitutu v Massachusettsu v zgodnjih 50-ih prvi razvil celoten sintezni postopek za pridobivanje penicilina G in nekaterih njegovih analogov, ampak postopek ni bil dovolj učinkovit za množično proizvodnjo.
14. marca 1942 je prvi bolnik (imel je streptokokno septikemijo) prejel penicilin ameriškega podjetja Merck & Co.[22] Polovica celotne količine proizvedenega penicilina v tistem času je bila porabljena za tega bolnika. Junija 1942 je količina pridobljenega penicilina zadoščala že za 10 bolnikov.[23] Leta 1943 so v svetovni raziskavi ugotovili, da plesniva melona iz Illinoisa vsebuje najboljši in najkakovostnejši penicilin.[24] To odkritje in rezultati raziskav fermentacije koruzne omakalne vodice (angl. corn steep liquor) prav tako v Illinoisu so omogočili, da so v ZDA spomladi 1944, v času napada na Normandijo, lahko proizvedli 2,3 milijona odmerkov penicilina. Zares množično proizvodnjo je omogočila kemičarka Margaret Hutchinson Rousseau, ki je razvila fermentacijo v globokih rezervoarjih.[25]

G. Raymond Rettew je s tehnologijo proizvodnje komercialnih količin penicilina prispeval znaten delež k ameriškim vojaškim trudom tistega časa.[26] Med drugo svetovno vojno je penicilin pomembno vplival na število smrti in amputacij zaradi okuženih ran med vojaki zavezniških držav. Zaradi težav pri proizvodnji velikih količin in potrebi po pogostem odmerjanju penicilina, ker se hitro izloča iz telesa, je bila razpoložljivost zdravila zelo omejena. Penicilin se iz telesa aktivno izloča in okoli 80 % odmerka se izloči že po 3 do 4 urah po aplikaciji. Na začetku uporabe penicilina so zaradi nezadostnih količin, ki so bile na voljo, celo zbirali seč bolnikov, ki so prejemali penicilin, ter ga iz njega izolirali in ponovno uporabili.[27]
Ker na obzorju še vedno ni bilo zadovoljive rešitve, so znanstveniki pričeli z iskanjem načina, da bi upočasnili izločanje penicilina iz telesa. Iskali so molekulo, ki bi se vezala na prenašalno beljakovino, ki je odgovorna za aktivno izločanje penicilina v seč, in bi zasedla te prenašalne beljakovine in s tem preprečila, da bi se sam penicilin izločal tako hitro. Kot primerna se je izkazala urikozurična učinkovina probenecid. Pri sočasni uporabi probenecida in penicilina je prvi kompetitivno zavrl izločanje penicilina in koncentracija penicilina v krvi ter čas njegovega delovanja sta se podaljšala. Uporaba probenecida je upadla, ko so razvili zmogljivejše tehnike za množično proizvodnjo penicilina ter odkrili polsintetske penicilinske učinkovine.[27] Vendar je probenecid še vedno uporabljan, in sicer pri določenih okužbah, ki zahtevajo posebej visoke krvne koncentracije penicilina.[28]
Ker je bil obseg okužb, ki jih je bilo možno zdraviti s prvotnimi naravnimi penicilini (zlasti penicilinom G), in zaradi sorazmerno slabega delovanja peroralno učinkovitega fenoksimetilpenicilina (penicilina V) so raziskovalci iskali derivate penicilina, ki bi delovali na širši spekter okužb. Izolacija 6-aminopenicilanske kisline (6-APA), ki predstalja osrednjo strukturo penicilinov, je omogočila razvoj polsinteznih penicilinov, ki so izkazovali boljše lastnosti kot naravni penicilin G (benzilpenicilin); tako so izboljšali biorazpoložljivost, spekter delovanja, obstojnost in prenašanje penicilinov.
Prvi večji dosežek je pomenila sinteza ampicilina, ki ima širši spekter delovanja od naravnih penicilinov (penicilina G in V). Z nadaljnjjimi raziskavami so odkrili peniciline, odporne na betalaktamazo (flukloksacilin, dikloksacilin, meticilin). To je bilo bistvenega pomena za zdravljenje okužb z bakterijami, ki proizvajajo betalaktamazo, niso pa učinkoviti proti na meticilin odpornemu S. aureusu, ki se je kasneje pojavil.
Naslednji dosežek je bil razvoj penicilinskih antibiotikov, učinkovitih proti psevdomonasu (karbenicilin, tikarcilin, piperacilin). Z njimi so spekter delovanja razširili tudi na gramnegativne bakterije.
Betalaktamsko strukturo so ohranili tudi pri novejših antibiotikih: mecilinamih, karbapenemih in cefalosporinih.[29]
Betalaktamski antibiotiki zavrejo prečno povezovanje peptidoglikana v bakterijski celični steni. Del molekule penicilina se veže v aktivno mesto encima DD-transpeptidaza, ki katalizira tvorbo prečnih povezav med peptidoglikanskimi molekulami. Posledično postane celična stena prepustna in zaradi osmotskega tlaka bakterijska celica umre. Nadalje pa se zaradi kopičenja predhodniških molekul peptidoglikana aktivirajo hidrolaze in avtolizini v celični steni, ki povzročijo propad peptidoglikana.
Po delovanju penicilinskega antibiotika ostane grampozitivna bakterija povsem brez celične stene – tako celico imenujemo protoplast. Pri gramnegativnih bakterijah propade celična stena le delno – nastane t. i. sferoplast.
Sočasna uporaba penicilinskih in aminoglikozidnih antibiotikov izkazuje sinergistični učinek. Penicilinski antibiotik namreč zavre tvorbo peptidoglikana in tako lahko aminoglikozid lažje prodre skozi celično steno v celico, kjer deluje tako, da zavre sintezo bakterijskih beljakovin.
Izraz penicilin se pogosto nanaša na katerokoli penicilinsko učinkovino z ozkim spektrom delovanja, zlasti na benzilpenicilin (penicilin G).
Druge različice ozkospektralnih penicilinskih spojin so:
Pogosti neželeni učinki, ki se pojavijo pri več kot 1 % bolnikov, zdravljenih s penicilinskimi antibiotiki, so driska, preobčutljivost, siljenje na bruhanje, izpuščaj, nevrotoksičnost, koprivnica, naknadna okužba (superinfekcija) – vključno s kandidozo. Občasni neželeni učinki (pri 0,1–1 % bolnikov) so vročina, bruhanje, eritem (rdečina), dermatitis, angioedem, krči (zlasti pri bolnikih z božjastjo) in psevdomembranski kolitis.[28]
Pri parenteralni uporabi (v žilo) se pogosto na mestu injiciranja pojavita tudi bolečina in vnetje (zlasti pri benzilpenicilinu in benzatinbenzilpenicilinu, v manjšem obsegu pri prokainpenicilinu).
Čeprav še vedno poročajo o preobčutljivostni reakciji na peniciline kot o najpogostejši alergijski reakciji, ima le 20 % ljudi, ki verjamejo, da so preobčutljivi na peniciline, zares alergijo nanje.[31] Še vedno pa so penicilini najpogostejše zdravilo, ki povzroči hude alergijske reakcije.
Alergijska reakcija na kateri koli betalaktamski antibiotik se pojavi pri 10 % bolnikov, ki prejmejo to zdravilo.[32] Gre za preobčutljivostno reakcijo tipa I. Anafilaksija (huda preobčutljivostna reakcija, ki lahko ogrozi življenje) se pojavi pri 0,01 % bolnikov.[28] V preteklosti je veljalo, da je navzkrižna občutljivost na penicilinske derivate, cefalosporine in karbapeneme 10-odstotna; razlog je v tem, da vse te učinkovine vsebujejo betalaktamski obroč.[33][34] Novejša dognanja so pokazala, da pri cefalosporinih druge generacije in pri novejših cefalosporinih tveganje za navzkrižno občutljivost ni povečano.[35][36] Za navzkrižno občutljivost pri cefalosporinih prve generacije in penicilinih naj bi bila odgovorna podobna struktura stranskih verig in ne betalaktamski obroč.[37]
Penicilin je sekundarni presnovek čopičastih plesni, ki se tvori, če je rast glive zavrta zaradi stresnih dejavnikov. Med aktivno rastjo se ne tvori. Proizvodnja je omejena tudi z negativno povratno zanko v sintezni poti penicilina:
Stranski produkt L-lizin namreč zavre tvorbo homocitrata, zato se je pri proizvodnji treba tudi izogibati prisotnosti eksogenega lizina.
Celice čopičaste plesni gojijo s pomočjo tehnike, imenovane dohranjevalna šarža (angl. fed-batch), pri čemer so celice neprestano podvržene stresu in zato proizvajajo velike količine penicilina. Pomembni so tudi ogljikovi viri: glukoza zavira tvorbo penicilina, laktoza pa na primer ne. Samodejno morajo biti nadzorovani tudi pH, raven dušika, lizina, fosfata in kisika v šaržah.
Proizvodnja penicilina se je začela kot neposreden rezultat druge svetovne vojne. Proizvajali so ga v ogromnih količinah in industrija je cvetela. Leta 1945 so proizvedli že 425 milijonov odmerkov letno.[38]
V zadnjem času je razvoj biotehnologije omogočil, da so s pomočjo usmerjene evolucije proizvedli številne mutirane seve Penicilliuma. Take tehnike usmerjene evolucije so npr. PCR, podvržena napakam (angl. error-prone PCR), premeščanje DNK (angl. DNA shuffling), ITCHY in PCR s prekrivanjem verig (angl. strand overlap PCR).
It was a discovery that would change the course of history. The active ingredient in that mold, which Fleming named penicillin, turned out to be an infection-fighting agent of enormous potency. When it was finally recognized for what it was — the most efficacious life-saving drug in the world — penicillin would alter forever the treatment of bacterial infections.