Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
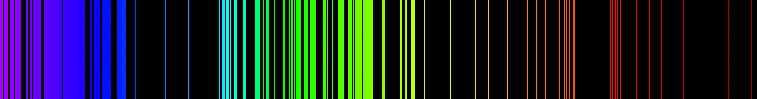
Emisjonsspekteret til eit stoff er den relative intensitet til den elektromagnetiske strålinga frå kvar frekvens emittert av atom eller molekyl i stoffet når dei er anslått.
Når eit stoff vert tilført energi til det gløder, vil det avgje elektromagnetisk stråling som lys. Ein seier at stoffet fluorescerer. Emisjon tyder utsending, men i denne samanhengen utstråling. Noko av strålinga oppfattar ein som varme og noko som lys.
Om ein bryt den delen av spekteret der det synlege lyset er ved hjelp av eit gjennomsiktig prisme av til dømes glas, ser ein at det består av ei rekkje fargar, frå raudt til fiolett, som gradvis går over i kvarandre. Raudt lys har lengst bølgjelengde, og minst energi medan det fiolette lyset har kort bølgjelengde og mykje energi.
Ved å forstørra spekteret frå sollys kom ein for mange tiår tilbake fram til at visse fargar mangla: spekteret hadde svarte linjer. Desse linjene fekk namn etter oppdagaren og vert framleis kalla «fraunhoferske linjer». Desse linjene viste til at nokre strålefrekvensar vart absorbert eller ikkje emittert.
Emisjonsspekteret til eit grunnstoff viser kva slags bølgjelengder grunnstoffet kan senda ut. Kvart grunnstoff har sitt unike emisjonsspekter. Røntgenfluorescens (XRF) er ein analysemetode til å bestemma kjemisk samansetjing til eit samansett stoff. Emisjon tyder utsending, men i denne samanheng: utstråling.
Atom har ein positiv kjerne med proton og nøytron. Rundt kjernen er banar/skal/lobar for elektron i ulike nivå som har plass til forskjellige mengder elektron. Når eitt foton med riktig bølgjelengd treffer stoffet kan fotonet verta absorbert og eitt elektron får meir energi ved å løftast opp i ein annan elektronbane/eit anna elektronskal. Dei mørke linjene svarar til frekvensen som er absorbert.
Når elektronet fell inn i eit lågare, mindre energirikt skal sender det ut eitt foton med bestemt bølgjelengd. Dette dannar striper av lys i emissjonsspekteret.