Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Impala | |
|---|---|
 Un maschio territoriale, nel Botswana settentrionale  Una femmina con il piccolo, nel parco nazionale Kruger, Sudafrica | |
| Stato di conservazione | |
Rischio minimo[1] | |
| Classificazione scientifica | |
| Dominio | Eukaryota |
| Regno | Animalia |
| Phylum | Chordata |
| Classe | Mammalia |
| Ordine | Artiodactyla |
| Famiglia | Bovidae |
| Sottofamiglia | Aepycerotinae Gray, 1872 |
| Genere | Aepyceros Sundevall, 1847 |
| Specie | A. melampus |
| Nomenclatura binomiale | |
| Aepyceros melampus (Lichtenstein, 1812) | |
| Areale | |
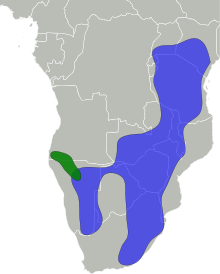 Impala faccianera (in verde) | |
L'impala o melampo (Aepyceros melampus Lichtenstein, 1812) è un'antilope di medie dimensioni diffusa in Africa orientale e meridionale. Unica specie del genere Aepyceros, venne descritto ufficialmente per la prima volta dallo zoologo tedesco Martin Lichtenstein nel 1812. Ne vengono riconosciute due sottospecie - l'impala comune e quello dalla faccia nera, più grande e di colore più scuro. L'impala raggiunge 70–92 cm di altezza al garrese e pesa 40–76 kg. Il suo manto lucido è di colore bruno-rossastro. Le corna a forma di lira, presenti unicamente nel maschio, misurano 45–92 cm.
Attivo soprattutto durante il giorno, l'impala può essere gregario o territoriale a seconda del clima e della regione geografica. Possono essere osservati tre tipi distinti di gruppi sociali: maschi territoriali, branchi di scapoli e branchi di femmine. L'impala è noto per i due caratteristici tipi di salto che costituiscono un comportamento anti-predatorio. Sia brucatore che pascolatore, l'impala si nutre di monocotiledoni, dicotiledoni, piante erbacee, frutti e baccelli di acacia (quando disponibili). Verso la fine della stagione delle piogge, generalmente in maggio, l'animale entra in calore per un periodo di tre settimane. I maschi in calore combattono tra loro per il predominio, e il maschio vincitore corteggia le femmine in estro. La gestazione dura sei o sette mesi, trascorsi i quali viene alla luce un unico piccolo, che viene immediatamente nascosto in un luogo sicuro. I piccoli vengono allattati dai quattro ai sei mesi; i giovani maschi - allontanati dai gruppi di sole femmine - si riuniscono in branchi di scapoli, mentre le femmine possono rimanere dove sono nate.
L'impala è diffuso nelle steppe arbustive e talvolta nelle zone di transizione (ecotoni) tra steppe arbustive e savane, in prossimità degli specchi d'acqua. Mentre l'impala dalla faccia nera è confinato all'Angola sud-occidentale e alla regione del Kaokoland (Namibia nord-occidentale), l'impala comune è ampiamente diffuso in tutto il suo areale ed è stato reintrodotto in Gabon e in Africa meridionale. L'Unione internazionale per la conservazione della natura (IUCN) classifica l'impala come «specie a rischio minimo»; l'impala dalla faccia nera, invece, viene classificato come «vulnerabile», dal momento che nel 2008 ne rimanevano in natura meno di 1000 esemplari.
La specie viene citata per la prima volta in letteratura nel 1802 con il nome palla o pallah, dal termine tswana phala, che significa «antilope rossa»[2]; il nome impala, talvolta scritto anche impalla o mpala, viene attestato per la prima volta nel 1875[3]. Talvolta, in lingua inglese, viene anche indicata con il suo nome in lingua afrikaans, rooibok, letteralmente «antilope rossa»[4].
Il nome scientifico del genere, Aepyceros (lett. «dalle corna alte»), deriva dal greco antico αἰπύς (aipus, «alto») + κέρας (keras, «corno»)[5][6]; l'appellativo specifico melampus (lett. «dai piedi neri») deriva da μελάς (melas, «nero») + πούς (pous, «piede»)[7].
L'impala è l'unico membro del genere Aepyceros e appartiene alla famiglia dei Bovidi. Venne descritto per la prima volta dallo zoologo tedesco Martin Lichtenstein nel 1812[8]. Nel 1984 la paleontologa Elisabeth Vrba ipotizzò che l'impala fosse un sister taxon degli Alcelafini, data la sua somiglianza con l'alcelafo[9]. Uno studio filogenetico condotto nel 1999 da Alexandre Hassanin (del Centro nazionale di ricerca scientifica di Parigi) e dai suoi colleghi, basato su analisi del DNA mitocondriale e nucleare, dimostrò che l'impala formava un clade con il suni (Neotragus moschatus). Questo clade è un sister group di quello formato dal cefalofo dorsale (Cephalophus dorsalis) e dal saltarupe (Oreotragus oreotragus)[10]. Nel 2003 anche l'analisi della sequenza nucleare dell'rRNA e della β-spettrina ha confermato lo stretto legame tra Aepyceros e Neotragus[11]. Il cladogramma seguente è basato sullo studio del 1999[10]:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nel corso degli anni sono state descritte fino a sei sottospecie, ma le analisi mitocondriali hanno confermato la validità di solo due di esse[12]. Nonostante siano simili morfologicamente[13], le due sottospecie mostrano una significativa distanza genetica tra loro e non sono mai stati segnalati ibridi[13][14]:
Secondo la Vrba, l'impala si sarebbe evoluto a partire da un progenitore alcelafino. La studiosa notò che mentre questo antenato si sarebbe diversificato almeno 18 volte in varie forme morfologiche differenti, l'impala avrebbe conservato la sua forma base per almeno cinque milioni di anni[9][15]. Sono state scoperte alcune specie fossili attribuibili a questo genere, come A. datoadeni del Pliocene dell'Etiopia[16]. I fossili più antichi scoperti suggeriscono che gli impala preistorici erano leggermente più piccoli della specie attuale, ma per il resto erano del tutto simili a quest'ultima. Ciò significa che l'impala si è adattato con successo al suo ambiente già dall'epoca preistorica. La sua natura gregaria, la dieta varia, un trend di popolazione positivo, la difesa contro le zecche e il rapporto simbiotico con le bufaghe che di queste si nutrono potrebbero aver giocato tutti un ruolo nell'impedire grandi cambiamenti nella morfologia e nel comportamento[9].

L'impala è un'antilope dalla struttura agile, di medie dimensioni, simile nelle forme al kob o alla gazzella di Grant[17]. La lunghezza testa-corpo è di circa 130 cm[18]. I maschi raggiungono più o meno 75–92 cm di altezza al garrese, le femmine sono alte 70–85 cm. Il peso si aggira sui 53–76 kg nei maschi e sui 40–53 kg nelle femmine. Il dimorfismo sessuale è molto evidente, in quanto le femmine sono prive di corna e più piccole dei maschi. Questi, infatti, hanno delle sottili corna a forma di lira lunghe 45–92 cm[17]. Le corna, fortemente anellate e divergenti, hanno sezione circolare e sono cave alla base. La loro struttura ad arco consente di bloccare i colpi assestati da altri maschi, il che aiuta il maschio possessore a respingere il suo avversario durante i combattimenti; le corna servono anche a proteggere il cranio da eventuali danni[13][17].
Il lucido manto dell'impala presenta due toni diversi di colorazione - quello bruno-rossastro del dorso e quello color tanno dei fianchi; entrambi contrastano fortemente con il bianco dell'addome. Sulla faccia sono evidenti degli anelli bianchi intorno agli occhi e la colorazione chiara di mento e muso. Le orecchie, lunghe 17 cm, hanno la punta nera[13][19]. Una striscia nera corre dalle natiche alla parte superiore delle cosce. La coda, bianca e folta, è lunga 30 cm e presenta una strisca nera lungo la linea mediana[19]. La colorazione dell'impala presenta una stretta somiglianza con quella del gerenuk, ma quest'ultimo ha corna più corte ed è privo delle strisce nere sul posteriore[13]. Sulle zampe posteriori l'impala possiede delle ghiandole odorifere ricoperte da un ciuffo di peli neri. Le ghiandole sebacee concentrate sulla fronte e sparse sul tronco dei maschi dominanti[17][20] sono più attive durante la stagione degli amori, mentre quelle delle femmine sono solo parzialmente sviluppate e non vanno incontro a cambiamenti stagionali[21]. Sono presenti quattro capezzoli[17].
Delle due sottospecie, l'impala dalla faccia nera è significativamente più grande e più scuro dell'impala comune; responsabile del suo colore scuro è il melanismo[22]. Caratteristica distintiva dell'impala dalla faccia nera è una striscia nera, su entrambi i lati del naso, che corre fino agli occhi e si assottiglia sulla fronte[18][19]. Altre differenze sono la macchia nera più grande sulla punta delle orecchie e una coda più folta e più lunga di quasi il 30%[13].
L'impala ha una caratteristica disposizione dei denti sulla parte frontale della mascella inferiore simile ai denti a pettine dei primati strepsirrini[23]; questi denti vengono usati durante l'allogrooming per pettinare i peli sulla testa e sul collo e rimuovere gli ectoparassiti[13][24].

L'impala è un animale diurno, ma tende a cessare ogni attività durante le calde ore di metà giornata; di notte mangia e si riposa[17]. Possono essere osservati tre tipi distinti di gruppi sociali - maschi territoriali, branchi di scapoli e branchi di femmine[25]. I maschi territoriali occupano dei territori in cui possono formarsi harem di femmine; i territori vengono demarcati con urina e feci e difesi dalle intrusioni dei giovani o degli altri maschi[17]. I branchi di scapoli tendono ad essere poco numerosi, con un numero di esemplari inferiore alle 30 unità. I vari individui mantengono una distanza di 2,5–3 m l'uno dall'altro; mentre maschi giovani e anziani possono interagire tra loro, i maschi di mezza età generalmente evitano ogni contatto, tranne per attaccar briga. I branchi di femmine variano per dimensioni dalle 6 alle 100 unità; i branchi occupano home ranges di 80-180 ettari. Il legame tra la madre e il piccolo è debole e si interrompe poco dopo lo svezzamento; i giovani lasciano il branco in cui sono nati per unirsi ad altre mandrie. I branchi di femmine tendono ad essere più aperti e non hanno una vera e propria leadership[17][26]. L'allogrooming svolge un importante ruolo di interazione sociale presso i branchi di femmine e di scapoli; in effetti, l'impala sembra essere l'unico ungulato a mostrare interesse sia alla pulizia del proprio corpo che a quello dei propri simili. In quest'ultimo caso, le femmine generalmente si dedicano alla pulizia di esemplari imparentati con esse, mentre presso i maschi tale comportamento è riservato ad esemplari con cui non sono imparentati. Ogni partner pulisce l'altro tra le sei e le dodici volte[27].

Il comportamento sociale è influenzato dal clima e dalla geografia: infatti, gli impala sono territoriali in certi periodi dell'anno e gregari in altri, e la durata di questi periodi può variare anche notevolmente da una popolazione all'altra. Per esempio, le popolazioni dell'Africa meridionale mostrano un comportamento territoriale solo durante i pochi mesi in cui vanno in calore, mentre nelle popolazioni dell'Africa orientale la territorialità è ridotta al minimo, nonostante una stagione degli amori ben più lunga. Inoltre, i maschi territoriali spesso tollerano gli scapoli e possono persino vivere come scapoli o come individui territoriali in periodi diversi dell'anno. Uno studio condotto nel parco nazionale del Serengeti ha riscontrato comportamenti territoriali per periodi di tempo inferiori a quattro mesi nel 94% dei maschi[17].
L'impala costituisce una preda importante per vari carnivori, tra cui ghepardi, leopardi e leoni. Quando fugge, questa antilope si esibisce in due caratteristici tipi di salto: può saltare in aria fino a 3 m di altezza, scavalcando la vegetazione e addirittura altri impala, coprendo una distanza anche di 10 m; oppure effettuare una serie di salti atterrando sulle zampe anteriori, muovendo quelle posteriori a mezz'aria come se scalciasse, atterrare su tutte e quattro le zampe (stotting) e poi proseguire con nuovi salti. Salta in entrambi i modi in direzioni diverse, probabilmente per confondere i predatori[13][28]. Altre volte, l'impala può anche nascondersi tra la vegetazione per evitare di essere scorto dagli occhi del predatore[29]. Il suono più caratteristico prodotto da questa specie consiste in un forte bramito, che emette producendo da uno a tre sbuffi con la bocca chiusa, seguiti da due a dieci profondi grugniti emessi con la bocca aperta e il mento e la coda sollevati; uno di questi bramiti può essere udito fino a 2 km di distanza[17]. Le secrezioni delle ghiandole odorifere consentono di identificare un maschio terriroriale[30]. Gli impala sono sedentari; i maschi adulti e di mezza età, in particolare, possono occupare lo stesso territorio per diversi anni[17].

Tra le specie di zecche della famiglia degli Ixodidi che si rinvengono comunemente sugli impala vi sono Amblyomma hebraeum, Boophilus decoloratus, Hyalomma marginatum, Ixodes cavipalpus, Rhipicephalus appendiculatus e R. evertsi[31][32][33]. In Zimbabwe, le gravi infestazioni da parte di zecche quali R. appendiculatus sono risultate essere la causa principale dell'elevata mortalità di ungulati, dal momento che queste possono portare a paralisi da zecca. L'impala è dotato di speciali adattamenti per il grooming, come la caratteristica disposizione dei denti già ricordata, per rimuovere le zecche prima che inizino a succhiare; tuttavia, la grande cura necessaria per tenere sotto controllo il numero di zecche può comportare il rischio di disidratazione durante l'estate, una minore vigilanza contro i predatori e una graduale usura dei denti. Uno studio ha dimostrato che l'impala regola il tempo dedicato al grooming e il numero di «sedute di pulizia» effettuate in base alla prevalenza stagionale delle zecche[31].
Gli impala sono legati da un rapporto simbiotico con le bufaghe[34], che si nutrono di quelle zecche presenti su quelle parti del corpo cui le antilopi non riescono ad accedere da sole (come orecchie, collo, palpebre, fronte e addome). L'impala è l'ungulato più piccolo ad aver stretto una simbiosi con le bufaghe. Nel corso di uno studio si è visto che le bufaghe sceglievano accuratamente gli impala nonostante la presenza di altri animali quali l'alcelafo di Coke, la gazzella di Grant, la gazzella di Thompson e il topi. Forse questa scelta potrebbe essere dovuta al fatto che, abitando nelle steppe arbustive (un ambiente dove la densità di zecche è più alta), l'impala potrebbe ospitare un numero maggiore di zecche per unità di superficie corporea[35]. Un altro studio ha dimostrato che le bufaghe preferiscono le orecchie rispetto ad altre parti del corpo, probabilmente perché queste zone presentano la massima infestazione da zecche[36].
Tra i pidocchi rinvenuti sull'impala figurano Damalinia aepycerus, D. elongata, Linognathus aepycerus e L. nevilli; nel corso di uno studio, l'ivermectina (un farmaco antiparassitario) si è dimostrata efficace contro Boophilus decoloratus e le specie del genere Linognathus, ma non contro quelle del genere Damalinia[37]. In un altro studio effettuato sugli impala del Sudafrica, il numero di vermi nei giovani è risultato essere correlato con l'aumento dell'età, raggiungendo un picco massimo negli esemplari di un anno. Questo studio ha registrato la presenza di vermi appartenenti a generi quali Cooperia, Cooperoides, Fasciola, Gongylonema, Haemonchus, Impalaia, Longistrongylus e Trichostrongylus; alcuni di questi hanno mostrato variazioni stagionali nella densità[38].

L'impala può essere sia brucatore che pascolatore a seconda della disponibilità delle risorse[39]. La dieta comprende monocotiledoni, dicotiledoni, piante erbacee, frutti e baccelli di acacia (quando disponibili). L'impala predilige i luoghi vicini agli specchi d'acqua e, quando l'acqua scarseggia, ripiega sulle piante succulente[17]. Uno studio ha mostrato che la dieta dell'impala è costituita per il 45% da monocotiledoni, il 45% da dicotiledoni e il 10% da frutta; la percentuale di erba nella dieta sale notevolmente (addirittura fino al 90%) dopo le prime piogge, ma scende nella stagione secca[40]. Gli arbusti prevalgono alla fine della stagione umida e durante la stagione secca, e la dieta è particolarmente povera di sostanze nutritive intorno alla metà della stagione secca, quando l'impala si nutre per lo più di dicotiledoni legnose[13][41]. Un altro studio ha indicato che la percentuale di dicotiledoni nella dieta è molto più alta negli scapoli e nelle femmine che nei maschi territoriali[42].
Gli impala si nutrono di graminacee morbide e nutrienti quali Digitaria macroblephara; tuttavia, erbe più alte, come Heteropogon contortus e Themeda triandra, vengono generalmente evitate[43]. Gli impala che si trovano alla periferia del branco sono generalmente più vigili nei confronti dei predatori di quelli che pascolano al centro; un esemplare che pascola può cercare di difendere l'appezzamento dove sta mangiando abbassando la testa[44]. Uno studio ha rivelato che il tempo speso a pascolare è maggiore (pari al 75,5% della giornata) alla fine della stagione secca, scende durante la stagione delle piogge e tocca il minimo agli inizi della stagione secca (57,8% della giornata)[45].

I maschi raggiungono la maturità sessuale ad un anno di età, ma generalmente riescono a riprodursi con successo solo dopo i quattro anni. I maschi maturi iniziano ad occupare propri territori e cercano di ottenere l'accesso alle femmine. Le femmine possono concepire dopo un anno e mezzo di età; l'estro dura 24-48 ore e, nelle femmine non gravide, ha luogo ogni 12-29 giorni[29]. Il periodo del calore, della durata di tre settimane, inizia verso la fine della stagione umida, generalmente in maggio. L'ingrossamento delle gonadi e la produzione di ormoni nei maschi inizia pochi mesi prima della stagione riproduttiva; ne consegue un incremento dell'aggressività e della territorialità[17]. Durante il periodo del calore le ghiandole bulbouretrali si ingrossano, i livelli di testosterone dei maschi territoriali presentano livelli quasi doppi rispetto a quelli degli scapoli[46] e il collo tende a diventare più spesso. Quasi tutti gli accoppiamenti hanno luogo nel periodo che intercorre tra due pleniluni[17].
I maschi in calore combattono tra loro per il predominio, spesso emettendo bramiti rumorosi e rincorrendosi; camminano impettiti e mettono in mostra il collo e le corna. Durante questo periodo i maschi esitano a mangiare e a dedicarsi all'allogrooming, probabilmente per dedicare più tempo ad attirare le femmine in estro[47]; per assicurarsi che le femmine siano in estro, il maschio ne esamina l'urina[47][48]. Quando trova una femmina in calore, il maschio eccitato comincia a corteggiarla inseguendola, tenendosi ad una distanza di 3–5 m da lei. Il maschio fa schioccare la lingua, alzando e abbassando vigorosamente la testa; la femmina gli permette di leccarle la vulva spostando la coda da un lato. Il maschio cerca di montarla, tenendo la testa alta e cingendole i fianchi con le zampe anteriori. I tentativi di monta possono essere ripetuti ogni pochi secondi per un minuto o due. Dopo la prima copulazione il maschio perde interesse per la femmina, ma essa è ancora attiva e può accoppiarsi con altri maschi[17][25].
La gestazione dura dai sei ai sette mesi. Le nascite si verificano generalmente intorno a mezzogiorno; la femmina si isola dalla mandria non appena iniziano i dolori del travaglio[49]. L'ipotesi che le femmine possano ritardare il parto per un mese o più se le condizioni ambientali sono sfavorevoli potrebbere non essere realistica[50]. Dopo la nascita, il piccolo viene immediatamente nascosto nel fitto della vegetazione, dove rimarrà per le prime settimane di vita, trascorse le quali si unisce agli altri piccoli del gruppo materno. I piccoli vengono allattati per un periodo variabile dai quattro ai sei mesi; i giovani maschi, costretti a lasciare il gruppo, si uniscono ai branchi di scapoli, mentre le femmine possono restare nel gruppo in cui sono nate[17].



Gli impala abitano nella steppa arbustiva, in quanto amano stare all'ombra; possono essere presenti anche nelle zone di transizione (ecotoni) tra steppe arbustive e savane. Preferiscono sempre i luoghi vicini alle fonti d'acqua. In Africa meridionale la specie tende ad essere associata alle steppe arbustive di Colophospermum mopane e di Senegalia[17][39]. La scelta dell'habitat varia da una stagione all'altra: durante la stagione umida vengono preferite le steppe arbustive di Senegalia senegal e nella stagione secca le savane di Vachellia drepanolobium. Un altro fattore che può influenzare la scelta dell'habitat è la vulnerabilità ai predatori; gli impala tendono a tenersi alla larga dalle zone con erba alta, in quanto potrebbero nascondervisi i predatori[43]. Uno studio ha dimostrato che la riduzione dell'estensione della steppa arbustiva e la creazione di boscaglia a seguito dell'azione degli elefanti africani ha favorito la popolazione degli impala, in quanto questo ha incrementato la disponibilità di arbusti da brucare durante la stagione secca. In precedenza, la steppa arbustiva di Baikiaea, ora andata restringendosi a causa degli elefanti, forniva pochi arbusti da brucare agli impala. La nuova boscaglia di Capparis andata formandosi, al contrario, potrebbe fornire un habitat ideale per quanto riguarda i bisogni alimentari[51]. Gli impala non vengono generalmente associati ad habitat montani[13], ma nel KwaZulu-Natal la specie è stata segnalata fino a 1400 m sul livello del mare[39].
L'areale storico dell'impala - comprendente gran parte dell'Africa meridionale e orientale - è rimasto quasi invariato, anche se la specie è scomparsa da alcune regioni, come il Burundi. L'area di diffusione si estende ad est dal Kenya centrale e meridionale e dall'Uganda nord-orientale fino al KwaZulu-Natal settentrionale a sud e alla Namibia e all'Angola meridionale ad ovest. L'impala dalla faccia nera è confinato all'Angola sud-occidentale e alla regione del Kaokoland (Namibia nord-occidentale); il suo stato di conservazione non è più stato valutato dagli anni 2000. L'impala comune è ampiamente diffuso in tutto il suo areale ed è stato reintrodotto in aree protette del Gabon e dell'Africa meridionale[1].
L'Unione internazionale per la conservazione della natura (IUCN) classifica l'impala come «specie a rischio minimo»[1]. L'impala dalla faccia nera, invece, viene classificato come «vulnerabile», dal momento che nel 2008 ne rimanevano in natura meno di 1000 esemplari[52]. Mentre la sopravvivenza dell'impala comune non è mai stata messa in dubbio, il bracconaggio e le calamità naturali hanno ridotto notevolmente il numero degli impala dalla faccia nera. Nel 2008 il numero complessivo di impala comuni è stato stimato intorno ai due milioni[1]. Secondo alcuni studi, il trasferimento in altre zone di esemplari di impala dalla faccia nera potrebbe essere di grande aiuto per la sua conservazione[53][54].
Circa un quarto della popolazione di impala comuni vive all'interno di aree protette, come il delta dell'Okavango (Botswana); il Masai Mara e Kajiado (Kenya); il parco nazionale Kruger (Sudafrica); i parchi nazionali di Ruaha e del Serengeti e la riserva faunistica di Selous (Tanzania); la valle del Luangwa (Zambia); Hwange, Sebungwe e la valle dello Zambesi (Zimbabwe). Il raro impala dalla faccia nera è stato introdotto in fattorie private della Namibia e nel parco nazionale d'Etosha. La densità di popolazione varia fortemente da un luogo all'altro: si va da meno di un esemplare per chilometro quadrato nel parco nazionale di Mkomazi (Tanzania) ai 135 per chilometro quadrato nelle vicinanze del lago Kariba (Zimbabwe)[1][55].
| Controllo di autorità | LCCN (EN) sh85064601 · GND (DE) 4679076-7 · J9U (EN, HE) 987007541090005171 · NDL (EN, JA) 00575572 |
|---|