Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
L'ion peroxynitrite et l'acide peroxynitreux sont connus depuis le début du XXe siècle. Depuis le milieu des années 1990, ces deux entités prennent une importance croissante dans la compréhension de nombreux phénomènes cellulaires, et en particulier dans l'explication du suicide cellulaire (apoptose).
Au laboratoire, le peroxynitrite de sodium est obtenu par action de l'ozone O3 sur l'azoture de sodium NaN3, ainsi que par celle de l'eau oxygénée (peroxyde d'hydrogène) sur l'ion nitrite:
H2O2 + NO2− → ONOO− + H2O
La synthèse in vivo de l'ion peroxynitrite se fait en milieu intracellulaire par réaction rapide du monoxyde d'azote avec l'ion superoxyde O2.-.

La constante de vitesse de cette réaction est comprise, selon les auteurs, entre 5 × 109 et 2 × 1010 mol−1 s−1 [1],[2], alors que celle de la réaction inverse est inférieure à 1 s−1. Alors que l'ion peroxynitrite est relativement stable, son acide conjugué, l'acide peroxynitreux HOONO, s'isomérise lentement en ion nitrate. La constante de vitesse de cette isomérisation est elle de 1,2 s−1 [3].
C'est pourquoi le temps de demi-vie in vivo des peroxynitrites est relativement élevé, à savoir 20 ms[4].
Sa mise en évidence et son dosage in vivo sont obtenus par le dosage de la nitrotyrosine qui se forme très rapidement lorsque cet acide aminé est en sa présence (ou plutôt en présence de nitrosoperoxycarbonate, voir ci-dessous le schéma des réactions des peroxynitrites).

Le pKa du couple acide peroxynitreux/ion peroxynitrite est de 6,8. le potentiel redox du couple ion peroxynitreux/dioxyde d'azote est de 1,4 V à pH = 7[5].
Il est possible d'en déduire le diagramme potentiel-pH suivant :
Il est remarquable de constater que le pKa de ce couple est très proche du pH physiologique (7,4). Nous pouvons en déduire que la forme acide représente 20 % de la totalité de l'espèce à ce pH.
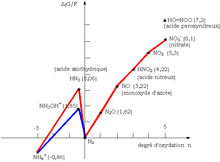
À pH=0, le diagramme de Frost de l'azote nous montre le caractère éminemment oxydant de l'acide peroxynitreux.
Ce caractère explique en grande partie ses propriétés d'agent de nitration des cycles aromatiques activés, tels les phénols (tyrosine), les anilines (mifépristone), ainsi que ses propriétés mutagènes (coupure de chaînes d'ADN, oxydation de la déoxyguanosine en 8-nitrodéoxyguanosine et en 8-oxodéoxyguanosine)[6],[7].
Voici résumées les principales réactions des peroxynitrites et de l'acide peroxynitreux dont l'importance biologique est remarquable[8],[9].

Ce sont eux qui donnent le signal de l'apoptose voire de la nécrose cellulaires ainsi que le montre le schéma suivant [10]:

Ils sont à l'origine de la suite de réactions qui participent à la synthèse des prostaglandines et interviennent donc dans les processus inflammatoires[11],[12]. La consommation de ces peroxynitrites par les composés à cycle aromatique activé tels que ceux de nombreux antiinflammatoires peut expliquer l'activité de ceux-ci. C'est que confirment Schildknecht et al pour le paracétamol[13]
Les peroxynitrites sont également connus pour oxyder directement les thiols en sulfates[14], pour être une des causes de la peroxydation des lipides[15]. Les amines tertiaires aliphatiques sont également oxydées[16]
La réplication du VIH est intimement liée à la présence de peroxynitrites, car la décomposition de ceux-ci par le MnTBAP (chlorure de Mn(III)tetrakis(4-benzoic acid)porphrin) inhibe à 99 % cette réplication lors d'une infection aiguë et à 90 % lors d'une infection chronique[17].