| Difluor
|
|
| Identification |
| Nom UICPA
|
difluor
|
| No CAS
|
7782-41-4
|
| No ECHA
|
100.029.049 |
| No CE
|
231-954-8
|
| PubChem
|
24524
|
| SMILES
|
|
| Apparence
|
gaz comprimé, jaune, d'odeur âcre[1]
|
| Propriétés chimiques |
| Formule
|
F2 [Isomères]
|
| Masse molaire[2]
|
37,996 806 4 ± 1,0E−6 g/mol
F 100 %,
|
| Propriétés physiques |
| T° fusion
|
−219 °C[1]
|
| T° ébullition
|
−188 °C[1]
|
| Solubilité
|
dans l'eau : réaction[1]
|
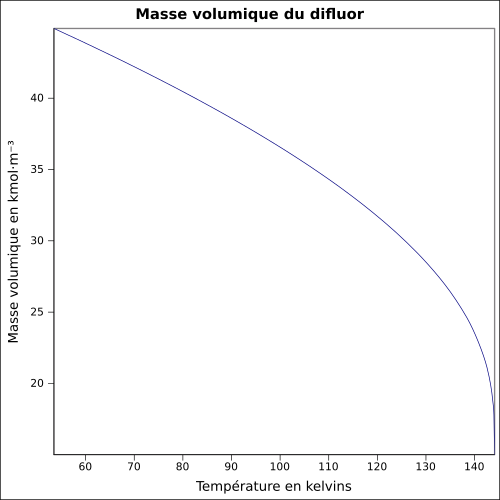
| Masse volumique
|
liq. à −188,13 °C : 1,512 7 g·cm-3
équation[3] : 
Masse volumique du liquide en kmol·m-3 et température en kelvins, de 53,48 à 144,12 K.
Valeurs calculées :
| T (K) |
T (°C) |
ρ (kmol·m-3) |
ρ (g·cm-3) |
|---|
| 53,48 |
−219,67 |
44,888 |
1,70561 |
| 59,52 |
−213,63 |
43,93139 |
1,66926 |
| 62,54 |
−210,61 |
43,44282 |
1,6507 |
| 65,57 |
−207,58 |
42,94684 |
1,63185 |
| 68,59 |
−204,56 |
42,44298 |
1,61271 |
| 71,61 |
−201,54 |
41,93073 |
1,59324 |
| 74,63 |
−198,52 |
41,4095 |
1,57344 |
| 77,65 |
−195,5 |
40,87866 |
1,55327 |
| 80,67 |
−192,48 |
40,33749 |
1,5327 |
| 83,69 |
−189,46 |
39,78517 |
1,51172 |
| 86,71 |
−186,44 |
39,2208 |
1,49027 |
| 89,74 |
−183,41 |
38,64333 |
1,46833 |
| 92,76 |
−180,39 |
38,05156 |
1,44584 |
| 95,78 |
−177,37 |
37,44409 |
1,42276 |
| 98,8 |
−174,35 |
36,81932 |
1,39902 |
|
| T (K) |
T (°C) |
ρ (kmol·m-3) |
ρ (g·cm-3) |
|---|
| 101,82 |
−171,33 |
36,17533 |
1,37455 |
| 104,84 |
−168,31 |
35,50984 |
1,34927 |
| 107,86 |
−165,29 |
34,82012 |
1,32306 |
| 110,89 |
−162,26 |
34,10281 |
1,2958 |
| 113,91 |
−159,24 |
33,3537 |
1,26734 |
| 116,93 |
−156,22 |
32,56748 |
1,23747 |
| 119,95 |
−153,2 |
31,73721 |
1,20592 |
| 122,97 |
−150,18 |
30,85354 |
1,17234 |
| 125,99 |
−147,16 |
29,90345 |
1,13624 |
| 129,01 |
−144,14 |
28,86783 |
1,09689 |
| 132,03 |
−141,12 |
27,71661 |
1,05315 |
| 135,06 |
−138,09 |
26,39774 |
1,00303 |
| 138,08 |
−135,07 |
24,80558 |
0,94254 |
| 141,1 |
−132,05 |
22,65024 |
0,86064 |
| 144,12 |
−129,03 |
15,005 |
0,57014 |
|
|
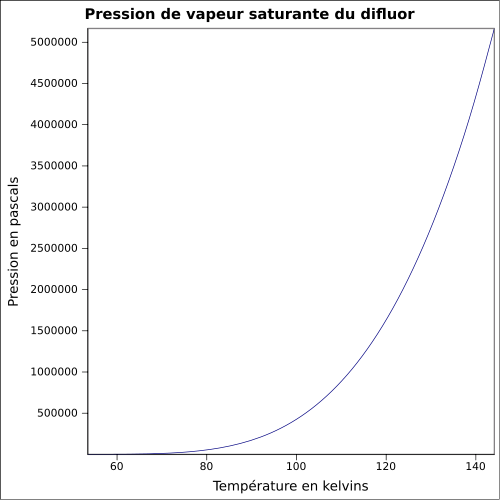
| Pression de vapeur saturante
|
équation[3] : 
Pression en pascals et température en kelvins, de 53,48 à 144,12 K.
Valeurs calculées :
| T (K) |
T (°C) |
P (Pa) |
|---|
| 53,48 |
−219,67 |
252,72 |
| 59,52 |
−213,63 |
1 373,37 |
| 62,54 |
−210,61 |
2 801,05 |
| 65,57 |
−207,58 |
5 316,85 |
| 68,59 |
−204,56 |
9 487,4 |
| 71,61 |
−201,54 |
16 047,5 |
| 74,63 |
−198,52 |
25 908,83 |
| 77,65 |
−195,5 |
40 160,68 |
| 80,67 |
−192,48 |
60 063,62 |
| 83,69 |
−189,46 |
87 037,46 |
| 86,71 |
−186,44 |
122 645,4 |
| 89,74 |
−183,41 |
168 576,05 |
| 92,76 |
−180,39 |
226 625,46 |
| 95,78 |
−177,37 |
298 680,29 |
| 98,8 |
−174,35 |
386 703,51 |
|
| T (K) |
T (°C) |
P (Pa) |
|---|
| 101,82 |
−171,33 |
492 723,39 |
| 104,84 |
−168,31 |
618 826,29 |
| 107,86 |
−165,29 |
767 153,45 |
| 110,89 |
−162,26 |
939 901,84 |
| 113,91 |
−159,24 |
1 139 328,9 |
| 116,93 |
−156,22 |
1 367 761,1 |
| 119,95 |
−153,2 |
1 627 605,79 |
| 122,97 |
−150,18 |
1 921 366,39 |
| 125,99 |
−147,16 |
2 251 660,41 |
| 129,01 |
−144,14 |
2 621 240,25 |
| 132,03 |
−141,12 |
3 033 016,55 |
| 135,06 |
−138,09 |
3 490 083,98 |
| 138,08 |
−135,07 |
3 995 749,54 |
| 141,1 |
−132,05 |
4 553 563,27 |
| 144,12 |
−129,03 |
5 167 400
|
|
 |
| Point critique
|
52,2 bar, −128,85 °C[4]
|
| Thermochimie |
| ΔvapH°
|
6,62 kJ·mol-1 (1 atm, −188,12 °C)[5]
|
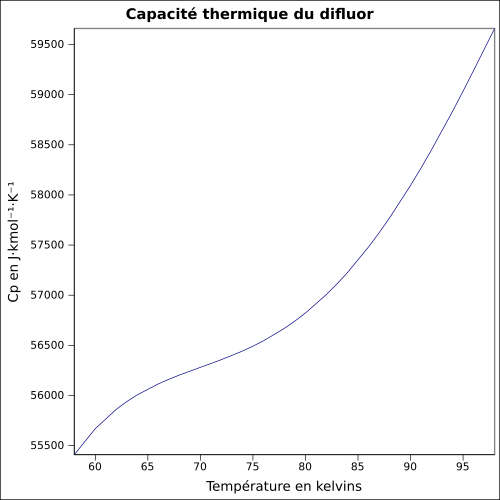
| Cp
|
équation[3] : 
Capacité thermique du liquide en J·kmol-1·K-1 et température en kelvins, de 58 à 98 K.
Valeurs calculées :
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
|---|
| 58 |
−215,15 |
55 410 |
1 458 |
| 60 |
−213,15 |
55 670 |
1 465 |
| 62 |
−211,15 |
55 863 |
1 470 |
| 63 |
−210,15 |
55 940 |
1 472 |
| 64 |
−209,15 |
56 007 |
1 474 |
| 66 |
−207,15 |
56 116 |
1 477 |
| 67 |
−206,15 |
56 162 |
1 478 |
| 68 |
−205,15 |
56 204 |
1 479 |
| 70 |
−203,15 |
56 281 |
1 481 |
| 71 |
−202,15 |
56 319 |
1 482 |
| 72 |
−201,15 |
56 358 |
1 483 |
| 74 |
−199,15 |
56 443 |
1 485 |
| 75 |
−198,15 |
56 492 |
1 487 |
| 76 |
−197,15 |
56 545 |
1 488 |
| 78 |
−195,15 |
56 670 |
1 491 |
|
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
|---|
| 79 |
−194,15 |
56 743 |
1 493 |
| 80 |
−193,15 |
56 823 |
1 495 |
| 82 |
−191,15 |
57 008 |
1 500 |
| 83 |
−190,15 |
57 113 |
1 503 |
| 84 |
−189,15 |
57 226 |
1 506 |
| 86 |
−187,15 |
57 481 |
1 513 |
| 87 |
−186,15 |
57 621 |
1 516 |
| 88 |
−185,15 |
57 771 |
1 520 |
| 90 |
−183,15 |
58 095 |
1 529 |
| 91 |
−182,15 |
58 269 |
1 534 |
| 92 |
−181,15 |
58 451 |
1 538 |
| 94 |
−179,15 |
58 834 |
1 548 |
| 95 |
−178,15 |
59 035 |
1 554 |
| 96 |
−177,15 |
59 241 |
1 559 |
| 98 |
−175,15 |
59 660 |
1 570 |
|
|
| Propriétés électroniques |
| 1re énergie d'ionisation
|
15,697 ± 0,003 eV (gaz)[6]
|
| Précautions |
| SGH[7] |
H270, H314 et H330H270 : Peut provoquer ou aggraver un incendie ; comburant
H314 : Provoque de graves brûlures de la peau et des lésions oculaires
H330 : Mortel par inhalation
|
| SIMDUT[8] |
   
A, D1A, E, F, A : Gaz comprimé température critique = −128,8 °CD1A : Matière très toxique ayant des effets immédiats graves Transport des marchandises dangereuses : classe 2.3 E : Matière corrosive Transport des marchandises dangereuses : classe 8 F : Matière dangereusement réactive réagit violemment au contact de l'eau en dégageant un gaz très toxique : difluorure d'oxygène Divulgation à 1,0% selon la liste de divulgation des ingrédients |
| NFPA 704 |
|
| Inhalation
|
irritation, spasmes bronchiaux, œdème pulmonaire
|
| Peau
|
brûlures
|
| Yeux
|
irritation, brûlures
|
| Ingestion
|
taches dentaires, ostéosclérose
|
| Écotoxicologie |
| CL50
|
rat 185 ppm (volume),
souris 150 ppm,
cochon d'Inde 170 ppm
|
| Seuil de l’odorat
|
bas : 0,09 ppm
haut : 0,19 ppm[9]
|
|
| Unités du SI et CNTP, sauf indication contraire. |
 |





