Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Carbure d'hafnium | |||
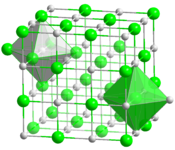 __ Hf4+ __ C4− Structure du carbure d'hafnium(IV) |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.031.910 | ||
| No CE | 235-114-1 | ||
| PubChem | 16212551 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | HfC | ||
| Masse molaire[1] | 190,5 ± 0,02 g/mol C 6,3 %, Hf 93,7 %, |
||
| Propriétés physiques | |||
| T° fusion | 3 890 °C[2] | ||
| Masse volumique | 12,2 g·cm-3[2] | ||
| Cristallographie | |||
| Système cristallin | Cubique | ||
| Classe cristalline ou groupe d’espace | (no 225) |
||
| Structure type | Halite | ||
| Précautions | |||
| SGH[2] | |||
| H228, P210, P240, P241 et P280 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| |
|||
Le carbure d'hafnium est une famille de composés binaires de carbone et d'hafnium ayant la formule chimique générique HfCx, où x est généralement compris entre 0,5 et 1 ; x = 0.5 correspond ainsi au carbure d'hafnium(II) Hf2C tandis que x = 1 correspond au carbure d'hafnium(IV). Il présente une structure cristalline de type sel gemme pour toutes les valeurs de x[3].
Ce sont des céramiques ultraréfractaires dont la température de fusion atteint environ 3 890 °C. Ils sont cependant assez sensibles à l'oxydation, qui commence dès 430 °C[4].
Le carbure d'hafnium pulvérulent est obtenu par réduction de l'oxyde d'hafnium(IV) avec du carbone de 1 800 à 2 000 °C. L'élimination de tout l'oxygène demande un long temps de traitement. Il est également possible de déposer des couches minces de carbure d'hafnium de haute pureté par dépôt chimique en phase vapeur à partir d'un mélange de méthane, d'hydrogène et de tétrachlorure d'hafnium. La production des carbures d'hafnium reste techniquement compliquée et coûteuse, ce qui limite les applications de ces matériaux malgré leurs propriétés intéressantes, notamment leur dureté (voisine de 9 sur l'échelle de Mohs) et leur température de fusion élevées.
Les HfCx sont paramagnétiques pour x ≤ 0,8 et deviennent diamagnétiques pour x > 0,8. Le carbure de tantale présente le comportement inverse bien qu'il partage la même structure cristalline que le carbure de hafnium[5].