Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.



Fluorestsents (sõna tuleneb mineraalist fluoriit[1]) on valguse kiirgumine ainest, mis on eelnevalt ergastatud UV-kiirgusega või nähtava valgusega.[2] See on luminestsentsi alaliik.
Enamikul juhtudel omab emiteeruv kiirgus pikemat lainepikkust kui neelatav kiirgus ja seeläbi omab ka madalamat energiat. Samas, kui neelatav elektromagnetiline kiirgus on väga intensiivne, võib üks elektron neelata ka kaks footonit. Selline nähtus võib esile kutsuda fluorestsentsi, millel on lühem lainepikkus kui neelatud kiirgusel.
Fluorestsentsil on palju rakendusi, seda kasutatakse näiteks mineraloogias, spektroskoopias, metallide määramisel, keskkonna ja tervisekaitse analüüsides, värvides, fluorestsentslampides, bioaktiivsete ainete määramisel, immunoanalüüsides.
Ühe esimestest varajastest tähelepanekutest fluorestsentsi olemasolu kohta tegi 1565. aastal Nicolás Monardes, kui ta uuris ühe Kesk-Ameerikast pärit puidu (Lignum nephriticum) leotist [3]. Selle fluorestsentsi põhjustas keemiline ühend, mis on ühe selles puus leiduva flavonoidi redoksreaktsiooni produkt.[4]
1819. aastal kirjeldas Edward D. Clarke ja 1822. aastal René Just Haüy fluorestsentsi fluoriidis, 1833. aastal kirjeldas Sir David Brewster seda fenomeni klorofüllis ja 1845. aastal Sir John Herschel hiniinis.
1852. aastal kirjutas George Gabriel Stokes oma artiklis fluoriidist ja uraaniklaasist, mida ta kirjeldas kui materjale, millel on võime muuta nähtamatut ultraviolettkiirgust nähtavaks pikema lainepikkusega kiirguseks. Ta nimetas seda fenomeni fluorestsentsiks.[5] Nimetuse tuletas ta fluoriidist. Oma põhikatses kasutas ta prismat ultraviolettkiirguse eraldamiseks päikesekiirgusest, kiiritas sellega hiniini etanoolilahust ja täheldas selle tagajärjel sinist valgust.
Fluorestsents toimub, kui pärast kõrgemale energianivoole ergastamist emiteerib elektron valgusefootoni ja seeläbi relakseerub oma põhiolekusse.
Ergastus:
Fluorestsents (kiirgumine):

on footoni energia üldtuntud tähistus, kus h on Plancki konstant ja (väike kreeka täht nüü) on valguse sagedus. Olekut S0 nimetatakse fluorofoori põhiolekuks ja S1 on tema esimene elektroonse ergastuse tase. Molekul võib oma ergastatud olekust relakseeruda mitme omavahel konkureeriva viisiga:
S1 olekust relakseerumine võib toimuda ka teise molekuliga vastastikmõju toimel, mida nimetatakse fluorestsentsi kustutamiseks. Näiteks molekulaarne hapnik (O2) on väga tugev ja efektiivne fluorestsentsi kustutaja oma ebatavalise tripletse põhioleku tõttu. Ergastatud molekulid võivad oma energia üle kanda ka mõnele teisele tundlikuks muudetud molekulile, mis ise seeläbi ergastub ja fluorestseerub.
Fluorestsentsi kvantsaagis näitab fluorestsentsi efektiivsust. Seda väljendatakse emiteerunud footonite ja neelatud footonite arvuhulkade suhtega.
Maksimaalne fluorestsentsi kvantsaagis võib olla 1,0 (100%); iga neeldunud footon ka kiiratakse. Ka ühendid, mille fluorestseerumise kvantsaagis on 0,1, loetakse üsna fluorestseeruvate ühendite alla. Teine võimalus, kuidas defineerida fluorestsentsi kvantsaagist, on kiirgusliku relakseerumise ja kõikide relakseerumisviiside kiiruskonstantide suhte abil.
kus fluorestsentskiirguse kiiruskonstant ja
on kõikide võimalike relakseerumisprotsesside kiirguskonstantide summa. Teised relakseerumisprotsessid on põhjustatud protsessidest, mis ei sisalda footoni kiirgamist, ja on seetõttu kutsutud mittekiirguslikeks üleminekuteks. Kui ükskõik millise ülemineku kiirus muutub, siis nii ergastatud oleku eluiga kui ka fluorestsentsi kvantsaagis on mõjutatud.[2] Fluorestsentsi kvantsaagist mõõdetakse standardiga võrreldes. Tavapärane fluorestsentsi standard on hiniinsulfaat väävelhappes.
Fluorestsentsi eluiga näitab keskmiselt, kui kaua on molekul ergastatud olekus enne footoni kiirgamist. Tavaliselt järgib fluorestsents esimest järku reaktsioonikineetikat.
kus on ajahetkel ergastatud olekus molekulide kontsentratsioon, on algkontsentratsioon ja on relakseerumise kiirus või ümberpööratud fluorestsentsi eluiga. Tegemist on eksponentsiaalse vähenemisega. Ka mittekiirguslikud protsessid võivad ergastatud olekus olevate elektronide arvu vähendada. Sel juhul on fluorestsentsi kustumise kiirus kõikide relakseerumisprotsesside kiiruste summa:
kus on täielik kustumise kiirus ja on mittekiirgusliku kustumise kiirus. Kui mõne relakseerumisprotsessi kiirus on suur, siis fluorestsentsi eluiga on lühike. Enamkasutatavamate fluorestsentsühendite puhul on tavaline fluorestsentsi eluiga 0,5–20 nanosekundit. Fluorestsentsi eluiga on tähtis parameeter praktiliste rakenduste juures, nagu näiteks Försteri resonantsenergia ülekandes.
Fluorestsentsspektroskoopia aparatuur vajab esmalt kiirgusallikat, mis suudab emiteerida kiirgust mitmel lainepikkusel. Tavaliselt on analüüsiks vaja ühte kindlat lainepikkust, mis selekteeritakse välja filtri või monokromaatoriga. Seejärel läbib see kindla lainepikkusega valguskiir proovi. Pärast neeldumist ja taaskiirgumist võivad ilmneda mitmed lainepikkused Stokesi nihke ja muude põhjuste tõttu. Et need lainepikkused eraldada ja analüüsida, on vaja veel ühte monokromaatorit. Teine monokromaator aga ei ole prooviküveti ja esimese monokromaatoriga sirge peal, vaid nende vahel on nurk. See on vajalik selleks, et ergastav kiirgus ei jõuaks teise monokromaatorini ja ei muudaks seeläbi analüüsi tulemusi. Pärast teist monokromaatorit jõuab kiirgus detektorisse.
Fluorestsentsi vaatlemiseks ja fluorestseeruvate objektide avastamiseks kasutatakse tihti ka taskulampe, mis annavad välja kiirgust UV-A lainevahemikus. Harvemini kasutatakse UV-B ja UV-C lampe (näiteks mineraalide vaatlemisel), kuid mille kiirgus on kahjustav ning nõuab kaitsevahendite kasutamist.
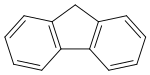

Kõige intensiivsem fluorestsents ilmneb ühendites, mis sisaldavad aromaatseid tuumi madalate üleminekute energiatega. Ka ühendid, mis omavad alifaatseid ja alitsüklilisi süsinikstruktuure või konjugeeritud kaksiksidemeid, võivad fluorestseeruda, aga nende kiirgumise intensiivsus on palju väiksem kui aromaatsetel ühenditel. Aromaatsete ühendite kvantsaagis tavaliselt suureneb aromaatsete tuumade arvu suurenemisega. Lihtsamad heteroaatomilised ühendid, nagu furaan ja püridiin, ei oma fluorestseeruvaid omadusi, kuid mitmetuumalised ühendid, nagu näiteks indool ja kinoliin, juba enamasti omavad. Lisaks aromaatsusele peab molekul olema ka jäik.
Näiteks kvantsaagised fluoreenile ja bifenüülile on vastavalt 1,0 ja 0,2. Sellist käitumise erinevust võib seletada fluoreeni molekuli jäikusega, mida põhjustab sillana käituv metüleenrühm. Väike jäikus suurendab mittekiirgusliku ülemineku tõenäosust, kuna mittekiirguslik relaksatsioon põhineb võnkumistel. Mida vähem on molekulil painduvaid osi, seda keerulisem on tal mittekiirguslikult relakseeruda. Ka väga paljud metallikompleksid on jäigad, kuna metall orienteerib ligandid tugevalt enda ümber. Näiteks fluorestsentsi intensiivsus vabal 8-hüdroksükinoliinil on palju väiksem kui tema jäigal metallikompleksil. Elektrodonoorsete rühmade rohkus ja elektronaktseptoorsete rühmade vähesus suurendavad fluorestsentsi tõenäosust.[6]
Happelise või aluselise kõrvalrühmaga aromaatse ühendi fluorestseerumisvõime sõltub tavaliselt pH-st. Nii emiteeruva kiirguse lainepikkus kui ka intensiivsus on ühendi ioniseeritud ja mitteioniseeritud vormi korral tõenäoliselt erinevad.

Esimest korda näidati avalikkusele fluorestsentslampe 1939. aastal New Yorgis. Fluorestsentslamp on olemuselt gaaslahenduslamp. Klaastoru sees on osaline vaakum ja väike kogus elavhõbedat. Elektrilahendus paneb elavhõbeda aatomid emiteerima UV-kiirgust. Toru on ääristatud fosfooriga, mis neelab UV-kiirgust ja kiirgab nähtavat valgust. Fluorestsentslamp on energiasäästlikum kui hõõglamp. Samas võib ebaühtlane fluorestsentslambi spekter põhjustada mõnede värvide ebaharilikku väljanägemist võrreldes hõõglambi või päevavalguse käes nägemisega. Elavhõbeda gaasi kiirgusspektris domineerib lühilaineline UV-joon 254 nm juures, lisaks on veel olemas nähtava valguse jooned 436 nm (sinine), 546 nm (roheline) ja 579 nm (kollane) juures. Valget valgust emiteerivad dioodid (light-emitting diodes – LED) tulid kasutusse 1990. aastate keskel LED-lampidena. LED-lampides tabab pooljuhist kiirguv sinine valgus luminofoori, sealt edasi ühineb sinine valgus luminofoorilt emiteeruva rohelise ja punase fluorestsentsiga, tootes valget valgust.
Paljud analüütilised protseduurid hõlmavad fluoromeetri kasutamist. Meetodi suure tundlikkuse tõttu on võimalik mõõta väga väikseid kontsentratsioone ja seda kasutatakse jälgede määramisel. Fluorestsentsi saab efektiivselt kasutada ka kromatograafias detektorina. Fluorestsentsi iseloomust tulenevalt on tegemist väga selektiivse detektoriga (nähakse ainult fluorestseeruvaid analüüte).

Võrreldes vedelikukromatograafias kõige levinuma UV-Vis detektoriga on fluorestsentsdetektor oluliselt tundlikum (avastamispiir on ligikaudu tuhat korda madalam, ulatudes ppm-ide ja ppb-de suurusjärku). Planaarkromatograafias saab plaate visualiseerida, kui ühend või värviv reagent on fluorestseeriv. Fluorestsents on kõige efektiivsem, kui Boltzmanni jaotuse järgi on madalamatel energiatasemetel palju aatomeid. Sel juhul on ergastumise ja footonite kiirgamise tõenäosus suurem, mis teeb analüüsi tõhusamaks.
Loodusteadustes kasutatakse fluorestsentsi mittedestruktiivse viisina bioloogiliste molekulide uurimisel. Kuna vähesed rakukomponendid on iseeneslikult fluorestseeruvad (autofluorestsents), siis saab neid jälgida kindlal sagedusel, kus puudub taustamüra ergastavast kiirgusest. Ka valku või mõnda muud ühendit saab märgistada välise fluorofooriga: fluorestsentsvärviga. Värvi kvantifitseerimist saab teha spektrofluoromeetriga ja seda rakendatakse näiteks järgmistel juhtudel:
2019. aastal täheldati et Ameerika lendoravlased perekonnast Glaucomys fluorestseeruvad roosakalt. Ultravioletis fluorestseeruv karv on ka mitmetel opossumlastel.[7]