Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
Acabo de realizar la consulta y arroja 1355 resultados |
El bicho Etiquetas: Revertido Edición visual Edición desde móvil Edición vía web móvil |
||
| Línea 53: | Línea 53: | ||
}} |
}} |
||
'''''Aves''''' es una [[clase (biología)|clase]] de [[Animalia|animales]] [[vertebrado]]s [[Homeotermia|homeotermos]] con los miembros anteriores |
'''''Aves''''' es una [[clase (biología)|clase]] de [[Animalia|animales]] [[vertebrado]]s [[Homeotermia|homeotermos]] con los miembros anteriores transformael bicho dos en [[ala (animal)|alas]], el cuerpo cubierto de [[pluma]]s y un [[pico (zoología)|pico]] córneo sin [[diente]]s. Para reproducirse [[ovíparo|ponen]] [[Huevo (biología)|huevos]] que incuban hasta su [[eclosión]]. |
||
Su grupo [[taxonómico]] se denomina [[clase (biología)|clase]] '''''Aves''''' —plural del latín ''avis—''<ref>{{Cita DLE|ave|fechaacceso=5 de julio de 2015}}</ref> y se encuentra dentro de los clados [[Theropoda]], [[Dinosauria]], [[Archosauria]] y [[Sauropsida]], dentro de la superclase [[Tetrápoda|Tetrapoda]]. |
Su grupo [[taxonómico]] se denomina [[clase (biología)|clase]] '''''Aves''''' —plural del latín ''avis—''<ref>{{Cita DLE|ave|fechaacceso=5 de julio de 2015}}</ref> y se encuentra dentro de los clados [[Theropoda]], [[Dinosauria]], [[Archosauria]] y [[Sauropsida]], dentro de la superclase [[Tetrápoda|Tetrapoda]]. |
||
| Aves | ||
|---|---|---|
| Rango temporal: 150,8 Ma-Reciente Titoniense (Jurásico Superior) - Reciente | ||
 Varios tipos de aves: Fila 1: Turaco crestirrojo, picozapato, rabijunco común | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Subfilo: | Vertebrata | |
| Infrafilo: | Gnathostomata | |
| Superclase: | Tetrapoda | |
| Clase: |
Aves[nota 1][1] Linnaeus, 1758[2] | |
| Superorden: | Dinosauria | |
| Subclases | ||
Aves es una clase de animales vertebrados homeotermos con los miembros anteriores transformael bicho dos en alas, el cuerpo cubierto de plumas y un pico córneo sin dientes. Para reproducirse ponen huevos que incuban hasta su eclosión.
Su grupo taxonómico se denomina clase Aves —plural del latín avis—[3] y se encuentra dentro de los clados Theropoda, Dinosauria, Archosauria y Sauropsida, dentro de la superclase Tetrapoda.
Las aves se originaron a partir de dinosaurios terópodos en el Jurásico, hace entre ciento cincuenta y doscientos millones de años y son los únicos dinosaurios que sobrevivieron a la extinción masiva del final del Mesozoico. La sangre caliente, que es la característica más notable que comparten con los mamíferos, es resultado de evolución convergente, pues no existió un ancestro común a ambos grupos que tuviera este rasgo. Su evolución dio lugar, tras una fuerte radiación, a las más de diez mil especies actuales[4][5] (más 153 extintas en tiempos históricos).[5] Las aves son los tetrápodos más diversos; sin embargo, tienen una gran homogeneidad morfológica en comparación con los mamíferos. Las relaciones de parentesco de las familias de aves no siempre pueden definirse por morfología, pero con el análisis de ADN han empezado a esclarecerse.
Las aves habitan en todos los ecosistemas terrestres, en los acuáticos continentales, y algunas están adaptadas a alimentarse en la superficie marina. Su tamaño puede ser desde 6,4 cm en el colibrí zunzuncito hasta 2,74 metros en el avestruz. Los comportamientos son diversos y notables, como en la anidación, los cuidados parentales, las migraciones, el apareamiento y la tendencia a la asociación en grupos. La comunicación entre las aves es variable y puede implicar señales visuales, llamadas y cantos. Algunas emiten gran diversidad de sonidos.
El ser humano ha tenido una intensa relación con las aves. En la economía humana las aves de corral y las cinegéticas son fuentes de alimento. Las canoras y los loros son populares como mascotas. Se usa el plumón de patos y gansos domésticos para rellenar almohadas y se cazaban muchas aves para adornar sombreros con sus plumas. El guano de las aves se usa en la fertilización de suelos. Algunas aves son reverenciadas o repudiadas por motivos religiosos, supersticiones o por prejuicios erróneos. Muchas son símbolos culturales y referencia frecuente para el arte. En los últimos quinientos años se han extinguido más de ciento cincuenta especies como consecuencia de actividades humanas[6] y, hasta el año 2023 son más de mil trescientas las especies de aves amenazadas que necesitan esfuerzos para su conservación.[7]
La especialidad de la zoología que estudia específicamente a las aves se denomina ornitología.


Las evidencias fósiles y los numerosos análisis biológicos han demostrado que las aves son dinosaurios terópodos.[8] Más específicamente, son miembros de Maniraptora, un grupo de terópodos que incluye también, entre otros, a dromeosaurios y oviraptóridos.[9] A medida que los científicos han descubierto más terópodos no-avianos que están cercanamente relacionados con las aves, la distinción antes clara entre no-aves y aves se ha vuelto borrosa. Los recientes descubrimientos en la provincia de Liaoning del noreste de China demuestran que muchos pequeños dinosaurios terópodos tenían plumas, lo que contribuye a esta ambigüedad de límites.[10]
La visión del consenso en la paleontología contemporánea es que las aves son el grupo más cercano a los deinonicosaurios, que incluyen a dromeosáuridos y troodóntidos. Juntas, estas tres forman el grupo Paraves. El dromeosaurio basal Microraptor tiene características que pueden haberle permitido planear o volar. Los deinonicosaurios más basales eran muy pequeños. Esta evidencia eleva la posibilidad de que el ancestro de todos los paravianos pudiera haber sido arbóreo, o pudiera haber sido capaz de planear.[11][12] Archaeopteryx, del Jurásico Superior, es muy conocido como uno de los primeros fósiles transicionales encontrados y aportó apoyo a la teoría de la evolución a finales del siglo XIX. Archaeopteryx tiene caracteres claramente reptilianos: dientes, dedos de la mano con garras y una larga cola similar a la de los lagartos, pero tiene alas finamente preservadas con plumas de vuelo idénticas a las de las aves modernas. No se considera un ancestro directo de las aves modernas, pero sí el más antiguo y primitivo miembro de Aves o Avialae, y está probablemente muy cercano al ancestro real. Sin embargo, contradiciendo lo anterior, se ha sugerido por otros autores que Archaeopteryx fue un dinosaurio que no era más cercano a Aves de lo que fueran otros grupos de dinosaurios,[13] y que Avimimus es un ancestro más plausible de todas las aves que Archaeopteryx.[14]
Han existido algunas controversias con respecto al origen de las aves. Una de las primeras se encontraba relacionada con el posible origen de las aves a partir de arcosaurios y no de dinosaurios (estos descienden de los primeros). El consenso académico no toma en serio estas ideas, y a partir de nuevos descubrimientos y estudios, se ha cimentado como hecho científico el origen de las aves a partir de dinosaurios no avianos.[15][16]
Los dinosaurios ornitisquios —que en griego significa «con cadera de ave»— compartían con las aves modernas la estructura de la cadera. Sin embargo, las aves se originaron a partir de los dinosaurios saurisquios —gr. «con cadera de lagarto»—, y por lo tanto sus caderas evolucionaron independientemente.[17] De hecho, una estructura de cadera aviana evolucionó en una tercera ocasión entre un grupo de terópodos peculiares conocidos como Therizinosauridae.
Las aves se diversificaron en una amplia variedad de formas durante el periodo Cretácico.[18] Muchos grupos retuvieron sus características primitivas, como alas con garras, y dientes, aunque los dientes se perdieron de forma independiente en algunos grupos de aves, incluidas las aves modernas. Mientras las formas más primitivas, como Jeholornis, retuvieron la cola larga ósea de sus ancestros,[18] las colas de las aves más avanzadas se acortaron con la aparición del hueso pigóstilo en el clado Pygostylia.
El primer linaje grande y diverso de aves de cola corta que evolucionó fue Enantiornithes (significa «aves opuestas»), llamado así porque la construcción de sus huesos del hombro estaba invertida respecto a la de las aves modernas. Enantiornithes ocupó un amplio espectro de nichos ecológicos, desde sondeadoras en la arena, como las limícolas, y comedoras de pescado, hasta las formas arborícolas y comedoras de semillas.[18] Otros linajes más avanzados se especializaron también en comer pescado, como la subclase Ichthyornithes («aves-pez») con apariencia de gaviota.[19]
Un orden de aves marinas del Mesozoico, Hesperornithiformes, se adaptó tan bien a la pesca en ambientes marinos que sus miembros perdieron la capacidad de volar y se hicieron primariamente acuáticos. A pesar de su especialización extrema, Hesperornithiformes incluye los parientes más cercanos de las aves modernas.[18]
| Aves |
| ||||||||||||||||||||||||
Los linajes basales de aves modernas (subclase Neornithes) se originaron al comienzo del Cretácico Superior, hace unos 90 millones de años, según estimaciones filogenéticas usando relojes moleculares.[20]Pero existen muy pocos fósiles que confirman la existencia de aves modernas en el Cretácico. Uno de ellos es Vegavis,[21] Las aves modernas se dividen en dos infraclases: Palaeognathae y Neognathae. En Palaeognathae se incluyen Tinamiformes y las ratites. Los Neognathae a su vez se dividen en dos clados, Galloanserae (patos, gallos y formas afines) y Neoaves (el resto de las aves modernas), que se originaron hace unos 80 millones de años.[20]No existe acuerdo sobre cuándo ocurrió la división múltiple de las demás neognatas, o clado Neoaves, si antes o después del límite Cretácico-Terciario, cuando desaparecieron los demás dinosaurios.[22]Este desacuerdo se debe en parte a la ambigüedad en las evidencias. La datación molecular sugiere que la radiación comenzó en el Cretácico,[22][23]mientras que los fósiles de Neoaves no aparecen sino entrado el Terciario.[24] Sin embargo, las dataciones moleculares más recientes sugieren que la radiación principal de Neoaves fue contemporánea con el evento de extinción masiva, que junto a lo fragmentario del registro fósil en este período, podría reconciliar las dos perspectivas.[20]De cualquier manera, es claro que la aves modernas experimentaron una gran radiación adaptativa a comienzos del Terciario y para el final del Mioceno ya existían la mayoría de los géneros de aves actuales. Las aves modernas sufrieron un evento importante de extinción al final del Pleistoceno, cuando se estima entre 1 300 and 1500 especies de aves se extinguieron debido a cambios climáticos y la actividad humana.[25] El número de especies de aves vivientes se establece entre unas 9800[5] y 10 050.[26] Se estima que cuando se termine la caracterización por secuenciación de ADN de todas las aves podrán identificarse numerosas nuevas especies mediante identificación de formas crípticas dentro de especies reconocidas basándose en las diferencias de ADN.[27]

La facultad de vuelo fue decisiva en la extraordinaria diversificación de las especies de aves respecto a otros tetrápodos (lo mismo ocurrió con los insectos respecto a los demás artrópodos o con los murciélagos respecto al resto de mamíferos). La llegada casual de algunos individuos a un territorio geográficamente aislado puede ser el origen de una nueva población que en el transcurso del tiempo acumule diferencias genéticas respecto a la población madre originaria, por azar o por adaptación a nuevos ambientes mediante la acción de la selección natural. Algunas islas han desarrollado avifaunas diferenciadas por vicarianza a partir de especies colonizadoras, o diversificadas a partir de pocas especies que se adaptaron por radiación a la explotación de distintos nichos ecológicos sin los competidores y predadores habituales de sus territorios de origen.[27] Este es el caso de los pinzones de Darwin,[28] en las Galápagos, de los mieleros hawaianos[29] o de las vangas en Madagascar.[30] La diferenciación evolutiva de nuevas especies de aves no se detiene, y puede, en ocasiones, ocurrir en tiempo relativamente breve, como se comprueba en las islas volcánicas de corta historia geológica.
Las aves junto con los reptiles y mamíferos se clasifican en un clado llamado Amniota, actualmente corroborado por los análisis genéticos y su desarrollo embrionario. De acuerdo con las evidencias fósiles las aves evolucionaron de dinosaurios terópodos durante el Jurásico, lo cual indica que las aves son un grupo de dinosaurios vivos que alcanzaron un gran éxito evolutivo. Este escenario también esta respaldado por las secuencias proteicas obtenidas de Tyrannosaurus rex y Brachylophosaurus canadensis. Sus parientes más cercanos vivientes son los cocodrilos (orden Crocodilia) con quienes conforman el clado Archosauria, el cual no solo esta respaldado molecularmente sino también morfológicamente.[31]
Los estudios genéticos revelan las siguientes relaciones filogenéticas para las aves con respecto a otros tetrápodos vivos (incluyendo las secuencias proteicas obtenidas de Tyrannosaurus rex y Brachylophosaurus canadensis). Puede notarse que las aves se agrupan en lo profundo del árbol reptiliano:[32][33][34][35][36][37]
| Tetrápoda |
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La primera clasificación científica de las aves se debe a Francis Willughby y John Ray en su libro Ornithologiae, publicado en 1676.[38] Carlos Linneo modificó aquel trabajo en 1758 para crear la clasificación taxonómica aún en uso.[39] Las aves están categorizadas como una clase homónima en la Taxonomía de Linneo. En la taxonomía filogenética, las aves se ubican en el clado Theropoda (dinosaurios carnívoros bípedos).[40]
El establecimiento del origen dinosauriano del clado Aves ha tenido como consecuencia su clasificación filogenética con anidación sucesiva dentro de los siguientes clados:
| Rango del clado | Nombre del clado |
|---|---|
| (Mundo) | Biota |
| Sin rango | Cytota |
| Sin rango | Neomura |
| Sin rango | Proteoarchaeota |
| Sin rango | Eukaryomorpha |
| Dominio | Eukaryota |
| Sin rango | Opimoda |
| Sin rango | Podiata |
| Sin rango | Amorphea |
| Sin rango | Obazoa |
| Sin rango | Opisthokonta |
| Sin rango | Holozoa |
| Sin rango | Filozoa |
| Sin rango | Apoikozoa |
| Reino | Animalia |
| Subreino | Eumetazoa |
| Sin rango | ParaHoxozoa |
| Sin rango | Bilateria |
| Superfilo | Deuterostomia |
| Filo | Chordata |
| Subfilo | Vertebrata |
| Infrafilo | Gnathostomata |
| Sin rango | Eugnathostomata |
| Sin rango | Teleostomi |
| Sin rango | Osteichthyes |
| Clase | Sarcopterygii |
| Sin rango | Rhipidistia |
| Sin rango | Tetrapodomorpha |
| Sin rango | Eotetrapodiformes |
| Sin rango | Elpistostegalia |
| Sin rango | Stegocephalia |
| Superclase | Tetrápoda |
| Sin rango | Reptiliomorpha |
| Sin rango | Amniota |
| Clase | Sauropsida |
| Sin rango | Eureptilia |
| Sin rango | Romeriida |
| Subclase | Diapsida |
| Sin rango | Neodiapsida |
| Sin rango | Sauria |
| Sin rango | Archelosauria |
| Infraclase | Archosauromorpha |
| Sin rango | Crocopoda |
| Sin rango | Archosauriformes |
| Sin rango | Eucrocopoda |
| Sin rango | Archosauria |
| Sin rango | Avemetatarsalia |
| Sin rango | Ornithodira |
| Sin rango | Dinosauromorpha |
| Sin rango | Dinosauriformes |
| Sin rango | Dracohors |
| Superorden | Dinosauria |
| Orden | Saurischia |
| Sin rango | Theropoda |
| Sin rango | Eutheropoda |
| Sin rango | Averostra |
| Sin rango | Tetanurae |
| Sin rango | Orionides |
| Sin rango | Tetanurae |
| Sin rango | Avetheropoda |
| Sin rango | Coelurosauria |
| Sin rango | Tetanurae |
| Sin rango | Tyrannoraptora |
| Sin rango | Maniraptoromorpha |
| Sin rango | Maniraptoriformes |
| Sin rango | Maniraptora |
| Sin rango | Pennaraptora |
| Sin rango | Paraves |
| Sin rango | Eumaniraptora |
| Sin rango | Avialae |
| Clase | Aves |
Las aves, junto a su orden hermano (Crocodilia), representan los únicos sobrevivientes del clado reptiliano Archosauria. Filogenéticamente, el clado Aves se define comúnmente como todos los descendientes del ancestro común más reciente de las aves modernas y de Archaeopteryx lithographica.[41] Archaeopteryx, perteneciente al Jurásico Superior (entre 156-150 millones de años), es el animal más antiguo hasta ahora conocido que se clasifica como un ave. Otros autores han definido Aves para agrupar solamente a las modernas (Neornithes), excluyendo a las aves antiguas con dientes, como Archaeopteryx, Enantiornithes y Hesperornithiformes[42] en parte para evitar las incertidumbres sobre la ubicación de Archaeopteryx en relación con los animales tradicionalmente conocidos como dinosaurios terópodos.[43][44][45]
Filogenia de aves modernas según Yuri, T. et al. (2013).[46]
| Aves |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
La clasificación de las aves es un asunto disputado. Como resumen Livezey y Zusi,[40] en 20 años desde 1988, han sido numerosas y divergentes las filogenias de Aves propuestas. Han estado basadas en metodologías diversas y aplicadas con amplitudes dispares, que generalmente han usado alternativamente morfología, secuencias de ADN mitocondrial o de ADN nuclear; con y sin análisis cladísticos. Sin embargo, se han producido resultados discordantes incluso cuando los estudios se han basado en metodologías de un mismo tipo.[40] Estos estudios dejan un panorama contradictorio en el que los resultados están en constante fluidez y no hay ninguna versión de filogenia ampliamente aceptada, por lo que no es posible dar aquí una filogenia más o menos definitiva. La situación parece en vías de solución con los nuevos descubrimientos de fósiles que están permitiendo estudios más refinados basados en morfología,[40] con el perfeccionamiento de los métodos estadísticos, con la expansión de las evidencias moleculares por el aumento de los loci analizados y con la aplicación de estos métodos a más amplias representaciones de grupos taxonómicos.[40][66] Con estas progresivas mejoras se considera cuestión de poco tiempo que se alcancen resultados que logren un consenso de la comunidad científica sobre la evolución de los órdenes y familias de aves modernas. Estos resultados quizás puedan ser acelerados con estudios basados en «evidencia total», con el análisis combinado de todas las fuentes de evidencia.[40]
La clasificación filogenética de los grupos de aves modernas que a continuación se presenta, se basa en un estudio de las secuencias de ADN de Hackett y colaboradores (2008),[66] realizado mediante el examen de cerca de 32 kilobases de secuencias alineadas provenientes de 19 loci independientes de ADN nuclear en 169 especies de aves, que representan a todos los grupos mayores existentes. En ella se confirma la monofilia de Galloanserae y Neoaves. Se refuerza, a su vez, la existencia de diversos clados propuestos a lo largo de los últimos años dentro de Neoaves, aunque las relaciones entre la gran mayoría aún están indeterminadas, lo cual genera una serie de politomías. Hackett y colaboradores consolidan en gran medida los estudios de Fain & Houde (2004) y Ericson et ál. (2006), y se destaca en todos ellos la división de Neoaves en dos ramas: Metaves y Coronaves.[67][68] Aunque esta división se basa en un único gen (beta-fibrinógeno) y, además, se contrapone con los resultados obtenidos a partir de estudios del ADN mitocondrial.[69] La validez de Metaves y Coronaves dependerá de futuros estudios. A continuación se definen nuevos clados (identificados solo con letras) y se señala el carácter parafilético de algunos grupos (que deben ser redefinidos). Véase la lista de familias de aves para más detalles dentro de los órdenes.
| Neornithes |
| ||||||||||||||||||||||||
Subclase Neornithes
Existen filogenias de aves muy diferentes, como la filogenia de Livezey y Zusi (2007) basada en un análisis cladístico de datos morfológicos también muy amplio,[40] o la de la clasificación tradicional (llamada de Clements),[5] o la de Sibley y Monroe (Taxonomía de Sibley-Ahlquist),[70] basada en datos de hibridación del ADN, que tuvo amplia aceptación en unos pocos aspectos, como por ejemplo la aceptación de Galloanserae.

Las aves viven y crían en la mayoría de los hábitats terrestres. Están presentes en todos los continentes, incluso en el territorio antártico, donde anidan las colonias de petreles níveos, las aves más australes.[72]La mayor diversidad de aves se da en las regiones tropicales, y el país con el mayor número de especies en el mundo es Colombia,[73][74] seguido por Perú y Brasil. Otras avifaunas notables por su cantidad de endemismos son las de Nueva Zelanda,[75] Madagascar[76] y Australia, las cuales, a diferencia de las de países sudamericanos, cuentan además con un considerable número de taxones superiores endémicos.[77][78] La región biogeográfica con mayor número de especies, con unas 3700 (más de la tercera parte mundial), es el Neotrópico (que incluye América del Sur, América Central, tierras bajas de México y las Antillas). Además, 31 familias son endémicas del Neotrópico, más del doble que en cualquier otra región biogeográfica.[27]
Tradicionalmente se ha considerado que la alta diversidad tropical era resultado de unas mayores tasas de especiación; sin embargo, estudios recientes descubrieron que en las altas latitudes hay mayores tasas de especiación que son compensadas por tasas de extinción más altas.[79] Numerosas familias de aves se han adaptado a vivir en el mar; algunas especies de aves marinas solo recalan en tierra para criar,[80] y se sabe que algunos pingüinos llegan a bucear hasta a 300 m de profundidad.[81]
Muchas especies de aves se han establecido en regiones donde han sido introducidas por el hombre. Algunas de estas introducciones han sido deliberadas; el faisán común, por ejemplo, ha sido introducido como especie para la caza en buena parte del mundo.[82] Otras introducciones han sido accidentales; este es el caso de varias especies de loros, como la cotorra argentina que a partir de ejemplares cautivos escapados se ha establecido en numerosas ciudades de Norteamérica,[83] Sudamérica y Europa.[84] Algunas especies, como la garcilla bueyera,[85] el chimachimá,[86] o la cacatúa galah,[87] se han introducido de forma natural en regiones fuera de sus áreas de distribución original gracias a que la agricultura ha creado ecosistemas adecuados para ellas.


La anatomía de las aves presenta un plan corporal que exhibe un gran número de adaptaciones inusuales en comparación con otros vertebrados, en su mayor parte para facilitar el vuelo.
El esqueleto está formado por huesos huecos, pero de estructura resistente, lo que les confiere ligereza. Estas cavidades óseas están llenas de aire y conectan con el aparato respiratorio.[88] Los huesos del cráneo están fusionados, sin presentar suturas craneales.[89] Las órbitas son grandes y separadas por un septo óseo. La columna vertebral de las aves presenta un gran contraste entre las zonas superiores y las inferiores. El número de vértebras cervicales es muy variable, aunque siempre numeroso y el cuello es especialmente flexible, pero en las vértebras torácicas anteriores la movilidad es reducida, y en todas las posteriores la movilidad es nula, dado que están fusionadas.[90] Las pocas vértebras posteriores están fusionadas con la pelvis para formar el sinsacro.[89] Las costillas son aplastadas y el esternón es aquillado para el anclaje de los músculos del vuelo, excepto en los órdenes de aves terrestres no voladoras. Las extremidades anteriores están modificadas en forma de alas.[91]
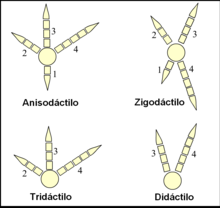
Los pies de las aves están clasificados según la disposición de sus dedos en anisodáctilos, zigodáctilos, heterodáctilos, sindáctilos y pamprodáctilos.[92] La mayor parte de las aves tienen cuatro dedos (aunque hay muchas especies tridáctilas y algunas didáctilas) que se organizan en torno a un ancho y fuerte metatarso.[93]
Como los reptiles, las aves son primariamente uricotélicos, es decir, sus riñones extraen desechos nitrogenados de su sangre y los excretan como ácido úrico, en vez de urea o amoníaco, a través de los uréteres hacia el intestino. Las aves no tienen vejiga urinaria o apertura urétrica externa y el ácido úrico se excreta junto con las heces como desperdicio semisólido.[94][95] Sin embargo, aves como los colibríes pueden ser facultativamente amoniotélicos, al excretar la mayor parte de los desechos nitrogenados en forma de amoníaco.[96] Las razones de esto son diversas y no están del todo claras, aunque sus dietas basadas en el néctar, por lo tanto con grandes aportes de agua, juegan un papel clave. También se debe a que sus metabolismos requieren poco nitrógeno, y a las bajas ingestiones de proteínas y sal. Cuando estas condiciones cambian, se reduce la ingesta de néctar o suben las proteínas y sales obtenidas, estas aves pueden pasar a ser uricotélicas.[97][98] Pueden excretar también creatina, en vez de creatinina como los mamíferos.[89] Esta materia, así como la fecal de los intestinos, es expulsada a través de la cloaca del ave.[99][100] La cloaca es una abertura multifuncional: por ella se expulsan los desechos, las aves se aparean juntando sus cloacas y las hembras ponen huevos a través de ella. Adicionalmente muchas especies regurgitan egagrópilas.[101]
El aparato digestivo de las aves es único, con un buche para almacenamiento de lo ingerido y una molleja que contiene piedras que el ave ha tragado y que sirven para triturar el alimento para compensar la ausencia de dientes.[102] La mayoría de las aves están adaptadas a una rápida digestión para ayudar al vuelo.[103] Algunas aves migratorias se han adaptado a usar proteínas de muchas partes del cuerpo, incluidas proteínas de los intestinos, como fuente adicional de energía durante la migración.[104]
Las aves son animales homeotérmicos, es decir, que la temperatura interna se mantiene regulada, por encima de la temperatura exterior, lo que les permite tener un elevado metabolismo; el plumaje participa en su regulación. La temperatura media interna de las aves adultas es bastante alta, en general entre 40 y 43 °C, con variaciones entre especies. Algunas Apodiformes tienen temperaturas nocturnas notablemente menores. Ciertas aves, como los reyezuelos, cuando son recién nacidos mantienen la temperatura ambiental (poiquilotermia), y adquieren la capacidad de regularla pocos días después.[105]
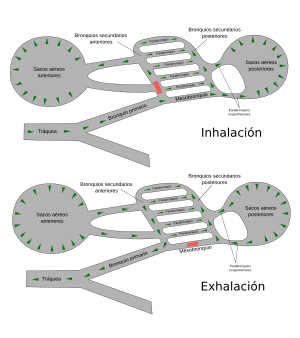
Las aves tienen uno de los aparatos respiratorios más complejos del reino animal.[89] Tras la inhalación, el 75 % del aire fresco pasa de largo de los pulmones y fluye directo a los sacos aéreos posteriores, que se extienden desde los pulmones y conectan con los espacios en los huesos, y los llenan con aire. El otro 25 % del aire va directamente a los pulmones. Cuando el ave exhala, el aire usado fluye fuera de los pulmones y el aire almacenado de los sacos aéreos posteriores es simultáneamente forzado a entrar en los pulmones. De este modo los pulmones de un ave reciben un suministro constante de aire fresco tanto en la inhalación como en la exhalación.[106] La producción de sonidos se logra usando la siringe, una cámara muscular con varias membranas timpánicas que está situada en el extremo inferior de la tráquea, desde la cual se separa.[107]

El corazón de las aves tiene cuatro cámaras separadas (dos aurículas y dos ventrículos) y es el arco aórtico derecho el que da lugar a la circulación sistémica (al contrario que en los mamíferos, en los que el involucrado es el arco aórtico izquierdo).[89] La vena cava inferior (única) recibe sangre de las patas por vía del sistema porta renal (muy reducido). La mayor parte de esta sangre proveniente de la cintura pélvica y la cola, llega al corazón sin pasar por los capilares renales. Los glóbulos rojos tienen núcleo, a diferencia de los mamíferos, y son ovales y biconvexos.[108]
El sistema nervioso es grande en relación con el tamaño del ave.[89] La parte más desarrollada del encéfalo es la que controla las funciones relacionadas con el vuelo, mientras el cerebelo coordina el movimiento, y los hemisferios cerebrales controlan patrones de comportamiento, la orientación, el apareamiento y la construcción del nido.
Unas pocas especies son capaces de usar defensas químicas contra sus depredadores. Algunos Procellariiformes pueden expulsar aceites repulsivos contra sus atacantes,[109] y algunas especies en el género Pitohui de Nueva Guinea tienen una potente neurotoxina en su piel y plumas.[110]
Los sentidos de las aves no deberían diferir básicamente de los mamíferos, pero para algunos de ellos quedan incógnitas: no se sabía muy bien, por ejemplo, cómo logran orientarse en sus migraciones. Estudios más recientes confirma la presencia de magnetita en el cráneo de las aves, mineral que ayuda a la orientación ya que funciona como una brújula.

El sistema visual de las aves suele estar altamente desarrollado. Las rapaces en especial tienen una gran agudeza visual, dos o tres veces mejor que la del ser humano.[111] La fóvea de una especie del género Buteo posee alrededor de 100 000 conos por mm², frente a los 20 000 en el hombre,[112] cinco veces más. Los ojos de las aves son muy voluminosos. Por ejemplo, los del estornino tienen un volumen correspondiente a 15 % del volumen craneal (como comparación, en el hombre representan el 1 % de dicho volumen).[112] Las aves acuáticas tienen lentes flexibles especiales, lo que les permite la acomodación para la visión en el aire y en el agua.[89] Algunas especies tienen fóveas duales (por ejemplo: golondrinas, charranes, martinetes, halcones, colibríes, etc.).[112] Las aves nocturnas tienen generalmente un campo visual restringido, pero una gran movilidad de la cabeza (que a veces puede girar más de 250°).[112] Las aves son tetracromáticas, al poseer en la retina conos sensibles al ultravioleta, además de las sensibles a verde, rojo y azul.[111][113] Esto les permite percibir la luz ultravioleta, la cual está involucrada en el cortejo. Muchas aves muestran patrones ultravioleta en los plumajes que son invisibles al ojo humano. Algunas aves cuyos sexos parecen similares a simple vista se pueden distinguir con visión ultravioleta por ciertas manchas en sus plumas que reflejan esa luz. Los machos de herrerillo europeo tienen un parche en la coronilla que refleja el ultravioleta que es mostrado en el cortejo cambiando la postura y erizando las plumas de la nuca.[114] La luz ultravioleta se usa en la detección del alimento; se ha observado que los cernícalos buscan la presa por medio de la detección de los rastros de orina, que reflejan el ultravioleta, dejados en el suelo por los roedores.[115] Los párpados de un ave no se usan para pestañear. En vez de eso, el ojo es lubricado por la membrana nictitante, un tercer párpado que se mueve horizontalmente.[116] La membrana nictitante también cubre el ojo y actúa como una lente de contacto en muchas aves acuáticas.[89] La retina de las aves tiene un sistema de suministro de sangre en forma de abanico llamado pecten.[89] La mayoría de las aves no pueden mover sus ojos, aunque hay excepciones, como el cormorán grande.[117] Las aves con ojos a los lados de la cabeza tienen un amplio campo visual, mientras que las que tienen los ojos en el frente, como los búhos, tienen visión binocular y pueden estimar mejor la profundidad del campo visual.[118]
La mayoría de las aves tienen un pobre sentido del olfato, pero hay excepciones notables como los kiwis,[119] las aves carroñeras americanas,[112][120] y los albatros y petreles.[121] Se ha comprobado que estos últimos son capaces de localizar a sus presas, en particular el aceite de pescado, por el olfato.[122][123]
El oído de las aves está bien desarrollado; aunque carece de pabellón auricular, está cubierto por plumas, y en algunas, como en los géneros de búhos Asio, Bubo y Otus, forman penachos que parecen orejas. Ciertas especies de búho pueden localizar una presa en completa oscuridad solo con la audición.[111] Sin embargo la ausencia de orejas les obliga a realizar rotaciones de la cabeza para percibir los sonidos provenientes de diferentes direcciones. Las salanganas y el guácharo de las cavernas son capaces de desplazarse en la oscuridad gracias a que sus oídos están adaptados a la ecolocalización. Al contrario que los mamíferos, el oído medio de las aves tiene un solo huesecillo, la columela. En el oído interno, la cóclea no es espiralada sino recta, al contrario que en los mamíferos.[112][124]
Las papilas gustativas no se encuentran en el extremo de la lengua sino en el fondo y en la garganta; además son poco numerosas (200 en una Anatinae, frente a las 9000 en el hombre), pero otros mecanismos pueden ser accionados para la degustación, como el sentido del tacto (notable a nivel del pico) que, en muchas aves, parece intervenir durante la búsqueda de alimento. En el sentido del tacto intervienen diversos corpúsculos: los corpúsculos encapsulados de Merkel (en la piel y en el interior de la boca) y los de Grandry (en el paladar) participan en la sensibilidad táctil general; estos serían los correspondientes al corpúsculos de Meissner en los mamíferos.[125]
Los corpúsculos de Herbst (que corresponden a los corpúsculos de Pacini de los mamíferos[125]) son preferentemente sensibles a las vibraciones; son particularmente numerosos en el pico y las patas, particularmente en las especies que deben encontrar su alimento «a tientas»: lengua en Picidae, pico en Anatidae y en numerosos Scolopacidae, pero también en los rebordes coloreados que bordean los picos de las crías de numerosos paseriformes y Picinae.[112]
Las aves poseen varios órganos de equilibrio independientes; el oído interno, como en los mamíferos, y un órgano situado en la pelvis.
Uno de los sentidos más misteriosos es la detección del campo magnético terrestre; el órgano que lo detecta se sitúa en el pico o cerca de los ojos.[111] La existencia de este sentido fue demostrada experimentalmente por primera vez en 1967 por Wolfgang Wiltschko en los petirrojos europeos.[126]
El sexo en las aves se determina por cromosomas sexuales, denominados Z y W. Las hembras son heterogaméticas y los machos homogaméticos. Esto significa que la hembra tiene sus cromosomas sexuales diferentes (ZW) y produce dos tipos de óvulos, lo que determina el sexo del futuro cigoto. En el macho, en cambio, sus cromosomas sexuales son idénticos (ZZ) y sus espermatozoides, todos portadores de cromosoma Z, no determinan el sexo de la descendencia. Al contrario de lo que ocurre en los mamíferos, donde los cromosomas sexuales, llamados en este caso X e Y, son diferentes en el macho (XY) y similares en la hembra (XX).[89]
En todas las especies de aves el sexo del individuo se determina en la fertilización. Sin embargo un estudio reciente ha demostrado que en el caso de los talégalos cabecirrojos la temperatura durante la incubación influye en la proporción de sexos en la descendencia; a mayores temperaturas, más cantidad de hembras y viceversa;[127] pero esto no se debe a que la temperatura altere los mecanismos genéticos de determinación del sexo, sino a que con temperaturas extremas de incubación, el desarrollo y mortalidad de los pollos es diferente según su sexo: a altas temperaturas los machos se desarrollan peor y mueren más, y a bajas temperaturas le ocurre lo mismo a las hembras.[128]

A diferencia de la piel de los mamíferos, la de las aves es delgada y seca y no posee glándulas sudoríparas; de hecho, la única glándula cutánea de las aves es la glándula uropígea, situada en la base de la cola, que secreta grasa que el ave esparce por su plumaje con el pico; dicha glándula está especialmente desarrollada en las aves acuáticas, con lo que consiguen una mayor impermeabilización.[129]
Las plumas son una característica única de las aves. Les permiten volar, proporcionan aislamiento térmico al impedir la circulación del aire que ayuda en la termorregulación, y son usadas para la exhibición, camuflaje, e identificación.[89] Hay varios tipos de plumas, y cada una tiene unas funciones y características determinadas: las plumas de vuelo o rémiges (primarias, secundarias y terciarias); las rectrices (plumas de la cola, que sirven como timón en el vuelo); las coberteras (que cubren parcialmente las rémiges y también las rectrices); las tectrices (que cubren todo el cuerpo y lo protegen frente a agentes adversos) y el plumón (que evita la pérdida de calor).[93] Las plumas son formaciones epidérmicas de queratina unidas a la piel y surgen solo en series específicas de la piel llamadas pterilos. El patrón de distribución de estas series de plumas (pterilosis) se usa en taxonomía y sistemática. El ordenamiento y el aspecto de las plumas en el cuerpo, llamado plumaje, puede variar dentro de la especie por edad, posición social,[130] y sexo.[131]

El plumaje es mudado regularmente. El plumaje característico de un ave que ha mudado tras la reproducción se conoce como plumaje post-reproductivo, o en la terminología Humphrey-Parkes plumaje «básico». Los plumajes reproductivos o las variaciones del plumaje básico se conocen en el sistema Humphrey-Parkes como plumajes «alternativos».[132] La muda es anual en la mayoría de las especies, aunque algunas pueden tener dos mudas al año, y las grandes aves de presa pueden mudar solo una vez cada pocos años. Los patrones de muda varían entre especies. En los paseriformes, las plumas de vuelo son reemplazadas de una en una iniciando el ciclo con la primaria más interna. Cuando la quinta de las seis primarias es mudada, la terciaria más externa comienza a desprenderse. Después que las terciarias más internas son mudadas, las secundarias comienzan a mudarse desde la más interna y esto prosigue hasta las plumas más externas (muda centrífuga). Las coberteras primarias mayores se mudan sincrónicamente con las primarias con las que se superponen.[133] Un pequeño número de especies, como los patos y gansos, pierden todas las plumas de vuelo a la vez, y quedan temporalmente sin capacidad de volar.[134] Como regla general, las plumas de la cola se mudan y reemplazan comenzando desde el par más interior;[133] sin embargo, se observan mudas centrípetas de plumas de la cola en Phasianidae.[135] La muda centrífuga es diferente en las plumas de la cola de los pájaros carpinteros y los trepatroncos en los que comienza por el segundo par de plumas más internas y termina con el par central, de modo que el ave mantiene la capacidad de ayudarse con su cola para trepar.[133][136] El patrón general que se ve en paseriformes es que las primarias son reemplazadas hacia afuera, las secundarias hacia adentro, y la cola desde el centro hacia afuera.[137]
Antes de anidar, en las hembras de la mayoría de las especies de aves se produce lo que se llama una placa de incubación, es decir, una zona libre de plumas cerca del abdomen. La piel está allí bien irrigada con vasos sanguíneos y ayuda al ave en la incubación.[138]

Las plumas requieren mantenimiento y las aves las acicalan o peinan diariamente, tomándose en promedio un 9 % de su tiempo diario en ello.[139] El pico se usa para extraer partículas extrañas y para aplicar secreciones cerosas provenientes de la glándula uropigial. Estas secreciones protegen la flexibilidad de la pluma y actúan como agente antimicrobiano, inhibiendo el crecimiento de bacterias degradadoras de la pluma.[140] Esto puede complementarse con secreciones de ácido fórmico de las hormigas, que reciben mediante un comportamiento conocido como «baño de hormigas», para quitarse los parásitos de las plumas.[141]
Las escamas de las aves se componen de la misma queratina que las plumas, el pico, las garras y espolones. Se encuentran principalmente en los dedos del pie y en el metatarso, pero pueden encontrarse más arriba hasta el talón en algunas aves. La mayoría de las escamas de las aves no se superponen significativamente, excepto en los casos de los martines pescadores y los carpinteros. Se piensa que las escamas de las aves son homólogas a las de los reptiles y mamíferos.[142]

La mayor parte de las aves pueden volar, lo que las distingue de casi todo el resto de vertebrados. Volar es el principal modo de locomoción para la mayoría de las aves y lo usan para reproducirse, alimentarse y huir de sus depredadores. Para volar, las aves han desarrollado diversas adaptaciones fisionómicas que incluyen un esqueleto ligero, dos grandes músculos de vuelo (el pectoral que es el 15 % de la masa total del ave, y el supracoracoideo), y dos miembros modificados (alas) que sirven como perfiles alares.[89] La forma y el tamaño de las alas determinan el tipo de vuelo de cada ave; muchas especies combinan un estilo de vuelo basado en fuertes aleteos, con un vuelo de planeo que requiere menos energía. La altitud de vuelo de las aves presenta un rango enorme, pues varía desde el nivel del mar hasta por encima de los 11 000 m.[143][144]
Alrededor de 60 especies de aves son no voladoras, también un buen número de especies extintas carecían de la capacidad de volar.[145] Las aves no voladoras a menudo se encuentran en islas aisladas, probablemente debido a una escasez de recursos y a la ausencia de depredadores terrestres.[146] A pesar de que no pueden volar, los pingüinos usan una musculatura y unos movimientos similares para volar a través del agua; así lo hacen también los álcidos, las pardelas y los mirlos acuáticos.[147]
En cuanto a por qué muchas aves vuelan en formación en "V" cuando lo hacen en grupo, esto es para beneficiarse de la eficiencia energética al aprovechar el vuelo en estela y facilitar la navegación durante las migraciones. Cuando un ave vuela, crea un flujo de aire ascendente detrás de sus alas. Al volar detrás de otra ave en formación en "V", las aves siguientes pueden posicionarse de manera que aprovechen este flujo ascendente, lo que les permite reducir la resistencia aerodinámica y ahorrar energía.[148]

La menor de las aves es el macho del colibrí zunzuncito de unos 64 mm de largo,[149] y 2,8 g,[105] y envergadura alar de unos 78 mm.[150] El ave actual más grande es el avestruz con una altura de hasta 2,74 metros y 155 kg de peso, pone también los huevos más grandes, con promedios de 15 por 13 cm y un peso de 1,4 kg.[151] Las aves más altas que hayan existido y de las cuales se tengan registros eran las moas gigantes que medían hasta 3,6 m, pesaban más de 230 kg y habitaban en Nueva Zelanda hasta, al menos, el siglo XVI.[152][153] El ave más pesada que haya coexistido con el hombre es la extinta ave elefante de Madagascar, que llegaba a medir hasta tres metros de altura y unos 500 kg de peso.[154] De dimensiones similares era Dromornis stirtoni de Australia.[155]
Los albatros viajeros poseen la mayor envergadura alar de todos los animales voladores actuales, pueden exceder los 340 cm, con peso de más de 10 kg.[156][157] La gigantesca ave fósil Argentavis magnificens es la mayor ave voladora que se ha descubierto; se estima que su envergadura era de más de 5,8 metros y un peso de 60–80 kg.[157] Son varias las especies actuales de aves voladoras consideradas como las más pesadas, las cuales no suelen superar los 20 kg, entre ellas la avutarda común y la avutarda kori.[158] El cóndor andino no supera a las anteriores pero es un ave voladora de dimensiones considerables, con una longitud de hasta 120 cm, con una envergadura que llega a los 320 cm y un peso de hasta 15 kg.[157][159]

La vida de las aves se organiza en función de varios ritmos biológicos. El más común, como en otros vertebrados, es el ritmo circadiano. La mayoría de las aves son diurnas, pero algunas, como la mayor parte de las rapaces nocturnas y los chotacabras son nocturnas o crepusculares. Otras especies, como la mayoría de las limícolas, siguen un ritmo basado en las mareas.[160]
Las aves, debido a la existencia de estaciones, siguen también un ritmo circanual. Las aves que migran grandes distancias sufren generalmente cambios anatómicos o de comportamiento (como, por ejemplo, el zugunruhe) o una muda para preparase para el viaje. Según la estación, ciertas especies pueden realizar igualmente migraciones diarias, altitudinales por ejemplo, o para llegar a sus zonas de aprovisionamiento.
Los ritmos circadianos y estacionales parecen estar ligados a la duración del día. Los ciclos de reproducción son anuales, pero en ciertas especies particularmente prolíficas pueden sacar adelante varias nidadas una misma estación.
La duración de la vida de las aves es muy variable según las especies, puede ser de tres o cuatro años para algunas paseriformes, a más de 50 años para los albatros, petreles y pardelas, o incluso más de 60 años para ciertas especies raras como el kakapo.[161] Para deducir aproximadamente la edad de un ave hay que tener buenos conocimientos sobre fenómenos como las variaciones de la muda según la edad (además de la estación),[162] o la neumatización del esqueleto al envejecer.

Aunque tener cerebro de pájaro o ser un cabeza de chorlito significa no tener inteligencia en varias culturas, ciertas especies de aves dan pruebas de capacidades cognitivas relativamente elevadas. Las especies de Corvidae tienen fama de ser las aves más inteligentes;[163] los loros son también capaces de demostraciones sorprendentes, pero con bastante disparidad entre las especies. Por otra parte, es difícil definir el término «inteligencia» y también el distinguir aquello que es parte del dominio de lo innato o del dominio de lo adquirido, y por lo tanto de evaluar sus capacidades de razonamiento.
Las aves son capaces de aprender; se sabe por ejemplo que los cucos aprenden los cantos de sus padres adoptivos o que los cuervos hacen su aprendizaje imitando a sus semejantes.[164] Sus capacidades más comunes son ciertamente la representación espacial (que les permite orientarse, reencontrar sus fuentes de alimento o construir nidos sofisticados) y la capacidad de comunicación.
Una de las capacidades más sorprendentes es la aptitud bastante difundida de servirse de un objeto como utensilio.[165] El cuervo neocaledoniano, por ejemplo, es capaz de usar un palo para sacar de los troncos los insectos con los que se nutre. Ciertas aves son también capaces de contar, como los loros, que son también conocidos no solo por reproducir la voz humana, sino también por comprender lo que dicen y utilizar su vocabulario con acierto.
Se ha observado igualmente a aves capaces de medicarse, por ejemplo al ingerir arcilla para combatir los efectos nefastos de toxinas alimentarias.[166]
Ciertas facultades son prácticamente únicas, el abejaruco verde chico es capaz de «meterse en la cabeza» de sus predadores, es decir de calcular lo que el predador puede ver o no.[167]
La mayoría de las aves son diurnas, pero algunas especies, sobre todo búhos y chotacabras, son nocturnas o crepusculares; y muchas aves limícolas costeras se alimentan cuando las mareas les son propicias ya sea de día o de noche.[168]

La dieta de las aves incluye una gran cantidad de tipos de alimentos como néctar, frutas, plantas, semillas, carroña, y diversos animales pequeños, incluidas otras aves.[89] Como las aves no tienen dientes, su aparato digestivo está adaptado a procesar alimentos sin masticar que el ave traga enteros.
Las aves llamadas generalistas son las que emplean muchas y diferentes estrategias para conseguir alimentos de una amplia variedad de tipos, mientras que las que se concentran en un espectro reducido de alimentos o tienen una única estrategia para conseguir comida son consideradas especialistas.[89] Las estrategias de alimentación de las aves varían según la especie. Algunas cazan insectos lanzándose sorpresivamente desde una rama. Las especies que se alimentan de néctar, como los colibríes, los suimangas y los loris, tienen lenguas pelosas y formas de pico especialmente adaptadas para ajustarse a las plantas de las que se alimentan.[169] Los kiwis y las aves limícolas tienen largos picos que usan para sondear el suelo en busca de invertebrados; en el caso de las limícolas, sus picos presentan diferentes longitudes y curvaturas, ya que cada especie tiene un nicho ecológico diferente.[89][170] Los colimbos, patos buceadores, pingüinos y álcidos persiguen a sus presas bajo el agua, usando sus alas y/o sus pies para propulsarse,[80] mientras que los alcatraces, martines pescadores y charranes son predadores aéreos que se sumergen en picado en busca de su presa. Los flamencos, tres especies de petreles, y algunos patos, se alimentan filtrando el agua.[171][172] Otras aves, como los gansos y los patos nadadores, se alimentan principalmente pastando. Algunas especies, entre las que se incluyen las fragatas, las gaviotas,[173] y los págalos,[174] son cleptoparásitas, es decir, roban comida a otras aves. Se supone que con esto logran un suplemento adicional, pero no una parte importante de su dieta general; un caso estudiado de cleptoparasitismo de la fragata grande sobre el alcatraz enmascarado determinó que obtenían en promedio solo el 5 % de su comida, y como máximo un 40 %.[175] Hay otras aves que son carroñeras, algunas de las cuales, como los buitres, están especializados en comer cadáveres, mientras que otras, como las gaviotas, los córvidos o algunas aves de presa lo hacen solo como oportunistas.[176]
La mayoría de las aves necesitan beber, aunque su demanda fisiológica de agua se ve reducida por la excreción uricotélica y la ausencia de glándulas sudoríparas.[177] Además, pueden refrescarse moviéndose a la sombra, metiéndose en el agua, jadeando, agitando su garganta, o con algunos comportamientos especiales como la urohidrosis. Algunas aves del desierto pueden obtener toda el agua que necesitan de su alimento. También pueden presentar otras adaptaciones, como permitir que la temperatura de su cuerpo se eleve, lo que evita la pérdida de humedad que se produciría mediante el enfriamiento por evaporación o por jadeo.[178] Las aves marinas pueden beber agua del mar, ya que tienen unas glándulas en la cabeza que usan para eliminar el exceso de sal, que expulsan a través de las fosas nasales.[179]
La mayor parte de las aves recogen el agua con el pico y después elevan su cabeza para dejar que el agua caiga por la garganta. Todas las palomas y algunas especies, especialmente en las zonas áridas, pertenecientes a las familias de los pinzones tejedores, los cólidos, los turnícidos y las avutardas, son capaces de beber agua sin necesidad de echar para atrás la cabeza.[180] Algunas especies del desierto dependen de fuentes de agua; tal es el caso de las gangas que se concentran diariamente en grandes números en los abrevaderos, y transportan el agua para sus pollos en las plumas mojadas del vientre.[181]
Muchas especies de aves migran para aprovecharse de las diferencias estacionales de temperatura en el mundo, con lo que optimizan la disponibilidad de fuentes de alimento y de hábitats reproductivos. Las migraciones varían mucho según la especie. Muchas realizan largas migraciones anuales, por lo general provocadas por los cambios en la duración del día así como por las condiciones meteorológicas. Estas aves se caracterizan por pasar la temporada de cría en regiones templadas o polares, e invernar en regiones templadas más cálidas, tropicales, o en el hemisferio contrario.
Antes de la migración incrementan sustancialmente sus grasas y reservas corporales, y reducen el tamaño de algunos de sus órganos.[104][182] La migración es una actividad que consume mucha energía, sobre todo cuando el ave debe cruzar desiertos y océanos sin poder reabastecerse. Las aves terrestres tienen una autonomía de vuelo de unos 2500 km y las aves limícolas de unos 4000 km,[89] aunque la aguja colipinta puede llegar a volar 10 200 km sin parar.[183] Las aves marinas también llevan a cabo largas migraciones; la migración anual más larga es la realizada por la pardela sombría, que cría en Nueva Zelanda y Chile y pasa el verano del Hemisferio Norte alimentándose en el Pacífico Norte (Japón, Alaska y California); en total hace unos 64 000 km al año.[184] Otras aves marinas se dispersan después de la época de cría, viajando mucho pero sin una ruta establecida. Los albatros, que crían en el océano Antártico, a menudo realizan viajes circumpolares en los períodos no reproductivos.[185]

Algunas especies de aves realizan migraciones más cortas, viajando solo lo necesario para evitar el mal tiempo o conseguir comida. Especies como algunos fringílidos boreales tienen comportamientos irruptivos, al estar presentes en un lugar un año y ausentes al siguiente. Este tipo de desplazamiento suele estar asociado a disponibilidad de alimentos.[186] También pueden realizar desplazamientos pequeños dentro de su área de distribución, con individuos de latitudes más altas que se mueven hacia los territorios sureños de sus congéneres; otras aves realizan migraciones parciales, en las cuales solo una parte de la población (normalmente hembras y machos subdominantes) migran.[187] En algunas regiones, la migración parcial puede ser un gran porcentaje de las formas de migración de sus avifaunas; en Australia, algunos estudios han calculado que en torno al 44 % de las aves no-paseriformes y el 32 % de las paseriformes son parcialmente migratorias.[188] La migración altitudinal es un tipo de migración de corta distancia, en la que las aves pasan la época de cría a mayores altitudes, y en épocas menos favorables se desplazan hacia altitudes menores. Por lo general están provocadas por cambios de temperatura, y normalmente ocurren cuando los territorios se vuelven inhóspitos por la falta de comida.[189] Algunas especies pueden ser nómadas, sin tener un territorio fijo y se desplazan en función del tiempo meteorológico y de la disponibilidad de alimentos. La mayoría de los loros no son ni migradores, ni sedentarios, sino que son dispersivos, irruptivos, nómadas, o realizan desplazamientos pequeños e irregulares.[190]
La capacidad de las aves de volver a un lugar concreto tras recorrer grandes distancias se conoce desde hace cierto tiempo; en un experimento realizado en la década de 1950, una pardela pichoneta liberada en Boston, volvió a su colonia en Skomer (Gales) en 13 días, cubriendo una distancia de 5150 km.[191] Las aves se orientan durante la migración usando diversos métodos; durante el día usan el sol para guiarse, y las estrellas son la referencia por la noche. Las especies que se orientan por el sol usan un reloj interno para compensar los cambios de posición del astro a lo largo del día.[89] La orientación a partir de las estrellas se basa en la posición de las constelaciones alrededor de los polos celestes.[192] En algunas especies, esto es reforzado además con su capacidad de sentir el magnetismo de la Tierra a través de fotorreceptores especializados.[193]

Las aves se comunican principalmente a través de señales visuales y auditivas. Las señales pueden ser interespecíficas (entre especies distintas) o intraespecíficas (de una sola especie).
En ocasiones usan su plumaje para establecer o reafirmar su posición social;[194] para indicar su receptividad sexual, o para intimidar, como en el caso de la exhibición de la tigana que busca ahuyentar a sus predadores y proteger a sus pollos.[195] Las variaciones del plumaje permiten la identificación de las aves, sobre todo entre especies. La comunicación visual en las aves incluye exhibiciones rituales, que se conforman de acciones habituales como acicalarse las plumas, picotazos y otros. Estas demostraciones pueden ser señales de amenaza o de sumisión, o contribuir a la formación de parejas.[89] Las exhibiciones más elaboradas se dan en el cortejo, a menudo compuesto de complejas combinaciones de muchos movimientos distintos;[196] el éxito reproductivo de los machos puede depender de la calidad de dichas exhibiciones.[197]
Las vocalizaciones de las aves, es decir, sus cantos y reclamos, ocurren en la siringe y son el principal medio que usan para comunicarse mediante el sonido. Esta comunicación puede ser muy compleja; algunas especies pueden usar los dos lados de la siringe independientemente, y logran así producir simultáneamente dos sonidos.[107] Los reclamos se usan para una amplia variedad de propósitos: para el cortejo (atracción de la pareja,[89] evaluar las posibles parejas[198]); para proteger y marcar el territorio;[89] para la identificación de otros individuos (como cuando los padres buscan a sus pollos en las colonias, o cuando las parejas se quieren reunir);[199] o para alertar de un depredador potencial. Los reclamos de alerta, en ocasiones, incluyen información específica de la naturaleza de la amenaza;[200] y además algunas aves son capaces de reconocer las llamadas de alerta que realizan otras especies.[201] Aparte de las vocalizaciones, algunas aves usan métodos mecánicos para la comunicación auditiva. Las agachadizas neozelandesas del género Coenocorypha producen sonidos cuando el aire pasa entre sus plumas,[202] los pájaros carpinteros realizan tamborileos para marcar territorio,[103] y la cacatúa enlutada hacen llamados a base de golpes usando herramientas.[203]

Mientras que algunas aves son esencialmente solitarias o viven en pequeños grupos familiares, otras pueden formar grandes bandadas. Los beneficios principales de agruparse son mayor seguridad y un incremento de la eficiencia en la búsqueda de alimento.[89] Defenderse contra los depredadores es especialmente importante en hábitats cerrados como los bosques, donde las emboscadas son comunes, y una gran cantidad de ojos contribuyen a un buen sistema de alerta. Esto ha llevado al desarrollo de bandadas compuestas por un pequeño número de diferentes especies unidas para la alimentación; estas bandadas aumentan la seguridad y reducen la competencia potencial por los recursos.[205] No todo son beneficios: entre los costes que presentan las asociaciones en bandadas están las intimidaciones y el acoso por parte de las aves dominantes hacia las subordinadas, y en algunos casos la reducción de la eficiencia en la búsqueda de alimento.[206]
También, en ocasiones, las aves forman asociaciones con especies que no son aves. Algunas aves marinas se asocian con los delfines y atunes, que empujan los bancos de peces hacia la superficie y las aves se zambullen para pescarlos.[207] Los cálaos tienen una relación mutualista con la mangosta enana: se alimentan juntos y se alertan de la cercanía de aves de presa y otros depredadores.[208]

Las altas tasas metabólicas de las aves durante sus momentos de actividad diurna están contrarrestadas por sus momentos de descanso. Mientras duermen, las aves a menudo realizan un tipo de sueño llamado vigilante, donde se intercalan períodos de descanso con leves y rápidos vistazos, que les permiten estar atentos a cualquier ruido y escapar de las amenazas;[209] los vencejos son capaces de dormir mientras vuelan, y usan el viento estratégicamente (generalmente encarándose a él) para no alejarse en exceso de sus territorios.[210] Se ha sugerido que algunos tipos de sueño podrían ser posibles en vuelo.[211] Algunas especies tienen la capacidad de caer en un sueño de onda lenta con un solo hemisferio del cerebro cada vez. Las aves tienden a usar esta habilidad según su posición relativa dentro de la bandada; las que se encuentran en los laterales del grupo mantienen así abierto y alerta el ojo que vigila las cercanías de la bandada; esta adaptación también se presenta en mamíferos marinos.[212] Es bastante normal que las aves se junten a la hora de dormir, lo que reduce la pérdida de calor corporal y disminuye los riesgos asociados a los depredadores.[213] Los dormideros son a menudo elegidos en atención a esos dos factores: seguridad y termorregulación.[214] Muchas aves, cuando duermen, doblan sus cabezas hacia el dorso y meten el pico debajo de las plumas, mientras que lo meten bajo las plumas del pecho. Es muy común que las aves descansen sobre una pata, y en algunos casos, sobre todo en climas fríos, meten la pata entre sus plumas. Los paseriformes tienen un mecanismo de bloqueo en el tendón que les permite mantenerse en la percha sin caer mientras duermen. Muchas aves terrestres, como los faisanes y las perdices, descansan subidos a los árboles. Varias especies del género Loriculus duermen boca abajo,[215] como hacen también los murciélagos. Algunas especies por la noche entran en un estado de letargo que se ve acompañado de una reducción de sus tasas metabólicas; hay unas 100 especies que tienen esta adaptación fisiológica: colibríes,[216] egotelos y chotacabras. Una especie, el chotacabras pachacua, incluso entra en un estado de hibernación.[217]

Las aves han desarrollado un comportamiento reproductor más complejo que la mayoría de los vertebrados. Durante la época de reproducción realizan una serie de rituales, algunos de ellos muy elaborados, como el cortejo del macho para aparearse con la hembra, o la construcción de nidos para llevar a cabo la puesta de huevos.
Las aves se reproducen mediante fecundación interna y ponen huevos provistos de una cubierta calcárea dura (el cascarón).[218]

El noventa y cinco por ciento de las especies de aves son monógamas sociales. Las parejas se mantienen al menos durante toda la temporada de cría, pero pueden durar varios años o incluso hasta la muerte de uno de los miembros de la pareja.[220] La monogamia permite el cuidado biparental que es especialmente importante en las especies en las que se necesita a dos adultos para sacar adelante la nidada.[221] En muchas especies monógamas, las cópulas fuera de la pareja («infidelidades») son comunes.[222] Este comportamiento es muy típico entre machos dominantes y hembras emparejadas con machos subordinados, pero también puede ser el resultado de cópulas forzadas, como en el caso de los patos y otras anátidas.[223] Los beneficios de estas cópulas fuera de la pareja incluyen, para las hembras, conseguir mejores genes para sus descendientes y asegurarse frente a la posibilidad de que su pareja sea infértil, y para los machos, aumentar el número de descendientes sin coste de cuidado parental.[224] En las especies en las que las cópulas fuera de la pareja son comunes, los machos vigilan estrechamente a sus parejas; esta adaptación aumenta la probabilidad de que los pollos que crían tengan sus genes.[225]
Otros sistemas de emparejamiento, como la poliginia, poliandria, poligamia, poliginandria y la promiscuidad también se dan en aves.[89] Los sistemas poligámicos se dan en especies donde las hembras son capaces de criar a sus pollos sin la necesidad de los machos.[89] Algunas especies usan más de uno de estos sistemas según las circunstancias.
En la reproducción normalmente se realiza alguna forma de exhibición de cortejo, por lo general realizada por el macho.[226] La mayor parte de estas exhibiciones son bastante simples e incluyen algún tipo de canto. Sin embargo otras están muy elaboradas. Dentro de los despliegues nupciales más llamativos se encuentran los realizados por las aves del paraíso de Nueva Guinea[227] y los bailarines del Neotrópico.[228] Según la especie pueden incluir golpeteos y tamborileos con las alas o la cola, bailes y vuelos acrobáticos en arenas de combate (leks). Las hembras suelen ser las que eligen a su pareja,[229] aunque en algunas especies poliándricas, como el falaropo picofino, es al revés: los machos, que son de colores poco llamativos, son los que eligen a las hembras de plumaje colorido y brillante.[230] Los acicalamientos mutuos, las cebas de cortejo, y los roces y «besos» con los picos son comportamientos comunes, generalmente después de que se hayan emparejado.[103]

Muchas aves defienden activamente un territorio de las intromisiones de sus congéneres durante la época de cría; al mantener su territorio aseguran las fuentes de alimento para sus pollos. Las especies que no defienden un territorio, como las aves marinas o los vencejos, a menudo crían en colonias; al criar en colonias se consigue cierta protección contra los depredadores. En las colonias las aves defienden sus lugares de anidamiento y la competencia por estos lugares puede ser intensa.[231]

Todas las aves ponen huevos amnióticos con cáscaras duras compuestas en su mayor parte por carbonato cálcico.[89] Los huevos de las especies que anidan en agujeros o madrigueras suelen ser blancos o de colores claros, mientras que los huevos de las que anidan en el suelo o entre la vegetación por lo general se camuflan con el entorno. Hay, sin embargo, muchas excepciones a esta regla; por ejemplo los chotacabras anidan en el suelo, pero sus huevos son blancos y el camuflaje se consigue por su plumaje. En las aves que son víctimas de los parásitos de puesta sus huevos tienen patrones de color variantes, adaptación que aumenta las probabilidades de descubrir el huevo del parásito en el nido, esto a su vez dirigió una adaptación en las hembras parásitas que ajusta los colores de sus huevos a los de sus hospedadores.[232]
Los huevos suelen ser incubados en un nido. La mayor parte de las especies construyen un nido más o menos trabajado, que puede ser una copa, una bóveda, una plataforma, un montículo, una madriguera o una simple escarbadura en el suelo.[233] Algunos nidos son, en cambio muy sencillos; los albatros ponen los huevos casi directamente sobre el suelo. La mayor parte de las aves ubican sus nidos en lugares protegidos y ocultos para evitar a los depredadores, pero en las especies coloniales, que tienen mayor capacidad de defensa, los nidos se sitúan en zonas más expuestas. Durante la construcción, algunas especies recogen plantas provistas de toxinas dañinas para los parásitos, lo que favorece la supervivencia de sus pollos,[234] y a menudo se usan las plumas como aislamiento térmico.[233] Varias especies de aves no tienen nidos; el arao común cría en acantilados donde deposita los huevos directamente sobre la roca, y el pingüino emperador guarda e incuba sus huevos entre sus pies y su cuerpo. La ausencia de nidos es más común en especies que anidan en el suelo, ya que sus pollos suelen ser precoces.
La incubación generalmente comienza cuando se ha puesto el último huevo y tiene el fin de optimizar su temperatura para el correcto desarrollo del embrión.[89] En las especies monógamas la incubación suele ser una tarea compartida, mientras que en las especies polígamas el encargado es solo uno de los progenitores. El calor de los padres pasa a los huevos a través de unas zonas concretas del vientre o del abdomen del ave que han perdido las plumas y tienen la piel descubierta. La incubación puede ser un proceso que demanda mucha energía; los albatros adultos, por ejemplo, pierden hasta 83 g de peso por día de incubación.[235] El calor en la incubación de los huevos de los talégalos proviene del sol, de la descomposición de la vegetación o del calor del suelo en zonas volcánicas.[236] Los períodos de incubación varían mucho, desde 10 días en los cucos, pájaros carpinteros y paseriformes, hasta más de 80 días en los albatros y en los kiwis.[89]

Al salir del cascarón los pollos pueden ser desde indefensos a independientes, incluidos varios estados intermedios, según la especie. Las que nacen indefensas se llaman altriciales o nidícolas y suelen ser pequeñas, ciegas y desnudas; los pollos que nacen más formados se llaman precoces o nidífugos, están cubiertos de plumón y son capaces de seguir a sus padres (como es el caso de los anseriformes y galliformes).[237] Los pollos altriciales necesitan la ayuda de sus padres para termorregularse y su periodo de cría dura más tiempo que el de los precoces.
La duración y naturaleza del cuidado parental varía mucho entre los diferentes órdenes y especies. En un extremo están los talégalos que dejan de cuidar a sus descendientes al romper el cascarón; el pollo recién nacido es capaz de salir del cascarón y del nido sin ayuda de los padres y valerse por sí mismo inmediatamente.[238] En el otro extremo muchas aves marinas cuidan a sus pollos durante largos períodos; el más largo es el de la fragata grande, sus pollos tardan seis meses en emplumar y son alimentados por los padres durante otros catorce meses más.[239]

En algunas especies los dos padres se ocupan de la cría, en otras solo uno de los sexos carga con la responsabilidad. En ocasiones otros congéneres, generalmente parientes cercanos de la pareja, como los juveniles de años pasados, ayudan en la cría.[240] Este comportamiento es bastante común entre los córvidos, y especies cercanas a estos como la urraca australiana o el género Malurus,[241] pero se ha observado también en especies tan diferentes como el acantisita verdoso o el milano real. En la mayor parte de los grupos animales el cuidado de las crías por parte de los machos es raro. Sin embargo, en las aves es bastante común, más que en cualquier otra clase de vertebrado.[89] Aunque las labores relacionadas con la reproducción y la cría son a menudo compartidas, en ocasiones hay una división del trabajo en la que uno de los miembros de la pareja lleva a cabo toda o la mayor parte de una determinada tarea.[242]
El momento en que los pollos abandonan el nido varía de manera muy acusada. Los pollos de los álcidos del género Synthliboramphus, como el mérgulo antiguo, dejan el nido la noche después de salir del cascarón, siguen a sus padres al mar donde se desarrollan a salvo de los depredadores terrestres.[243] Otras especies, como los patos, también abandonan el nido a una edad temprana. En la mayor parte de los casos, los pollos dejan el nido cuando son capaces de volar. Tras dejar el nido hay especies, por ejemplo los albatros, que no continúan cuidando de su nidada, mientras que otras siguen alimentándoles.[244] Los juveniles pueden también seguir a sus padres durante su primera migración.[245]

El parasitismo de puesta, en el que una especie deja sus huevos entre los de otra especie para que esta los críe, es más común entre las aves que en cualquier otro tipo de organismo.[246] Después de que el ave parásita deposite sus huevos en el nido de otra, por lo general son aceptados y criados por los padres adoptivos a expensas de su propia nidada. Entre las especies que usan este modo de parasitismo hay unas que son incapaces de sacar adelante una nidada propia y por ello están obligadas a parasitar, y hay otras que en ocasiones ponen sus huevos en nidos de individuos de su misma especie para incrementar su rendimiento reproductivo, incluso aunque hayan criado a sus propios pollos.[247] Unas cien especies, entre las que se incluyen indicadores, ictéridos, estríldidos y patos son parásitos obligados, aunque los más famosos son los cucos.[246] En algunos parásitos de puesta sus huevos eclosionan antes que los del hospedador, lo que le permite al parásito destruir los huevos empujándolos fuera del nido o matar a los pollos que han tenido menos tiempo para desarrollarse; esto les asegura que toda la comida que traigan los padres-hospedadores sea para ellos.[248]

Las aves ocupan un amplio espectro de nichos ecológicos.[204] Mientras algunas aves son generalistas, otras están altamente especializadas en su hábitat o en su alimentación. Incluso en un solo hábitat, como por ejemplo un bosque, los nichos ecológicos ocupados por diferentes aves varían; algunas especies se alimentan en la copa de los árboles, otras por debajo del dosel arbóreo, y algunas en el suelo del bosque. Las aves forestales pueden ser insectívoras, frugívoras y nectarívoras. Las aves acuáticas por lo general se alimentan pescando, comiendo plantas acuáticas, o como cleptoparásitas. Las aves de presa están especializadas en cazar mamíferos, otras aves y otros animales, mientras que los buitres son aves carroñeras especializadas.
Algunas aves nectarívoras son importantes polinizadoras, y muchas especies frugívoras juegan un papel clave en la dispersión de las semillas.[249] Las plantas y las aves que las polinizan, a menudo coevolucionan,[250] y en algunos casos el principal polinizador de la planta es el único capaz de llegar a su néctar.[251]
Las aves son importantes en la ecología de las islas. Alcanzan islas a donde los mamíferos no han podido llegar; en estas islas las aves desempeñan roles ecológicos que en zonas continentales ocupan animales de mayor tamaño. Por ejemplo, en Nueva Zelanda las moas eran importantes ramoneadoras y frugívoras, como lo son el kereru y el kokako en la actualidad.[249] Hoy en día las plantas en Nueva Zelanda mantienen las adaptaciones defensivas que desarrollaron para protegerse de las extintas moas.[252] Las aves marinas también afectan la ecología de las islas en que nidifican, sobre todo a través de la concentración y acumulación de grandes cantidades de guano, que enriquecen con nutrientes los suelos,[253] y los mares circundantes.[254]
Los parásitos más corrientes de las aves pertenecen a los grupos de los ácaros, los piojos aviares y los vermes. Otros parásitos microscópicos, como hongos, protozoos, bacterias y virus, también les provocan enfermedades.

Al menos 2500 especies de ácaros repartidos en 40 familias viven en relación estrecha con las aves, ocupan sus nidos, sus plumas, o incluso sus picos, como ciertos ácaros de los colibríes. Estos ácaros pueden tener una relación simplemente forética o pueden perturbar a sus hospedadores y provocarles desnutrición, pero pueden también ser verdaderos parásitos como Dermanyssus y Ornithonyssus. Todas las especies de aves se ven afectadas, incluso los pingüinos portan garrapatas.[255] El modo de vida de una garrapata de ave depende, por supuesto, de su especie; sin embargo, la larva vive por lo común en el nido. Los ácaros tienen ciclos de reproducción cortos y son capaces de multiplicarse muy rápidamente. Algunos ácaros se nutren de piel muerta, otros como los de los colibríes, se hacen transportar de flor en flor y se nutren de néctar. En los nidos, incluso se han descubierto garrapatas enanas parásitas de garrapatas aviarias.[255]

Un número muy importante de garrapatas puede perjudicar a la nidada e incluso a la vida de los pollos. Por tanto, ciertos estudios podrían sugerir que este comensalismo no es únicamente desfavorable a las aves.[255] Los piojos de las aves (Ischnocera) infestan, la mayoría de ocasiones, a una especie concreta. Varias especies de platelmintos, entre los cuales están los cestodos, o los trematodos, pueden infectar las aves que los pueden transportar de un continente a otro. Por ejemplo, las aves marinas, al comer los berberechos, favorecen un parasitismo de trematodos (géneros Meiogymnophalus, Himasthla, etc.) que pueden luego afectar a varias especies de hospedadores, ya sean aves u otros moluscos.[256]
Además de parásitos, las aves pueden sufrir otras enfermedades infecciosas como:
|


Dado que las aves son animales muy visibles y muy comunes, los humanos han tenido una intensa relación con ellas desde el comienzo de la humanidad.[257] Algunas veces estas relaciones son mutualísticas, como la existente entre los indicadores y pueblos africanos como los borana que se ayudan de estas aves a la hora de recolectar miel.[258] En otras ocasiones la relación puede ser de comensalismo, situación que se da cuando una especie se beneficia de las actividades humanas, como por ejemplo el gorrión común.[259] Muchas especies se han convertido en plagas económicamente significativas para la agricultura,[260] y algunas generan riesgos para la aviación.[261] Las actividades humanas también han perjudicado a las aves, y han extinguido y puesto en peligro de extinción a numerosas especies.

Las aves juegan papeles prominentes y diversos en el folclore, la religión y la cultura popular. En la religión, las aves pueden servir tanto como mensajeras, representantes o portadoras de una deidad, como en el culto de Make-Make, en que los Tangata Manu de la Isla de Pascua servían de jefes,[262] o como asistentes, como en el caso de Hugin y Munin, dos cuervos comunes que susurraban las noticias al oído del dios noruego Odín.[263] También pueden servir de símbolos religiosos, como cuando Jonás (Hebreo: יוֹנָה, paloma) corporizaba el miedo, la pasividad, el lamento, y la belleza, asociados tradicionalmente a las palomas.[264] Las aves han sido por sí mismas deificadas, como en el caso del pavo real común, que es percibido como la madre tierra por los drávidas de la India.[265] Algunas aves han sido percibidas también como monstruos, como el mitológico Roc y el Pouakai legendario de los maoríes, un ave gigante capaz de levantar en vuelo a humanos apresados.[266]
Las aves han sido representadas en la cultura y el arte desde tiempos prehistóricos, cuando eran pintadas en cuevas.[267] Fueron usadas luego como arte y diseños religiosos o simbólicos, como el magnífico Trono del Pavo real de los Mogoles y los emperadores de Persia.[268] Con el surgimiento del interés científico por las aves, muchas pinturas de aves fueron encargadas para libros. Uno de los pintores de aves más famoso fue John James Audubon, cuyas obras de aves norteamericanas tuvieron un gran éxito comercial en Europa, y quien luego prestó su nombre a la National Audubon Society.[269] Las aves son también personajes importantes en la poesía; por ejemplo, Homero incorporó a los ruiseñores en su Odisea, y Catulo usó al gorrión como un símbolo erótico en su Catullus 2.[270]
En español, existen algunos nombres de aves con sentido metafórico para describir o representar comportamientos y características humanos. Pero las percepciones de una misma ave a menudo varían entre distintas culturas. Los búhos se asocian con la mala suerte, la brujería y la muerte en zonas de África,[271] pero son relacionados con la sabiduría en gran parte de Europa.[272] Las abubillas eran consideras sagradas en el Egipto Antiguo, y símbolos de virtud en Persia, pero eran percibidas como ladronas en gran parte de Europa, y como presagio de guerra en Escandinavia.[273]

Las aves domésticas criadas para carne y huevos, también llamadas aves de corral, son la mayor fuente de proteína animal en la alimentación humana: en 2003, se produjeron 76 millones de toneladas de carne de aves y 61 millones de toneladas de huevos en todo el mundo.[274] Los pollos son la mayor proporción de la carne de aves domésticas que se consume, aunque pavos, patos y gansos son también relativamente comunes. Muchas especies de aves son cazadas por su carne. La cacería de aves es principalmente una actividad recreativa, pero en áreas poco desarrolladas la caza sigue aportando parte de la dieta. Las especies cinegéticas de aves más importantes de América del Sur y del Norte son las anátidas, pero también se cazan mucho los faisanes, pavos silvestres, codornices, palomas, perdices, gallos silvestres, grévoles, agachadizas y chochas.[275] La caza de pollos de pardelas (muttonbirding) es popular en Australia y Nueva Zelanda.[276] Aunque alguna cacería, como la de pichones de pardelas, pueda ser sostenible, la caza ha llevado a la extinción o a la amenaza de extinción a decenas de especies.[277]
Otros productos de aves comercialmente valiosos son las plumas (especialmente el plumón de gansos y patos), usados en el aislamiento de ropas y acolchado de camas, y el guano (las heces de las aves), que es una rica fuente de fósforo y nitrógeno. La Guerra del Pacífico, llamada a veces Guerra del Guano, se libró en parte por el control de grandes depósitos de esta sustancia.[278]
Las aves han sido domesticadas por humanos como mascotas y para propósitos prácticos. Aves coloridas como los loros y las minas son criadas en cautiverio y mantenidas como animales de compañía, práctica que ha llevado al tráfico ilegal de un número de especies amenazadas.[279] Los halcones y cormoranes han sido desde muy antiguo usados para la caza (cetrería) y la pesca respectivamente. La paloma mensajera, usada al menos desde el año 1 d. C., siguió siendo importante hasta épocas tan recientes como la Segunda Guerra Mundial. Hoy en día, tales actividades son más comunes como afición, entretenimiento, turismo,[280] o deporte, como en las carreras de palomas.
Los entusiastas aficionados llamados observadores de aves o pajareros se cuentan por millones.[281] Muchas personas disponen comederos de aves cerca de sus viviendas para atraer varias especies. La alimentación para aves se ha convertido en un negocio multimillonario. Por ejemplo, se estima que el 75 % de las amas de casa de Gran Bretaña provee alimento para las aves en algún momento durante el invierno.[282]
Las aves pueden jugar un rol sanitario importante al ser vectores de enfermedades humanas, al propagarlas a largas distancias, como la psitacosis, salmonelosis, campilobacteriosis, micobacteriosis (tuberculosis aviar), gripe aviar, giardiasis, y criptosporidiosis.[283] Por ello estas zoonosis son estudiadas y su propagación es cuidadosamente vigilada. El descubrimiento de reservorios de enfermedades aviares puede llevar a las autoridades locales a tomar medidas radicales respecto a las aves de corral, lo cual puede representar un fuerte impacto económico. Así, en septiembre de 2007, 205 000 aves fueron sacrificadas en Baviera,[284] y otras 160 000 en Bangladés en junio de 2007,[285] tras el descubrimiento de la cepa de la gripe aviar, entre otros ejemplos. Ciertas enfermedades pueden ser más específicas de un orden, como la enfermedad de Pacheco producida por un herpesvirus en Psittaciformes.[286]

Los humanos han tenido un gran impacto sobre muchas especies de aves. Las actividades humanas han permitido en algunos casos expandir drásticamente su territorio a algunas especies; otras, en cambio, han reducido su área de distribución, lo que ha conducido a muchas extinciones. Más de 120 especies de aves se han extinguido desde el siglo XVII,[288] aunque las extinciones más dramáticas causadas por el hombre ocurrieron durante la colonización humana de las islas de Melanesia, Polinesia y Micronesia en el océano Pacífico, durante la cual se estima que se extinguieron de 750 a 1800 especies de aves.[289] Muchas poblaciones de aves están en declive en todo el mundo; en condición de amenazadas se cuentan 1253 especies (año 2011) en las listas de Birdlife International y la UICN.[290] La causa más frecuentemente citada involucra la pérdida de hábitat.[291] Otras amenazas incluyen la caza excesiva, la mortalidad accidental por colisión con edificaciones o debida al enganche por la pesca con sedal largo,[292] por contaminación (incluidos derrames de petróleo y uso de pesticidas),[293] competencia y depredación por especies invasoras (como ratas, gatos y mangostas),[294] y el cambio climático. La familia que cuenta con más especies amenazadas (más de 70) es la de los loros. Los gobiernos, junto a organizaciones de conservación, trabajan para proteger a las aves mediante de leyes, preservando y restaurando sus hábitats, o manteniendo poblaciones en cautiverio para ulteriores reintroducciones. Los esfuerzos de conservación biológica han conseguido algunos éxitos; un estudio estimó que entre 1994 y 2004 fueron salvadas 16 especies de aves que se habrían extinguido si no se hubieran realizado estas acciones.[295]