Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Indolo | ||||
| ||||
| Plata kemia strukturo de la Indolo | ||||

| ||||
| Tridimensia strukturo de la Indolo | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 120-72-9 | |||
| ChemSpider kodo | 776 | |||
| PubChem-kodo | 798 | |||
| Merck Index | 15,5003 | |||
| Fizikaj proprecoj | ||||
| Aspekto | blanka solido kun forta fekaĵodoro, lumsensiva | |||
| Molmaso | 117.15 g·mol-1 | |||
| Denseco | 1.1747 g cm−3 | |||
| Fandpunkto | 52-54 °C | |||
| Bolpunkto | 253-254 °C | |||
| Ekflama temperaturo | 121 °C | |||
| Solvebleco | Akvo:1.9 g/L (20 °C) 3.56 (25 °C) | |||
| Mortiga dozo (LD50) | 1000 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Risko | R21/22 R37/38 R41 R50/53 | |||
| Sekureco | S26 S36/37/39 S45 S60/61 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj[1] | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H302, H311, H315, H318, H335, H400 | |||
| GHS Deklaroj pri antaŭgardoj | P261, P273, P280, P305+351+338, P312 | |||
(25 °C kaj 100 kPa) | ||||
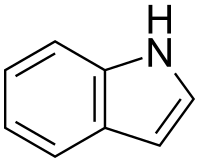
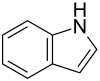
Indolo estas aromata organika heterocikla kombinaĵo kun ducikla strukturo, konsistante je sesmembra benzena ringo ligita al kvinmembra pirola ringo. Indolo estas vaste trovata en naturo tiaj kiaj en floroj de jasmeno kaj oranĝo kaj estas produktata de pluraj bakterioj kaj fekmaterialoj. Ĝi estas sintezebla de kelkaj bakterioj kiel malkomponiga produkto de la triptofana aminoacido.
Ĝi nature troviĝas en homaj fekaĵoj kaj posedas intensan fekodoron. Ĉi-malagrabla odoro okazas en la biero pro malpurigo de koliformoj dum la primara staĝo je fermentado en la bierfabrikado. Tamen, en tre malaltaj koncentriĝoj ĝia odoro estas milda kaj agrabla kaj estas konstituanto de pluraj floresencoj kaj parfumoj. La natura jasmenoleo, uzada en parfumindustrio, enhavas ĉirkaŭ 2.5% da indolo.
Indolo ankaŭ okazas en la karbogudro. La partopreno de la elektrona paro en la nitrogena jono de la aromata ringo signifas ke la indolo ne estas bazo kaj ĝi ankaŭ ne kondutas sin kiel simpla amino. La aminoacido triptofano estas indola derivaĵo kaj antaŭanto de la nervotransigilo serotonino.
Indoloj estas gravaj antaŭaĵoj de aliaj substancoj en la homa korpo kaj do ili estas esplorataj kaj uzataj en medicino. La komponaĵo estis oficiale malkovrita en 1866 far sciencistoj laborantaj kun la proprecoj de la zinka pulvoro kiu reduktas la oksindolon al indolo.
Post la malkovro, la indoloj iĝis gravan konstituantoj de la tekstila industrio, kaj oni rimarkis ke ju pli esploroj estis faritaj, des pli la rolo de la indoloj plenumis en la homkorpa sistemo. La indolaj nukleoj en substancoj tiaj kiaj la triptofano kaj la aŭksino rezultis en pli bona kompreno de iliaj mekanismoj ene de la korpo.





| Derivaĵoj de la indano | ||||||||
 |
 |
 |
 |
 | ||||
|
|
||||||||

|

|

|

|
| ||||
|
|
||||||||
 |
|

|

|
 | ||||
|
|
||||||||