Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Στρόντιο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Στρόντιο (Sr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | Μέταλλα | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
Αλκαλικές γαίες ,5, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
87.62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[ Kr ] 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 215 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 1,00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 1050 K, 777 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 1655 K, 1382 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | Παραγμανιτισμός | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το στρόντιο είναι χημικό στοιχείο με χημικό σύμβολο Sr και ατομικό αριθμό 38. Ως μέταλλο αλκαλικής γαίας, το στρόντιο είναι ένα μαλακό ασημί-λευκό κιτρινωπό μεταλλικό στοιχείο, όπου, χημικά, είναι εξαιρετικά αντιδραστικό. Το μέταλλο σχηματίζει ένα σκούρο στρώμα οξειδίου, όταν εκτεθεί στον αέρα. Το στρόντιο έχει φυσικές και χημικές ιδιότητες παρόμοιες με αυτές των δύο κάθετων γειτόνων του στον περιοδικό πίνακα, του ασβεστίου και του βαρίου. Εμφανίζεται φυσικά κυρίως στα ορυκτά σελεστίνη και στροντιανίτη, και εξορύσσεται κυρίως από αυτά.
Τόσο το στρόντιο όσο και ο στροντιανίτης έχουν πάρει το όνομά τους από το Στρόντιαν, ένα χωριό στη Σκωτία κοντά στο οποίο το ορυκτό ανακαλύφθηκε το 1790 από τους Ανταίρ Κρόφορντ και Γουίλιαμ Κρούικσανκ. Αναγνωρίστηκε ως νέο στοιχείο τον επόμενο χρόνο, από το κατακόκκινο χρώμα της φλόγας. Το στρόντιο απομονώθηκε για πρώτη φορά ως μέταλλο το 1808 από τον Χάμφρι Ντέιβι, χρησιμοποιώντας την τότε πρόσφατα ανακαλυφθείσα διαδικασία της ηλεκτρόλυσης. Κατά τον 19ο αιώνα, το στρόντιο χρησιμοποιήθηκε κυρίως για την παραγωγή ζάχαρης από ζαχαρότευτλα. Στο αποκορύφωμα της παραγωγής σωλήνων καθοδικών ακτίνων για τηλεοπτικές οθόνες, έως και το 75% της κατανάλωσης στροντίου στις Ηνωμένες Πολιτείες χρησιμοποιήθηκε για το γυαλί των οθονών.[1] Με την αντικατάσταση των καθοδικών λυχνιών με άλλες μεθόδους απεικόνισης, η κατανάλωση στροντίου έχει μειωθεί δραματικά.[1]
Ενώ το φυσικό στρόντιο (το οποίο είναι ως επί το πλείστον το ισότοπο στρόντιο-88) είναι σταθερό, το συνθετικό στρόντιο-90 είναι ραδιενεργό και είναι ένα από τα πιο επικίνδυνα συστατικά της πυρηνικής πτώσης, καθώς το στρόντιο απορροφάται από τον οργανισμό με παρόμοιο τρόπο με το ασβέστιο. Αντιθέτως, το φυσικό σταθερό στρόντιο δεν είναι επικίνδυνο για την υγεία.
Το στρόντιο είναι ένα δισθενές αργυρόχρωμο μέταλλο με ωχροκίτρινη απόχρωση, του οποίου οι ιδιότητες είναι ως επί το πλείστον ήπιες και παρόμοιες με εκείνες της ομάδας γειτονικών του ασβεστίου και βαρίου.[2] Είναι πιο μαλακό από το ασβέστιο και πιο σκληρό από το βάριο. Οι βαθμοί τήξης και βρασμού (777°C και 1377°C αντίστοιχα) είναι χαμηλότεροι από εκείνους του ασβεστίου (842°C και 1484°C αντίστοιχα). Το βάριο συνεχίζει αυτή την πτωτική τάση στο σημείο τήξης (727°C), αλλά όχι στο σημείο βρασμού (1900°C). Η πυκνότητα του στροντίου (2,64g/cm3) είναι ομοίως ενδιάμεσο μεταξύ εκείνων του ασβεστίου (1,54g/cm3) και βάριο (3.594g/cm3). Υπάρχουν τρία αλλότροπα μεταλλικού στροντίου, με σημεία μετάβασης στους 235°C και 540°C.[3]
Το τυπικό δυναμικό ηλεκτροδίου για το ζεύγος Sr2+/Sr είναι −2,89V, περίπου στη μέση μεταξύ εκείνων του ζεύγους Ca2+/Ca (−2,84V) και Ba2+/Ba (−2,92V) και κοντά σε αυτά των γειτονικών αλκαλιμετάλλων.[4] Το στρόντιο είναι ενδιάμεσο μεταξύ ασβεστίου και βαρίου ως προς την αντιδραστικότητα του προς το νερό, με το οποίο αντιδρά κατά την επαφή για να παράγει υδροξείδιο του στροντίου και αέριο υδρογόνο. Το μέταλλο στροντίου καίγεται στον αέρα και παράγει τόσο οξείδιο του στροντίου όσο και νιτρίδιο του στροντίου, αλλά επειδή δεν αντιδρά με άζωτο κάτω από τους 380°C, σε θερμοκρασία δωματίου σχηματίζει μόνο το οξείδιο αυθόρμητα. Εκτός από το απλό οξείδιο SrO, το υπεροξείδιο SrO2 μπορεί να παραχθεί με άμεση οξείδωση μετάλλου στροντίου υπό υψηλή πίεση οξυγόνου και υπάρχουν κάποιες ενδείξεις για ένα κίτρινο υπεροξείδιο Sr(O2)2.[5] Το υδροξείδιο του στροντίου, Sr(OH)2, είναι μια ισχυρή βάση, αν και δεν είναι τόσο ισχυρή όσο τα υδροξείδια του βαρίου ή των αλκαλικών μετάλλων.[6] Και τα τέσσερα διαλογονίδια του στροντίου είναι γνωστά.[7]
Λόγω του μεγάλου μεγέθους των βαρέων στοιχείων στον τομέα s, συμπεριλαμβανομένου του στροντίου, είναι γνωστό ένα τεράστιο εύρος αριθμών συντονισμού, από 2, 3 ή 4 μέχρι το 22 ή το 24 στο SrCd11 και το SrZn13. Το ιόν Sr2+ είναι αρκετά μεγάλο, έτσι ώστε οι υψηλοί αριθμοί συντονισμού είναι ο κανόνας.[8] Το μεγάλο μέγεθος του στροντίου και του βαρίου παίζει σημαντικό ρόλο στη σταθεροποίηση των συμπλεγμάτων στροντίου με πολυοδοντικούς μακροκυκλικούς υποκαταστάτες όπως οι αιθέρες κορώνας: για παράδειγμα, ενώ το 18-crown-6 σχηματίζει σχετικά ασθενή σύμπλοκα με το ασβέστιο και τα αλκαλικά μέταλλα, τα σύμπλοκα στροντίου και βαρίου είναι πολύ πιο δυνατό.[9]
Οι ενώσεις οργανοστροντίου περιέχουν έναν ή περισσότερους δεσμούς στροντίου-άνθρακα. Έχουν αναφερθεί ως ενδιάμεσα σε αντιδράσεις τύπου Barbier.[10] [11][12] Αν και το στρόντιο ανήκει στην ίδια ομάδα με το μαγνήσιο και οι οργανομαγνήσιες ενώσεις χρησιμοποιούνται πολύ συχνά σε όλη τη χημεία, οι ενώσεις οργανοστροντίου δεν είναι εξίσου διαδεδομένες επειδή είναι πιο δύσκολο να κατασκευαστούν και πιο αντιδραστικές. Οι ενώσεις οργανοστροντίου τείνουν να μοιάζουν περισσότερο με τις οργανικές ενώσεις του ευρωπίου ή οργανικού σαμαρίου λόγω των παρόμοιων ιοντικών ακτίνων αυτών των στοιχείων (Sr2+ 118 pm, Eu2+ 117 pm και Sm2+ 122 pm). Οι περισσότερες από αυτές τις ενώσεις μπορούν να παρασκευαστούν μόνο σε χαμηλές θερμοκρασίες. Οι ογκώδεις συνδέτες τείνουν να ευνοούν τη σταθερότητα. Για παράδειγμα, το δικυκλοπενταδιενύλιο στρόντιο, Sr(C5H5)2, πρέπει να παρασκευάζεται με άμεση αντίδραση μετάλλου στροντίου με το υδροκένιο ή το ίδιο το κυκλοπενταδιένιο. Η αντικατάσταση του συνδέτη C5H5 με τον πιο ογκώδη συνδέτη C5(CH3)5 από την άλλη πλευρά αυξάνει τη διαλυτότητα, την πτητότητα και την κινητική σταθερότητα της ένωσης.[13]
Λόγω της εξαιρετικής αντιδραστικότητάς του με το οξυγόνο και το νερό, το στρόντιο εμφανίζεται φυσικά μόνο σε ενώσεις με άλλα στοιχεία, όπως στα ορυκτά στροντιανίτη και σελεστίνη. Διατηρείται κάτω από υγρό υδρογονάνθρακα όπως ορυκτέλαιο ή κηροζίνη για να αποφευχθεί η οξείδωση. Το πρόσφατα εκτεθειμένο μέταλλο στρόντιο παίρνει γρήγορα ένα κιτρινωπό χρώμα με το σχηματισμό του οξειδίου. Το λεπτόκοκκο μέταλλο στρόντιο είναι πυροφορικό, που σημαίνει ότι θα αναφλεγεί αυθόρμητα στον αέρα σε θερμοκρασία δωματίου. Τα πτητικά άλατα στροντίου προσδίδουν ένα έντονο κόκκινο χρώμα στις φλόγες και αυτά τα άλατα χρησιμοποιούνται στην πυροτεχνία και στην παραγωγή φωτοβολίδων. Όπως το ασβέστιο και το βάριο, καθώς και τα αλκαλιμέταλλα και οι δισθενείς λανθανίδες ευρώπιο και υττέρβιο, το μέταλλο στρόντιο διαλύεται απευθείας σε υγρή αμμωνία για να δώσει ένα σκούρο μπλε διάλυμα διαλυτωμένων ηλεκτρονίων.[2]
Το φυσικό στρόντιο είναι ένα μείγμα τεσσάρων σταθερών ισοτόπων: 84Sr, 86Sr, 87Sr και 88Sr. Η αφθονία τους αυξάνεται με τον αυξανόμενο αριθμό μάζας και το βαρύτερο, το 88Sr, αποτελεί περίπου το 82,6% όλου του φυσικού στροντίου, αν και η αφθονία ποικίλλει λόγω της παραγωγής του ραδιογενούς 87Sr ως θυγατρικό ισότοπο του μακρόβιου βήτα-διάσπασης 87Rb.[14] Αυτή είναι η βάση της χρονολόγησης ρουβιδίου-στροντίου. Από τα ασταθή ισότοπα, ο κύριος τρόπος διάσπασης των ισοτόπων ελαφρύτερων από 85Sr είναι η σύλληψη ηλεκτρονίων ή η εκπομπή ποζιτρονίων στα ισότοπα του ρουβιδίου και αυτός των ισοτόπων βαρύτερων από 88Sr είναι η εκπομπή ηλεκτρονίων σε ισότοπα υττρίου. Ιδιαίτερης σημασίας είναι τα 89Sr και 90Sr. Το πρώτο έχει χρόνο ημιζωής 50,6 ημέρες και χρησιμοποιείται για τη θεραπεία του καρκίνου των οστών λόγω της χημικής ομοιότητας του στροντίου και ως εκ τούτου της ικανότητας να αντικαθιστά το ασβέστιο.[15] [16] Ενώ είναι 90Sr (χρόνος ημιζωής 28,90 χρόνια) έχει χρησιμοποιηθεί με παρόμοιο τρόπο, είναι επίσης ένα ισότοπο ανησυχίας σε επιπτώσεις από πυρηνικά όπλα και πυρηνικά ατυχήματα λόγω της παραγωγής του ως προϊόν σχάσης. Η παρουσία του στα οστά μπορεί να προκαλέσει καρκίνο των οστών, καρκίνο των κοντινών ιστών και λευχαιμία.[17] Το πυρηνικό ατύχημα του Τσερνόμπιλ το 1986 μόλυναν περίπου 30.000km2 με μεγαλύτερο από 10kBq/m2 με 90Sr, που αντιπροσωπεύει περίπου το 5% των 90Sr που ήταν στον πυρήνα του αντιδραστήρα.[18]

Το στρόντιο πήρε το όνομά του από το σκωτσέζικο χωριό Στρόντιαν (γαελικά Sròn an t-Sìthein), όπου ανακαλύφθηκε στα μεταλλεύματα των ορυχείων μολύβδου.[19]
Το 1790, ο Ανταίρ Κρόφορντ, ένας γιατρός που ασχολήθηκε με την παρασκευή βαρίου, και ο συνάδελφός του Γουίλιαμ Κρούικσανκ, αναγνώρισαν ότι τα μεταλλεύματα του στροντίου παρουσίαζαν ιδιότητες που διέφεραν από εκείνες σε άλλες πηγές «βαριών σπάρων».[20] Ο γιατρός και συλλέκτης ορυκτών Φρίντριχ Γκαμπριέλ Σούλτσερ ανέλυσε μαζί με τον Γιόχαν Φρίντριχ Μπλούμενμπαχ το ορυκτό από το Στρόντιαν και το ονόμασε στροντιανίτη. Το 1793 ο Τόμας Τσαρλς Χόουπ, καθηγητής χημείας στο Πανεπιστήμιο της Γλασκώβης μελέτησε το ορυκτό[21][22] και πρότεινε το όνομα strontites.[23][24][25] Το στοιχείο τελικά απομονώθηκε από τον Σερ Χάμφρι Ντέιβι το 1808 με την ηλεκτρόλυση ενός μείγματος που περιείχε χλωριούχο στρόντιο και οξείδιο του υδραργύρου, και ανακοινώθηκε από αυτόν σε μια διάλεξη στη Βασιλική Εταιρεία στις 30 Ιουνίου 1808.[26] Σύμφωνα με την ονομασία των άλλων αλκαλικών γαιών, άλλαξε το όνομα σε στρόντιο.[27][28] [29] [30][31]
Η πρώτη μεγάλης κλίμακας εφαρμογή του στροντίου ήταν στην παραγωγή ζάχαρης από ζαχαρότευτλα. Αν και μια διαδικασία κρυστάλλωσης με χρήση υδροξειδίου του στροντίου κατοχυρώθηκε με δίπλωμα ευρεσιτεχνίας από τον Αγκουστίν-Πιερ Ντουμπρανφό το 1849.[32] Η εισαγωγή σε μεγάλη κλίμακα ήρθε με τη βελτίωση της διαδικασίας στις αρχές της δεκαετίας του 1870. Η γερμανική βιομηχανία ζάχαρης χρησιμοποίησε τη διαδικασία μέχρι τον 20ό αιώνα. Πριν από τον Α΄ Παγκόσμιο Πόλεμο, η βιομηχανία ζάχαρης χρησιμοποιούσε 100.000 έως 150.000 τόνους υδροξειδίου του στροντίου για αυτή τη διαδικασία ετησίως.[33] Το υδροξείδιο του στροντίου ανακυκλωνόταν ως μέρος της διαδικασίας, αλλά η ζήτηση για αντικατάσταση των απωλειών κατά την παραγωγή ήταν αρκετά υψηλή ώστε να δημιουργηθεί σημαντική ζήτηση, που ξεκίνησε την εξόρυξη στροντιανίτη στο Μάνστερλαντ. Η εξόρυξη στροντιανίτη στη Γερμανία τελείωσε όταν ξεκίνησε η εξόρυξη των κοιτασμάτων σελεστίνη στο Γκλόστερσαιρ.[34] Τα ορυχεία αυτά παρείχαν το μεγαλύτερο μέρος της παγκόσμιας προμήθειας στροντίου από το 1884 έως το 1941. Αν και τα κοιτάσματα στη λεκάνη της Γρανάδας ήταν γνωστά για κάποιο χρονικό διάστημα, η εξόρυξη μεγάλης κλίμακας δεν ξεκίνησε πριν από τη δεκαετία του 1950.[35]
Κατά τη διάρκεια δοκιμών ατμοσφαιρικών πυρηνικών όπλων, παρατηρήθηκε ότι το στρόντιο-90 είναι ένα από τα προϊόντα πυρηνικής σχάσης με σχετικά υψηλή απόδοση. Η ομοιότητα με το ασβέστιο και η πιθανότητα εμπλουτισμού του στροντίου-90 στα οστά έκανε την έρευνα για τον μεταβολισμό του στροντίου ένα σημαντικό θέμα.[36] [37]

Το στρόντιο εμφανίζεται συνήθως στη φύση, είναι το 15ο πιο άφθονο στοιχείο στη Γη (το βαρύτερο συγγενικό του βάριο είναι το 14ο), που υπολογίζεται κατά μέσο όρο σε περίπου 360 μέρη ανά εκατομμύριο στον φλοιό της Γης [38] και βρίσκεται κυρίως στο θειικό ορυκτό σελεστίνη (SrSO4) και στον ανθρακικό στροντιανίτη (SrCO3). Από τα δύο, ο σελεστίνης εμφανίζεται πολύ πιο συχνά σε κοιτάσματα επαρκούς μεγέθους για εξόρυξη. Επειδή το στρόντιο χρησιμοποιείται συχνότερα σε ανθρακική μορφή, ο στροντιανίτης θα ήταν το πιο χρήσιμο από τα δύο κοινά ορυκτά, αλλά λίγα κοιτάσματα έχουν ανακαλυφθεί που είναι κατάλληλα για ανάπτυξη.[39] Λόγω του τρόπου με τον οποίο αντιδρά με τον αέρα και το νερό, το στρόντιο υπάρχει στη φύση, μόνο όταν συνδυάζεται για να σχηματίσει μέταλλα. Το στρόντιο που απαντάται στη φύση είναι σταθερό, αλλά το συνθετικό του ισότοπο 90Sr παράγεται μόνο από πυρηνική πτώση.
Στα υπόγεια ύδατα το στρόντιο συμπεριφέρεται χημικά όπως το ασβέστιο. Σε ενδιάμεσο έως όξινο pH το κατιόν Sr2+ είναι το κυρίαρχο είδος στροντίου. Με την παρουσία ιόντων ασβεστίου, το στρόντιο συνήθως σχηματίζει συγκαταβύθιση με μέταλλα ασβεστίου όπως ο ασβεστίτης και ο ανυδρίτης σε αυξημένο pH. Σε ενδιάμεσο έως όξινο pH, το διαλυμένο στρόντιο συνδέεται με τα σωματίδια του εδάφους μέσω ανταλλαγής κατιόντων.[40]
Η μέση περιεκτικότητα του νερού των ωκεανών σε στρόντιο είναι 8 mg/L.[41] [42] Σε συγκέντρωση μεταξύ 82 και 90 μmol/L στροντίου, η συγκέντρωση είναι σημαντικά χαμηλότερη από τη συγκέντρωση ασβεστίου, η οποία είναι συνήθως μεταξύ 9,6 και 11,6 mmol/L.[43][44] Ωστόσο, είναι πολύ υψηλότερο από αυτό του βαρίου, 13 μg/L.
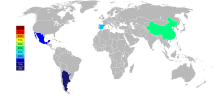
Οι τρεις κύριοι παραγωγοί στροντίου ως σελεστίνη από το 2015 είναι η Κίνα (150.000 t), Ισπανία (90.000 t), και το Μεξικό (70.000 t). Η Αργεντινή (10.000 t) και το Μαρόκο (2.500 t) είναι μικρότεροι παραγωγοί. Αν και τα κοιτάσματα στροντίου υπάρχουν ευρέως στις Ηνωμένες Πολιτείες, δεν έχουν εξορυχθεί από το 1959.
Ένα μεγάλο ποσοστό εξορυσσόμενου σελεστίνη (SrSO4) μετατρέπεται σε ανθρακικό με δύο διαδικασίες. Είτε ο σελεστίνης εκπλένεται απευθείας με διάλυμα ανθρακικού νατρίου, είτε καβουρδίζεται με άνθρακα, για να σχηματιστεί το σουλφίδιο. Το δεύτερο στάδιο παράγει ένα σκουρόχρωμο υλικό που περιέχει κυρίως θειούχο στρόντιο. Αυτή η λεγόμενη «μαύρη τέφρα» διαλύεται σε νερό και φιλτράρεται. Το ανθρακικό στρόντιο καθιζάνει από το διάλυμα θειούχου στροντίου με την εισαγωγή διοξειδίου του άνθρακα.[45] Το θειικό ανάγεται σε θειούχο με την καρβοθερμική αναγωγή:
Περίπου 300.000 τόνοι επεξεργάζονται με αυτόν τον τρόπο ετησίως.
Το μέταλλο παράγεται εμπορικά με αναγωγή του οξειδίου του στροντίου με αργίλιο. Το στρόντιο αποστάζεται από το μείγμα. Το μέταλλο στρόντιο μπορεί επίσης να παρασκευαστεί σε μικρή κλίμακα με ηλεκτρόλυση ενός διαλύματος χλωριούχου στροντίου σε τετηγμένο χλωριούχο κάλιο:[4]

Καταναλώνοντας το 75% της παραγωγής, η κύρια χρήση του στροντίου ήταν στο γυαλί για σωλήνες καθόδου ακτίνων σε έγχρωμες τηλεοράσεις, όπου χρησιμοποιούνταν για να εμποδίζει την εκπομπή ακτίνων Χ.[46][47] Αυτή η εφαρμογή για το στρόντιο έχει μειωθεί, επειδή οι CRT αντικαθίστανται από άλλες μεθόδους απεικόνισης. Αυτή η μείωση έχει σημαντική επίδραση στην εξόρυξη και τη διύλιση του στροντίου.[39] Όλα τα μέρη του CRT πρέπει να απορροφούν τις ακτίνες Χ. Στο λαιμό και στο χωνί του σωλήνα χρησιμοποιείται για το σκοπό αυτό γυαλί μολύβδου, αλλά αυτός ο τύπος γυαλιού εμφανίζει ένα καφετί αποτέλεσμα, λόγω της αλληλεπίδρασης των ακτίνων Χ με το γυαλί. Επομένως, κύρια οθόνη είναι κατασκευασμένη από διαφορετικό μείγμα γυαλιού με στρόντιο και βάριο, για να απορροφά τις ακτίνες Χ. Οι μέσες τιμές για το μείγμα γυαλιού που καθορίστηκαν για μια μελέτη ανακύκλωσης το 2005 είναι 8,5% οξείδιο του στροντίου και 10% οξείδιο του βαρίου.[48]
Επειδή το στρόντιο είναι παρόμοιο με το ασβέστιο, ενσωματώνεται στα οστά. Και τα τέσσερα σταθερά ισότοπα ενσωματώνονται, στις ίδιες περίπου αναλογίες που βρίσκονται στη φύση. Ωστόσο, η πραγματική κατανομή των ισοτόπων τείνει να ποικίλλει πολύ από τη μία γεωγραφική τοποθεσία στην άλλη. Έτσι, η ανάλυση του οστού ενός ατόμου μπορεί να βοηθήσει στον προσδιορισμό της περιοχής από την οποία προέρχεται.[49][50] Αυτή η προσέγγιση βοηθά στον εντοπισμό των αρχαίων προτύπων μετανάστευσης και της προέλευσης των αναμεμειγμένων ανθρώπινων οστών σε τοποθεσίες ταφής στο πεδίο της μάχης.[51]
Τα ισότοπα 87Sr/86Sr χρησιμοποιούνται συνήθως για τον προσδιορισμό των πιθανών περιοχών προέλευσης των ιζημάτων σε φυσικά συστήματα, ειδικά σε θαλάσσια και ποτάμια περιβάλλοντα. Ο Dasch (1969) έδειξε ότι τα επιφανειακά ιζήματα του Ατλαντικού εμφάνισαν αναλογίες 87Sr/86Sr που θα μπορούσαν να θεωρηθούν ως μαζικοί μέσοι όροι των αναλογιών 87Sr/86Sr των γεωλογικών εδαφών από γειτονικές χερσαίες μάζες.[52] Ένα καλό παράδειγμα ενός ποτάμιου-θαλάσσιου συστήματος στο οποίο έχουν χρησιμοποιηθεί επιτυχώς μελέτες προέλευσης ισοτόπων Sr είναι το σύστημα ποταμού Νείλου-Μεσογείου.[53] Λόγω των διαφορετικών ηλικιών των πετρωμάτων που αποτελούν την πλειοψηφία του Γαλάζιου και Λευκού Νείλου, οι λεκάνες απορροής της μεταβαλλόμενης προέλευσης των ιζημάτων, που φτάνουν στο Δέλτα του ποταμού Νείλου και στην Ανατολική Μεσόγειο, μπορούν να διακριθούν μέσω ισοτοπικών μελετών στροντίου. Τέτοιες αλλαγές ελέγχονται κλιματικά στην Ολόκαινο εποχή.[53]
Πιο πρόσφατα, αναλογίες 87Sr/86Sr χρησιμοποιήθηκαν επίσης για τον προσδιορισμό της πηγής αρχαίων αρχαιολογικών υλικών, όπως ξυλεία και καλαμπόκι στο Φαράγγι Τσάκο στο Νέο Μεξικό.[54] [55] Οι αναλογίες 87Sr/86Sr στα δόντια μπορούν επίσης να χρησιμοποιηθούν για την παρακολούθηση μεταναστεύσεων ζώων.[56][57]
Το αργιλικό στρόντιο χρησιμοποιείται συχνά για φωσφορίζοντα παιχνίδια, καθώς είναι χημικά και βιολογικά αδρανές.

Το ανθρακικό στρόντιο και άλλα άλατα στροντίου προστίθενται στα πυροτεχνήματα για να δώσουν ένα βαθύ κόκκινο χρώμα.[58] Αυτό το ίδιο αποτέλεσμα προσδιορίζει κατιόντα στροντίου στη δοκιμή φλόγας. Τα πυροτεχνήματα καταναλώνουν περίπου το 5% της παγκόσμιας παραγωγής. Το ανθρακικό στρόντιο χρησιμοποιείται στην κατασκευή μαγνητών σκληρού φερρίτη.[59] [60]
Το χλωριούχο στρόντιο χρησιμοποιείται μερικές φορές σε οδοντόκρεμες για ευαίσθητα δόντια. Μια δημοφιλής μάρκα περιλαμβάνει 10% ολικό εξαένυδρο χλωριούχο στρόντιο κατά βάρος.[61] Μικρές ποσότητες χρησιμοποιούνται στη διύλιση ψευδαργύρου για την απομάκρυνση μικρών ποσοτήτων ακαθαρσιών μολύβδου.
Η εξαιρετικά στενή οπτική μετάβαση μεταξύ της ηλεκτρονικής βασικής κατάστασης [Kr]5s2 1S0 και της μετασταθερής [Kr]5s5p 3P0 διεγερμένης κατάστασης του 87Sr είναι ένας από τους κορυφαίους υποψηφίους για τον μελλοντικό επαναπροσδιορισμό του δευτερολέπτου στο όριο μιας οπτικής μετάβασης σε αντίθεση με τον τρέχοντα ορισμό που προέρχεται από μια μετάβαση μικροκυμάτων μεταξύ διαφορετικών υπερλεπτών θεμελιωδών καταστάσεων 133Cs.[62] Τα τρέχοντα οπτικά ατομικά ρολόγια που λειτουργούν σε αυτή τη μετάβαση ξεπερνούν ήδη την ακρίβεια και την ακρίβεια του τρέχοντος ορισμού του δευτερολέπτου.
Το 89Sr είναι το δραστικό συστατικό του Metastron,[63] ενός ραδιοφαρμάκου που χρησιμοποιείται για τον πόνο των οστών δευτερογενές σε μεταστατικό καρκίνο των οστών. Το στρόντιο επεξεργάζεται όπως το ασβέστιο από το σώμα, ενσωματώνοντάς το κατά προτίμηση στα οστά σε σημεία αυξημένης οστεογένεσης. Αυτός ο εντοπισμός εστιάζει την έκθεση στην ακτινοβολία στην καρκινική βλάβη.[16]

Το 90Sr έχει χρησιμοποιηθεί ως πηγή ενέργειας για θερμοηλεκτρικές γεννήτριες ραδιοϊσοτόπων (RTG). Το 90Sr παράγει περίπου 0,93 watt θερμότητας ανά γραμμάριο (είναι χαμηλότερο για τη μορφή 90Sr που χρησιμοποιείται σε RTG, το οποίο είναι φθοριούχο στρόντιο).[64] Ωστόσο, το 90Sr έχει το ένα τρίτο της διάρκειας ζωής και χαμηλότερη πυκνότητα από το 238Pu, ένα άλλο καύσιμο RTG. Το κύριο πλεονέκτημα του 90Sr είναι ότι είναι φθηνότερο από 238Pu και βρίσκεται στα πυρηνικά απόβλητα. Η Σοβιετική Ένωση ανέπτυξε σχεδόν 1.000 από αυτούς τους RTG στη βόρεια ακτή της ως πηγή ενέργειας για φάρους και μετεωρολογικούς σταθμούς.[65] [66]
Τα Ακανθάρια, μια σχετικά μεγάλη ομάδα θαλάσσιων ακτινολαρίων πρωτόζωων, παράγει περίπλοκους ορυκτούς σκελετούς, που αποτελούνται από θειικό στρόντιο.[67] Στα βιολογικά συστήματα, το ασβέστιο υποκαθίσταται σε μικρότερο βαθμό από το στρόντιο.[68] Στο ανθρώπινο σώμα, το μεγαλύτερο μέρος του απορροφούμενου στροντίου εναποτίθεται στα οστά. Η αναλογία στροντίου προς ασβέστιο στα ανθρώπινα οστά είναι μεταξύ 1:1000 και 1:2000, περίπου στο ίδιο εύρος όπως στον ορό του αίματος.[69]
Το ανθρώπινο σώμα απορροφά το στρόντιο, σαν να ήταν το ελαφρύτερο συγγενικό του ασβέστιο. Επειδή τα στοιχεία είναι χημικά πολύ παρόμοια, τα σταθερά ισότοπα στροντίου δεν αποτελούν σημαντική απειλή για την υγεία. Ο μέσος άνθρωπος λαμβάνει περίπου δύο χιλιοστόγραμμα στροντίου την ημέρα.[70] Στους ενήλικες, το στρόντιο που καταναλώνεται τείνει να προσκολλάται μόνο στην επιφάνεια των οστών, αλλά στα παιδιά, το στρόντιο μπορεί να αντικαταστήσει το ασβέστιο στο μέταλλο των αναπτυσσόμενων οστών, και έτσι να οδηγήσει σε προβλήματα ανάπτυξης των οστών.[71]
Ο βιολογικός χρόνος ημιζωής του στροντίου στον άνθρωπο έχει αναφερθεί ποικιλοτρόπως από 14 έως 600 ημέρες,[72][73] 1.000 ημέρες,[74] 18 χρόνια,[75] 30 χρόνια [76] και 49 χρόνια, σε ανώτατο όριο.[77] Τα ευρέως δημοσιευμένα στοιχεία βιολογικού χρόνου ημιζωής εξηγούνται από τον πολύπλοκο μεταβολισμό του στροντίου μέσα στο σώμα. Ωστόσο, με τον μέσο όρο όλων των μονοπατιών απέκκρισης, ο συνολικός βιολογικός χρόνος ημιζωής εκτιμάται ότι είναι περίπου 18 χρόνια.[78] Ο ρυθμός αποβολής του στροντίου επηρεάζεται έντονα απ' την ηλικία και το φύλο, λόγω των διαφορών στον μεταβολισμό των οστών.[79]
Το φάρμακο ρανελικό στρόντιο βοηθά την ανάπτυξη των οστών, αυξάνει την οστική πυκνότητα και μειώνει τη συχνότητα των καταγμάτων των σπονδύλων, των περιφερικών και του ισχίου.[80][81] Ωστόσο, το ρανελικό στρόντιο αυξάνει επίσης τον κίνδυνο φλεβικής θρομβοεμβολής, πνευμονικής εμβολής και σοβαρών καρδιαγγειακών διαταραχών, συμπεριλαμβανομένου του εμφράγματος του μυοκαρδίου. Επομένως, η χρήση του είναι πλέον περιορισμένη.[82] Οι ευεργετικές του επιδράσεις είναι επίσης αμφισβητήσιμες, αφού η αυξημένη οστική πυκνότητα προκαλείται, εν μέρει, από την αυξημένη πυκνότητα του στροντίου, έναντι του ασβεστίου που αντικαθιστά. Το στρόντιο βιοσυσσωρεύεται επίσης στο σώμα.[83] Παρά τους περιορισμούς στο ρανελικό στρόντιο, το στρόντιο εξακολουθεί να περιέχεται σε ορισμένα συμπληρώματα.[84] [85] Δεν υπάρχουν πολλά επιστημονικά στοιχεία σχετικά με τους κινδύνους του χλωριούχου στροντίου, όταν λαμβάνεται από το στόμα. Όσοι έχουν προσωπικό ή οικογενειακό ιστορικό διαταραχών πήξης του αίματος συνιστάται να αποφεύγουν το στρόντιο.[84] [85]
Το στρόντιο έχει αποδειχθεί ότι αναστέλλει τον αισθητηριακό ερεθισμό, όταν εφαρμόζεται τοπικά στο δέρμα.[86] [87] Εφαρμόζεται τοπικά, το στρόντιο έχει αποδειχθεί ότι επιταχύνει τον ρυθμό αποκατάστασης του φραγμού επιδερμικής διαπερατότητας (φραγμός δέρματος).[88]
Το στρόντιο-90 είναι ένα προϊόν ραδιενεργούς σχάσης που παράγεται από πυρηνικούς αντιδραστήρες που χρησιμοποιούνται στην πυρηνική ενέργεια. Αποτελεί σημαντικό συστατικό της υψηλής ραδιενέργειας των πυρηνικών αποβλήτων και των αναλωμένων πυρηνικών καυσίμων. Η ημιζωή του 29 ετών είναι αρκετά μικρή ώστε η θερμότητα αποσύνθεσής του να έχει χρησιμοποιηθεί για την τροφοδοσία αρκτικών φάρων, αλλά αρκετά μεγάλη ώστε μπορεί να χρειαστούν εκατοντάδες χρόνια για να αποσυντεθεί σε ασφαλή επίπεδα. Η έκθεση από μολυσμένο νερό και τρόφιμα μπορεί να αυξήσει τον κίνδυνο λευχαιμίας, καρκίνου των οστών[89] και πρωτοπαθούς υπερπαραθυρεοειδισμού.[90]
Τα φύκια έχουν δείξει επιλεκτικότητα για το στρόντιο σε μελέτες, όπου τα περισσότερα φυτά που χρησιμοποιούνται στη βιοαποκατάσταση δεν έχουν δείξει επιλεκτικότητα μεταξύ ασβεστίου και στροντίου, συχνά κορεσμένα με ασβέστιο, το οποίο είναι μεγαλύτερο σε ποσότητα και επίσης υπάρχει στα πυρηνικά απόβλητα.[89]
Οι ερευνητές εξέτασαν τη βιοσυσσώρευση στροντίου από το Scenedesmus spinosus (φύκια) σε προσομοιωμένα λύματα. Η μελέτη υποστηρίζει μια εξαιρετικά επιλεκτική ικανότητα βιοπροσρόφησης για το στρόντιο του S. spinosus, υποδηλώνοντας ότι μπορεί να είναι κατάλληλο για χρήση πυρηνικών λυμάτων.[91]
Μια μελέτη του άλγης της λίμνης Closterium moniliferum χρησιμοποιώντας μη ραδιενεργό στρόντιο διαπίστωσε ότι η μεταβολή της αναλογίας βαρίου προς στρόντιο στο νερό βελτίωσε την εκλεκτικότητα του στροντίου.[89]
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||