Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.

Eine Peptidbindung ist eine Carbonsäureamid-Bindung, die zwei Aminosäuren über die Carboxygruppe der einen Aminosäure und die Aminogruppe der anderen Aminosäure verknüpft.[1]
Meistenfalls ist mit Peptidbindung im engeren Sinn die Bindung zwischen den jeweiligen α-ständigen funktionellen Gruppen zweier Aminosäuren gemeint, also zwischen C-1 der einen Aminosäure und N-2 der anderen Aminosäure. Diese Bindung wird selten auch Eupeptidbindung genannt und unterscheidet sich von der Isopeptidbindung.[1]
Die Bindung entsteht durch eine Kondensationsreaktion unter Wasserabspaltung.[2] Ein Beispiel ist die Reaktion von zwei Molekülen der Aminosäure Alanin zu dem Dipeptid Alanyl-Alanin:
Die Aminogruppe fungiert in der Reaktion als Nukleophil und ersetzt die Hydroxygruppe unter Bildung der Peptidbindung. Da die Hydroxygruppe eine schlechte Abgangsgruppe ist und sich schwer verdrängen lässt, liegt das Gleichgewicht unter Normbedingungen auf der linken Seite.[2] Die chemische Reaktion ist endergon.
Sowohl bei der Peptidsynthese im Labor als auch bei der biologischen Synthese von Peptiden und Proteinen müssen die reaktiven Gruppen zuerst aktiviert werden. Dies geschieht in biologischen Systemen zumeist durch Enzyme. Bei der Proteinbiosynthese in einer Zelle wird diese Reaktion während der Translation von den Ribosomen katalysiert. Daneben kommen bei manchen Organismen zusätzlich auch nichtribosomale Peptidsynthetasen (NRPS) als Enzyme vor, die eine nichtribosomale Peptidsynthese ermöglichen.

Durch mehrfache Kondensation können weitere Aminosäuren (AS) per Peptidbindung verknüpft werden. So entstehen aus Dipeptiden (2 AS) dann Tripeptide (3), Tetrapeptide (4), Pentapeptide (5), Hexapeptide (6), Heptapeptide (7), Oktapeptide (8), Nonapeptide (9) etc., wobei solche Peptide aus wenigen Aminosäuren, Oligopeptide genannt, von noch größeren Peptiden aus vielen Aminosäuren, Polypeptide genannt, unterschieden werden. Die kettenförmig aus zahlreichen Aminosäuren aufgebauten Polypeptide gehören zu den Makromolekülen.
Polypeptidketten aus verschiedenen Aminosäuren bilden das primäre Strukturelement von Proteinen und werden durch ihre Aminosäuresequenz charakterisiert. Zu Primär-, Sekundär- und Tertiärstrukturen von Peptiden und Proteinen siehe Proteinstruktur.
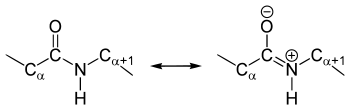
Die Kristallstrukturanalysen von Aminosäuren und Dipeptiden zeigen, dass die Amidgruppe planar ist, alle am Aufbau beteiligten Atome liegen also in einer Ebene. Der Diederwinkel (HNCO) liegt bei 180° und die Atome können wegen Mesomeriestabilisierung nicht gegeneinander verdreht werden – die Peptidbindung ist dadurch nur begrenzt rotationsflexibel. Diese eingeschränkte Drehbarkeit ist in einem Ramachandran-Plot oder einem Janin-Plot darstellbar. Die Rotation um die Cα-N-Bindung wird dabei durch den Winkel Φ, die Rotation um die Cα-C-Bindung durch den Winkel ψ beschrieben.[3]

In den nativen Proteinen liegen vorwiegend trans-Peptidbindungen vor, cis-Peptidbindungen finden sich vor allem in cyclischen Dipeptiden (Diketopiperazine) und cyclischen Tripeptiden (Beispiel: Cyclotriprolyl).[4] Der Grund für das häufigere Auftreten von trans-Peptidbindungen sind die sterischen Hinderungen zwischen den Gruppen am α-C-Atom bei cis-Peptidbindungen, die bei der trans-Konfiguration nicht auftreten.[5]

Die Bindungslängen sind zwischen Stickstoff und Carbonyl-Kohlenstoff 133 pm, zwischen Stickstoff und α-C-Atom 146 pm, zwischen Carbonyl-Kohlenstoff und α-C-Atom 151 pm und zwischen Carbonyl-Kohlenstoff und Sauerstoff 124 pm.[6] Die geringere Länge der C-N-Bindung in der Amidbindung im Vergleich zur normalen C-N-Bindung weist darauf hin, dass sie Doppelbindungscharakter besitzt; diese Art der chemischen Bindung wird auch partielle Doppelbindung genannt. Diese Besonderheit findet ihre Erklärung in der Amid-Iminol-Tautomerie der Peptidbindung.

Durch die Reaktion der Carboxygruppe einer Aminosäure und der Aminogruppe einer zweiten Aminosäure bildet sich unter Wasserabspaltung eine Peptidbindung. Jede Peptidbindung ist auch eine Amidbindung.
Voraussetzung für die Bildung einer Peptidbindung ist die Kondensationsreaktion der endständigen Carboxygruppe am C1-Atom mit der Aminogruppe am α-C-Atom einer zweiten Aminosäure. Jede andere Kondensation zwischen Carboxygruppe und Aminogruppe führt auch zu einer Amidbindung, die aber keine Peptidbindung ist.
Werden Peptide mittels Peptidbindungen verlängert, so reagieren die endständigen Carboxy- oder Aminogruppen am α-C-Atom mit weiteren Aminosäuren.