Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| GLUT-4 | ||
|---|---|---|
| ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 509 Aminosäuren | |
| Sekundär- bis Quartärstruktur | multipass (12 TMS) Membranprotein | |
| Bezeichner | ||
| Gen-Name | SLC2A4 | |
| Externe IDs | ||
| Transporter-Klassifikation | ||
| TCDB | 2.A.1.1 | |
| Bezeichnung | Major-Facilitator-Superfamilie / Glucosetransporter | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Säugetiere[1] | |
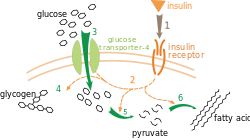
GLUT-4 (Glucosetransporter Typ 4) (Gen: SLC2A4) ist ein Protein, das besonders in Vesikeln in Säugetier-Zellen lokalisiert ist. Bei GLUT-4 handelt es sich um ein Membran-Transportprotein. Beim Menschen wird GLUT-4 in gestreiften Muskel- und Fettzellen exprimiert. Eine der Konsequenzen des Andockens von Insulin an den Insulinrezeptor ist, dass sich die GLUT-4-Vesikel mit der Zellmembran vereinen und somit die Einschleusung von Glucose in die Zelle angekurbelt wird. Mutationen im GLUT4-Gen können zu GLUT-4-Mangel und dieser zu einer (seltenen) erblichen Form des Diabetes mellitus Typ 2 führen.[2]
Bei niedrigem Insulinlevel wandern die GLUT-4-Vesikel langsam zu den Endosomen und werden dort abgebaut. Steigt der Blutzuckerspiegel an, steigt auch der Insulinspiegel. Insulin vermittelt die Fusion der Vesikel mit der Plasmamembran. Nach Umlenkung der Vesikel zur Außenmembran durch Insulin-Signaltransduktion kann die Glucoseaufnahme der Zelle schnell auf den 20- bis 50-fachen Wert steigen. Danach werden die Transporter durch Endozytose wieder aufgenommen und können erneut verwendet werden. In den Fettzellen kann die Glucose dann in Triacylglycerine umgewandelt, in Muskelzellen in Form von Glykogen, gespeichert werden. GLUT-4 hat große Ähnlichkeit mit GLUT-1, kann jedoch kein DHA transportieren.[3]
Die Glucoseaufnahme von Muskelzellen wird über die Anzahl der GLUT-4-Moleküle in der Membran und gleichzeitig die Häufigkeit ihres Recycling mittels Endozytose reguliert. Außerdem kann sich die Aktivität des Transporters verändern. Die Anzahl der GLUT-4-Transporter wird dabei hauptsächlich durch die Wirkungen des Insulin erhöht. Die Recyclingrate kann durch Muskelkontraktion, -depolarisierung oder Energiemangel gebremst werden. Die Aktivität ist erniedrigt, wenn die Enzyme Glycerinaldehyd-3-phosphat-Dehydrogenase oder Hexokinase II an GLUT-4 binden.[4][5][6]