Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Cytochrom-c-Oxidase | ||
|---|---|---|
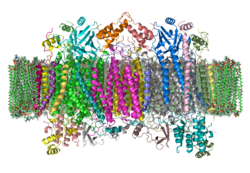
| ||
| Bändermodell eines Cytochrom-c-Oxidase-Dimers vom Rind in der Membran nach PDB 1OCC | ||
| Transporter-Klassifikation | ||
| TCDB | 3.D.4.7.1 | |
| Bezeichnung | protonenübertragende COX | |
| Enzymklassifikation | ||
| EC, Kategorie | 1.9.3.1, Oxidoreduktase | |
| Reaktionsart | Redoxreaktion | |
| Substrat | 4 Cytochrom c (reduziert) + O2 + 8 H+(in) | |
| Produkte | 4 Cytochrom c (oxidiert) + 2 H2O + 4 H+(out) | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
| Übergeordnet |
|---|
| Atmungskette-Komplex |
| Gene Ontology |
| QuickGO |
Das Enzym Cytochrom-c-Oxidase (COX), genauer Cytochrom c: Sauerstoff-Oxidoreduktase (systematischer Name), Cytochrom-aa3-Komplex oder auch Komplex IV der mitochondrialen Atmungskette („Zellatmung“) genannt, ist eine früher als Atmungsferment bezeichnete Oxidoreduktase. Der bei Bakterien aus drei, bei Eukaryoten aus dreizehn Untereinheiten bestehende Enzymkomplex katalysiert in einer gekoppelten Reaktion die Oxidation von Cytochrom c mit der Reduktion von Sauerstoff zu Wasser und dem Transport von Protonen über eine biologische Membran.
Mutationen in den Genen, die für die einzelnen Untereinheiten codieren (MT-CO1, MT-CO2, MT-CO3) können seltene Erbkrankheiten verursachen, die unter Cytochrom-c-Oxidasemangel (MT-C4D) zusammengefasst werden, nämlich Optikus-Neuropathie Typ Leber (LHON), rekurrente Myoglobinurie, sowie mitochondriale nichtsyndromale sensorineurale Schwerhörigkeit.[1][2][3]
Die Cytochrom-c-Oxidase gehört zur Superfamilie der Häm-Kupfer-Oxidasen, die bei allen aerob atmenden Organismen den terminalen Elektronenakzeptor der Atmungskette darstellen. Sie sind für nahezu sämtlichen Sauerstoffverbrauch der atmenden Organismen verantwortlich. Die Oxidasen sind bei Eukaryoten in der inneren Mitochondrienmembran, bei Prokaryoten in der inneren Zellmembran eingelagert. Varianten der Cytochrom-c-Oxidase kommen in der Zellmembran aerober Bakterien vor. Diese enthalten zum Teil modifizierte Kofaktoren (Häm-Varianten), oder verwenden andere Elektronendonoren als Cytochrom c (Chinol-Oxidasen z. B. in Escherichia coli). Sie besitzen sämtlich große strukturelle und funktionelle Homologie und enthalten im aktiven Zentrum eine Häm-Gruppe und ein Kupfer-Ion.
Erste bedeutende Studien über die Atmungsfermente und die Zellatmung führte ab 1908 Otto Warburg durch.[4]
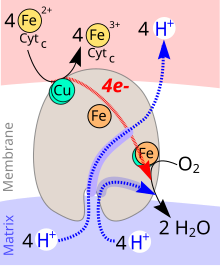
Die Transportgleichung lautet:[5]
4 Cytc(Fe2+) + O2 + 8 H+innen → 4 Cytc(Fe3+) + 2 H2O + 4 H+außen
Die Funktion der Cytochrom-c-Oxidase besteht aus der
Während des katalytischen Zyklus der Cytochrom-c-Oxidase wird ein Molekül Sauerstoff (O2) zu zwei Molekülen Wasser (H2O) reduziert. Als Reduktionsmittel werden vier Elektronen (e−) von vier Molekülen Cytochrom c sowie Protonen (H+) für die Wasserbildung aus dem Innenraum des Mitochondriums (Matrix) gebraucht. Die bei der Reduktion von Sauerstoff zu Wasser freigesetzte Energie wird zum Aufbau eines Protonengradienten über die innere Mitochondrienmembran genutzt. Pro Reaktionszyklus werden vier Protonen aus dem Innenraum des Mitochondriums in den Intermembranraum transportiert.
Über das komplexe Zusammenspiel der ablaufenden Sauerstoffchemie, der Elektronentransferreaktionen, sowie den Protonenaufnahme- und Pumpschritten und deren genauen zeitlichen Abfolgen konnten in letzter Zeit einige Vorstellungen entwickelt werden. In Abb. 3 und 4 finden sich Modelle über die Abfolge der Redoxreaktionen und der Mechanik des Pumpmechanismus.[6][7]
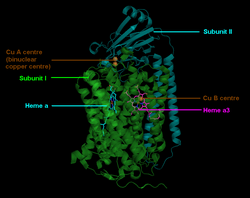
Die Cytochrom c Oxidase ist ein Membranprotein. Es enthält verschiedene metallische prosthetische Gruppen:[8]
Das CuA befindet sich an der Bindungsstelle für Cytochrom c. Nach dessen Oxidation wird das Elektron über Cytochrom a zu Cytochrom a3 weitergeleitet, wo es zusammen mit CuB die O2-Reduktion katalysiert. Der Ablauf ist im Einzelnen in Abb. 3 dargestellt.


Das Enzym leistet nicht nur in Mitochondrien, sondern auch in einer Vielzahl von aeroben Prokaryoten einen wichtigen Beitrag zum Energiestoffwechsel, indem es als Protonenpumpe zum Aufbau eines chemiosmotischen Potentials beiträgt.
Bei der Oxidation von vier Cytochromc-Molekülen werden 4 Protonen transloziert. Jede dieser Reaktionen läuft (vereinfacht gesagt) nach demselben Mechanismus ab. Er ist rechts in Abb. 4 in vier Phasen (1–4) dargestellt.
Der mitochondriale Enzymkomplex IV in Säugetieren besteht aus 13 Untereinheiten,[9] von denen die Untereinheiten I–III mitochondrial und die weiteren Untereinheiten IV–XIII vom Nukleus kodiert sind. Die Untereinheit I besitzt die drei redoxaktiven Metallzentren Häm a, Häm a3 und CuB. Häm a3 und CuB bilden zusammen das katalytisch aktive Zentrum, an dem Sauerstoff gebunden und zu Wasser reduziert wird. Die Untereinheit II besitzt das redoxaktive Metallzentrum CuA, das Elektronen vom Cytochrom c aufnimmt, die dann zum Häm a und weiter zum Häm a3 transferiert werden.
Der Komplex IV beim Menschen im Detail:
| Anzahl | Gen-Name | UniProt | Größe (aa) |
OMIM | Kommentar |
|---|---|---|---|---|---|
| 1 | MT-CO1 | P00395 | 513 | 516030 | Katalytische Untereinheit; Häm, Cu2+; Membrandomänen; pathologische Mutationen |
| 2 | MT-CO2 | P00403 | 227 | 516040 | Cu2+; Membrandomänen; pathologische Mutationen |
| 1 | MT-CO3 | P00414 | 261 | 516050 | Membrandomänen; pathologische Mutationen |
| 1 | COX4I1 | P13073 | 169 | 123864 | |
| 1 | COX5A | P20674 | 150 | 603773 | Häm A |
| 1 | COX5B | P10606 | 98 | 123866 | Zn2+ |
| 1 | COX6A1 | P12074 | 85 | 602072 | |
| 1 | COX6B1 | P14854 | 85 | 124089 | Pathologische Mutationen |
| 1 | COX6C1 | P09669 | 74 | 124090 | Membrandomäne |
| 1 | COX7A2L | O14548 | 59 | 605771 | |
| 1 | COX7B | P24311 | 56 | 603792 | Membrandomäne |
| 1 | COX7C | P15954 | 47 | 603774 | Membrandomäne |
| 1 | COX8A | P10176 | 44 | 123870 | Membrandomäne |
Cyanide, Kohlenmonoxid, Schwefelwasserstoff und Azide sind Inhibitoren der Cytochrom-c-Oxidase. Sie blockieren die Bindungsstelle für Sauerstoff im aktiven Zentrum.
Zum Nachweis des Enzyms Cytochrom-c-Oxidase in Zellen wird der Oxidase-Test verwendet.
Weitere Enzymkomplexe der Atmungskette: