Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.

Un grup funcional, o grup característic, és un àtom, o un grup d'àtoms que confereixen propietats químiques semblants quan són presents en diferents composts orgànics. Defineix les propietats físiques i químiques característiques de les famílies o classes de composts orgànics.[1]
El concepte de grup funcional és fonamental en la sistemàtica orgànica i té un gran paper en la nomenclatura, però no hi ha acord general sobre el seu abast. La Unió Internacional de Química Pura i Aplicada (IUPAC) el defineix com heteroàtom, per exemple , i ; heteroàtom que conté un o més àtoms d’hidrogen o altres heteroàtoms, com ara , , , i , o bé grup heteroatòmic unit a un àtom de carboni o que el conté, com ara , , i , unit a un hidrur fonamental.[2]

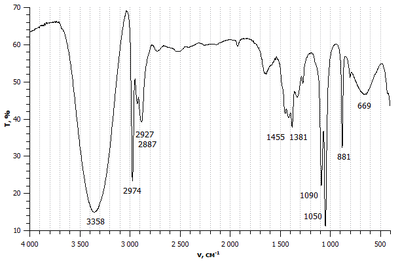
Les propietats físiques dels composts orgànics, com ara punts de fusió i ebullició, solubilitat, densitat, bandes en els espectres infraroigs… que presenten el mateix grup funcional són semblants i varien regularment amb el nombre d'àtoms de carboni de la cadena a la qual vagi unit el grup funcional. Per exemple, els punts d'ebullició dels alcohols que presenten el grup funcional hidroxi , des del metanol al pentanol, són 64,7 °C, 78,3 °C, 97,2 °C, 117,7 °C i 138,0 °C. Hom hi observa que tots estan en una mateixa zona de temperatures i una clara tendència a incrementar-se en augmentar el nombre de carbonis. També en la sèrie de les cinc primeres amines primàries, amb el grup funcional amino els punts de fusió estan a la mateixa zona i presenten una tendència a augmentar, però no tan regular. Els valors són: –94 °C, –84 °C, –83 °C, –51 °C i –55 °C.[3] Un exemple diferent és la intensa banda d'absorció a l'espectre infraroig característica de tots els alcohols i fenols. Aquesta banda apareix entre els nombres d'ona de 3 700 cm–1 i 3 584 cm–1 i és deguda al grup hidroxi .[4]
Els grups funcionals o característics solen ser la part més reactiva de les molècules dels composts orgànics. Una mateixa molècula pot contenir-ne més d’un, i poden ser idèntics o bé diferents.[5] El grup funcional aporta reactivitat a la molècula perquè li introdueix o bé certa polaritat, la qual cosa fa que sigui susceptible d'un atac nucleòfil o electròfil, o bé enllaços més febles. Aquests enllaços poden ser els enllaços entre el carboni de la cadena hidrocarbonada i l'àtom del grup funcional, com l'enllaç σ carboni-oxigen dels alcohols, o bé l'enllaç entre els àtoms que componen el grup funcional, com l'enllaç π d'un grup carbonil ), en tenir energies d'enllaç més baixes que la dels enllaços carboni-carboni i carboni-hidrogen de la cadena hidrocarbonada.[6]
Les propietats químiques de tots els composts orgànics amb un mateix grup funcional (famílies o classes de composts) són semblants, només hi ha petites variacions segons la cadena de carbonis a la qual està enllaçat el grup funcional. La presència d'altres grups funcionals fa que les propietats químiques presentin més diferències. Per exemple, les amines són bases de Brønsted, i presenten uns valors de la constant d'equilibri Kb molt semblants: Kb(metanamina) = 4,4 × 10–4, Kb(etanamina) = 5,6 × 10–4, Kb(propan-1-amina) = 4,7 × 10–4, Kb(butan-1-amina) = 4,1 × 10–4. Un altre exemple és l'esterificació de Fischer, una reacció que té lloc entre alcohols i àcids carboxílics per donar un èster, independentment de les cadenes de carbonis de cadascun dels reactius:[3]

Els grups funcionals més comuns, per ordre decreixent de prioritat a l’hora de seleccionar-los i anomenar-los com a grup característic principal en el nom d'un compost orgànic, són:
| Grup funcional | Classe de compost | Fórmula del compost |
Fórmula desenvolupada |
Prefix | Sufix |
|---|---|---|---|---|---|
| Grup carboxi | Àcid carboxílic | R-COOH | 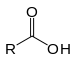
|
carboxi- | -ic |
| Grup acil | Anhídrid d'àcid | (RCO)₂O | 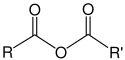 |
Anhídrid -ic | _ |
| Grup alcoxicarbonil o ariloxicarbonil Grup acil |
Èster | R-COO-R' | -iloxicarbonil- (-COOR) | Segons l'alcohol i àcid de procedència: alquilat d'alquil | |
| Grup acil | Halur d'àcid | -COX | 
|
Haloformil- | Halur de -oil |
Grup acil |
Amida | R-C(=O)N(-H)-R' | 
|
amido- | Segons l'amina i àcid de procedència: alquil alcanamida |
| Grup nitril | Nitril o cianur | R-CN | ciano- | alquilnitril | |
| Grup carbonil | Aldehid | R-C(=O)H | 
|
oxo- | -al |
| Cetona | R-C(=O)-R' | 
|
oxo- | -ona | |
| Grup hidroxi | Alcohol | R-OH | hidroxi- | -ol | |
| Grup amino | Amina | NR₃ | 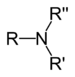
|
amino- | -amina |
| _ | Hidrazina | R₂N-NR₂ | _ | _ | |
| Grup alcoxi o ariloxi |
Èter | R-O-R' | alquiloxi o ariloxi | Segons l'alcohol de procedència: alquil alquil èter |
Altres grups funcionals que contenen àtoms de nitrogen són:
| Grup funcional |
Classe de compost |
Fórmula | Fórmula desenvolupada |
Prefix | Sufix |
|---|---|---|---|---|---|
| Grup imino | Imina | RR″C=NR′ | 
|
-imina | |
| Grup isocianur | Isocianur | R-NC | isociano- | alquilisonitril | |
| _ | Hidroxilamina | -NOH | 
|
hidroxiamino-, alcoxiamino- o (ariloxi)amino- |
_ |
| Grup azo | Compost azo | R-N=N-R' | _ | _ | |
| Grup diazo | Compost diazo | R=N+=N- | 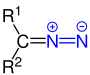
|
diazo- | _ |
| _ | Sal de diazoni | -N+≡N | _ | -diazoni | |
| Grup nitro | Nitro | R-NO₂ | 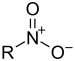
|
nitro- | _ |
| Grup isocianat | Isocianat | R-NCO | isocianato- | alquilisocianat | |
| _ | Azida | -N=N+=N- | azido- | _ | |
| Grup imido | Imida | –CO–NH–CO– | 
|
‑imida» o ‑dicarboximida | |
| Hidrazida | -OC-NH-NH | 
|
‑ohidrazida ‑carbohidrazida |
Altres grups funcionals que contenen àtoms de sofre:
| Grup funcional | Classe de compost | Fórmula | Fórmula desenvolupada |
Prefix | Sufix |
|---|---|---|---|---|---|
| _ | Tioèter o sulfur | R-S-R' | _ | ||
| _ | Tiol | R-SH | _ | ||
| _ | Sulfòxid | R-SO-R' | 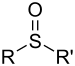
|
_ | |
| _ | Sulfona | R-SO₂-R' | 
|
_ | |
| _ | Àcid sulfònic | RSO₃H | 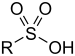
|
_ | |
| Grup isotiocianat | Isotiocianat | R-NCS | isotiocianato- | alquilisotiocianat |
| Terme | Fórmula | Fórmula
desenvolupada |
Prefix | Sufix |
|---|---|---|---|---|
| Fosfodièster | R-OP(=O)₂O-R' | _ | _ | _ |
| Piridil | R-C₅H₄N |  
|
_ | _ |
| Núm. | Compost |
|---|---|
| 1 | Àcids (per aquest ordre: COOH, C(O)O2 H; llurs tio- i selenoderivats; àcids sulfònics, sulfínics, selenònics, etc.; fosfònics, arsònics, etc.). |
| 2 | Anhídrids. |
| 3 | Èsters. |
| 4 | Halogenurs d’àcid. |
| 5 | Amides. |
| 6 | Hidrazides. |
| 7 | Imides. |
| 8 | Nitrils. |
| 9 | Aldehids, seguits per tioaldehids, selenoaldehids i tel·luroaldehids. |
| 10 | Cetones, seguides per tiocetones, selenocetones i tel·lurocetones. |
| 11 | Alcohols i fenols, seguits per tiols, selenols i tel·lurols. |
| 12 | Hidroperòxids, seguits per tiohidroperòxids, selenohidroperòxids i tel·lurohidroperòxids. |
| 13 | Amines. |
| 14 | Imines. |
| 15 | Hidrazines, fosfans, etcètera. |
| 16 | Èters, seguits per sulfurs, selenurs i tel·lururs. |
| 17 | Peròxids, seguits per disulfurs, diselenurs i ditel·lururs. |