Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Аміяк | |

| |
| |
| Агульныя | |
|---|---|
| Хім. формула | NH3 |
| Фізічныя ўласцівасці | |
| Стан (ст. ум.) | газ |
| Адн. малек. маса | 17.0306 а. а. м. |
| Малярная маса | 17.0306 г/моль |
| Шчыльнасць | 0.0007723 (з.у.) |
| Тэрмічныя ўласцівасці | |
| Тэмпература плаўлення | -77.73 °C |
| Тэмпература кіпення | -33.34 °C |
| Крытычны пункт | 132.25 °C |
| Энтальпія ўтварэння (ст. ум.) | -45.94 кДж/моль |
| Хімічныя ўласцівасці | |
| pKa | 9.21 |
| Растваральнасць у вадзе | 89.9 (пры 0°C) |
| Класіфікацыя | |
| Рэг. нумар CAS | [] |
| PubChem | |
| Рэг. нумар EINECS | 231-635-3 |
| SMILES | |
| RTECS | BO0875000 |
| ChemSpider | |
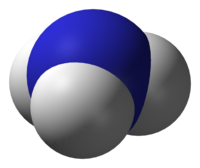
Аміяк, NH3, нітрыд вадароду — прасцейшае[1] хімічнае злучэнне азоту з вадародам.
Пры нармальных умовах бескаляровы газ з рэзкім характэрным пахам (пах нашатырнага спірту), амаль удвая лягчэй за паветра, вельмі атрутны. Растваральнасць NH3 у вадзе надзвычай вялікая — каля 1200 аб'ёмаў (пры 0 °C) або 700 аб'ёмаў (пры 20 °C) у аб'ёме вады. Малекула аміяку мае форму трыганальнай піраміды з атамам азоту ў вяршыні.
Аміяк выкарыстоўваецца ў вытворчасці азотнай кіслаты, соды, мачавіны, сінільнай кіслаты, мінеральных угнаенняў і інш.
У халадзільнай тэхніцы носіць назву R717, дзе R — Refrigerant (холадагент), 7 — тып холадагенту (неарганічнае злучэнне), 17 — малекулярная маса.