Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| |||||||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي الخطوط الطيفية للصوديوم | |||||||||||||||||||||||||||||
| الخواص العامة | |||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | صوديوم، 11، Na | ||||||||||||||||||||||||||||
| تصنيف العنصر | فلز قلوي | ||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 1، 3، s | ||||||||||||||||||||||||||||
| الكتلة الذرية | 22.98976928 غ·مول−1 | ||||||||||||||||||||||||||||
| توزيع إلكتروني | Ne] 3s1] | ||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2,8,1 (صورة) | ||||||||||||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||||||||||||
| الطور | صلب | ||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 0.968 غ·سم−3 | ||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 0.927 غ·سم−3 | ||||||||||||||||||||||||||||
| نقطة الانصهار | 370.87 ك، 97.72 °س | ||||||||||||||||||||||||||||
| نقطة الغليان | 1156 ك، 883 °س | ||||||||||||||||||||||||||||
| النقطة الحرجة | (قيمة حسابية) 2573 ك، 35 ميغاباسكال | ||||||||||||||||||||||||||||
| حرارة الانصهار | 2.60 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| حرارة التبخر | 97.42 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 28.230 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||||||
| أرقام الأكسدة | +1, 0, -1 (أكاسيده قاعدية قوية) | ||||||||||||||||||||||||||||
| الكهرسلبية | 0.93 (مقياس باولنغ) | ||||||||||||||||||||||||||||
| طاقات التأين | الأول: 495.8 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| الثاني: 4562 كيلوجول·مول−1 | |||||||||||||||||||||||||||||
| الثالث: 6910.3 كيلوجول·مول−1 | |||||||||||||||||||||||||||||
| نصف قطر ذري | 186 بيكومتر | ||||||||||||||||||||||||||||
| نصف قطر تساهمي | 9±166 بيكومتر | ||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 227 بيكومتر | ||||||||||||||||||||||||||||
| خواص أخرى | |||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الجسم | ||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة | ||||||||||||||||||||||||||||
| مقاومة كهربائية | 47.7 نانوأوم·متر (20 °س) | ||||||||||||||||||||||||||||
| الناقلية الحرارية | 142 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||||||
| التمدد الحراري | 71 ميكرومتر·متر−1·كلفن−1 (25 °س) | ||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 3200 متر/ثانية (20 °س) | ||||||||||||||||||||||||||||
| معامل يونغ | 10 غيغاباسكال | ||||||||||||||||||||||||||||
| معامل القص | 3.3 غيغاباسكال | ||||||||||||||||||||||||||||
| معامل الحجم | 6.3 غيغاباسكال | ||||||||||||||||||||||||||||
| صلادة موس | 0.5 | ||||||||||||||||||||||||||||
| صلادة برينل | 0.69 ميغاباسكال | ||||||||||||||||||||||||||||
| رقم CAS | 7440-23-5 | ||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الصوديوم | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
الصوديوم هو عنصر كيميائي رمزه Na (من النطرون) وعدده الذرّي 11. ينتمي العنصر في الجدول الدوري إلى مجموعة الفلزّات القلوية كثاني عناصر المجموعة الأولى وضمن عناصر الدورة الثالثة. الصوديوم فلزّ طري لونه أبيض فضّي ويتميّز بنشاطه الكيميائي الكبير فهو يتفاعل في الهواء ويحترق بلهب أصفر، كما أنّه شديد التفاعل مع الماء والرطوبة الجوّية، لذلك يحفظ في الزيوت أو مشتقّات النفط مثل الكيروسين، وبذلك تقيه من التماس المباشر مع الأكسجين أو الرطوبة.[ْ 1]
لا يوجد الصوديوم بشكل حرّ في الطبيعة، ويستحصل عليه من مركّباته. هناك وفرة كبيرة نسبياً للصوديوم، فهو سادس أكثر العناصر الكيميائية وفرة في القشرة الأرضية، ويوجد في العديد من المعادن مثل الفلسبار والصوداليت والهاليت. تمتاز أملاح الصوديوم أنّ انحلاليتها كبيرة في الماء، وأبرزها ملح كلوريد الصوديوم، والذي يعدّ المسبّب الرئيسي لملوحة مياه البحار. للصوديوم نظير واحد مستقر وهو 23Na.
للصوديوم دور حيويّ مهمّ، فهو يصنّف ضمن العناصر الغذائية الأساسية للإنسان وللحيوانات ولبعض النباتات. فأيونات الصوديوم +Na هي الكاتيونات الأساسية في السائل خارج الخلايا، ولها دور أساسي في ضبط ضغط الدم والضغط التناضحي (الإسموزي) في الجسم، بالإضافة إلى الدور في نقل الإشارات العصبية (جهد الفعل).

على العكس من فلزّ الصوديوم الحرّ الذي اكتشف حتى أوائل القرن التاسع عشر للميلاد، فإنّ مركّبات الصوديوم كانت معروفة ومتداولة منذ القدم، وخاصّة ملح الطعام المستخرج من البحر والبحيرات المالحة، وكذلك من المكامن الصخرية. قام المصريون القدماء باستخراج الأملاح من وادي النطرون، ولذلك سادت كلمة نتر المصرية في العهد القديم. انتقلت هذه الكلمة إلى اللغة الإغريقية لتصبح νίτρον (نترون)، والتي استعملها العرب فأصبحت نطرون، ومنهم أخذها الرومان وحوّروها لتصبح nitrium (نتريوم).[2] ولا تزال التسمية اللاتينية للعنصر Natrium وتحويرات منها مستخدمة في عدّة لغات، كما في اللغة الألمانية ولغات منطقة إسكندنافيا وذلك حسب اقتراح من بيرسيليوس.[2] يعتقد البعض أنّ تسمية صوديوم يعود أصلها إلى الكلمة اللاتينية sodanum والتي تعني «علاج وجع الرأس»،[3] والمأخوذة من كلمة صداع العربية.[4] لكن هذا الرأي ضعيف، والأغلب صلة اسم الصوديوم بكلمة صودا، والقادمة من اللاتينية soda التي كانت تشير إلى نبات مزهر ينمو على الأراضي الملحية، مثل نبات السويداء، والذي كان رماده (رماد الصودا) يستخدم في الغسيل، والذي من المرجح أن يكون اشتقاق كلمة صودا منه.[5]
اكتشف عنصر الصويوم لأوّل مرّة بشكله الحرّ من قبل همفري ديفي سنة 1807 وذلك من التحليل الكهربائي لمصهور هيدروكسيد الصوديوم باستخدام عمود فولتي كمصدر كهربائي.[6][7] حسبما ورد في سجلاّت الجمعية الملكية في لندن، فإنّ ديفي حصل في عمليّته تلك على ناتجين مختلفين: الناتج الأوّل الموجود في الصودا أسماه صوديوم، وهذه التسمية للفلزّ هي المستخدمة في نطاق المتحدّثين باللغتين الإنجليزية والفرنسية، ومنها انتقلت إلى عدّة لغات أخرى، منها العربية. أمّا الفلزّ الآخر المكتشف فأسماه بوتاسيوم. في سنة 1809، وفي سعي لتوحيد التسمية اقترح العالم الألماني لودفيغ فيلهلم غيلبرت على ديفي استخدام Natronium (ناترونيوم) وKalium (كاليوم) كاسمين للعنصرين المكتَشَفين حديثاً.[8] نشر يونس ياكوب بيرسيليوس الرمز الكيميائي للصوديوم لأول مرة سنة 1814 وذلك ضمن مسعاه لتنظيم رموز العناصر الكيميائية،[9][10] واختار الرمز Na من كلمة Natrium في اللاتينية الجديدة، والقادمة عبر كلمة نطرون العربية من المصرية القديمة، للإشارة إلى أملاح المعادن الطبيعية على شكل كربونات صوديوم مميّهة.[4] كانت تسمية نطرون منتشرة في أوروبا وذلك للاستخدام الكبير للمادّة على المستويين الصناعي والمنزلي.[11]
يضفي الصوديوم لوناً أصفر إلى اللهب، وهذه ملاحظة تعود إلى سنة 1860، حيث قام العالمان غوستاف روبرت كيرشهوف وروبرت بنزن بتدوين هذه الملاحظة في منشورهم العلمي في دورية Annalen der Physik العلمية.[12]

بسبب النشاط الكيميائي الكبير للعنصر، لا يوجد الصوديوم على شكله الحرّ على سطح الأرض، إنّما يدخل في تركيب العديد من المعادن، والتي يمتاز البعض منها بالانحلالية الكبيرة في الماء مثل الهاليت والنطرون. يعدّ ماء البحر أحد مصادر الصوديوم المهمّة، فكلّ ليتر منه يحوي وسطياً 11 غرام من أيونات الصوديوم،[13] وتقدّر وفرة الصوديوم في المحيطات بحوالي 1.08×104 ميليغرام في كل ليتر.[14] أمّا البعض الآخر فهي أقلّ انحلالية مثل مجموعة معادن الأمفيبول والزيوليتات. يعود ضعف الانحلالية لبعض المعادن الحاوية على الصوديوم مثل الكريوليت والفلدسبار إلى الخاصّة البوليميرية للأنيونات، والتي تكون على شكل بولي سيليكات مثلاً في الفلدسبار.
تحوي القشرة الأرضية على الصوديوم بنسبة 2.36% من تركيبها، ممّا يجعله سادس أكثر العناصر وفرة في القشرة الأرضية،[15] والخامس من حيث ترتيب الفلزات بعد الألومنيوم والحديد والكالسيوم، وبنسبة مقاربة للمغنسيوم، ولكن قبل البوتاسيوم.[16] من أكثر المعادن الحاوية على الصوديوم انتشاراً كلّ من الألبيت (NaAlSi3O8 فلدسبار الصوديوم) والأوليغوكلاس Na,Ca)Al(Si,Al)3O8)؛ كما يوجد أيضاً بكمّيّات كبيرة نسبياً في القباب الملحية على شكل هاليت (ملح الصخر). يوجد الصوديوم في الطبيعة أيضاً على شكل نترات الصوديوم (يعرف باسم ملح بيتر تشيلي) NaNO3، وهو أحد المصادر الطبيعية القليلة لمعادن النترات، والتي تنتشر في المناطق القاحلة مثل صحراء أتاكاما في تشيلي؛ بالإضافة إلى ذلك تعدّ مكامن النطرون Na2CO3 · 10 H2O من المصادر المهمّة للصوديوم.
يحتلّ الصوديوم المرتبة 14 من حيث وفرة العناصر في الكون؛[17] وذلك بنسبة مقاربة للكالسيوم والنيكل. يتمّ التعرّف على الصوديوم في العديد من الأجرام السماوية (من ضمنها الشمس) وكذلك في الوسط بين النجمي عن طريق الخطّ الطيفي D المميّز. على الرغم من ارتفاع درجة حرارة تبخّره، إلاّ أنّ وفرته في الغلاف الجوّي لكوكب عطارد مكّنت من كشفه بواسطة مسبار مارينر 10. كما تمكّن علماء الفلك أثناء رصدهم مذنب هيل-بوب سنة 1997 من ملاحظة أنّ ذيل المذنب يتكوّن من الصوديوم.[18]

يُنتج حوالي 100 ألف طنّ من الصوديوم الفلزّي سنويّاً، ويستخدم جلّ الإنتاج في تطبيقات اختصاصية.[19] يعود تاريخ إنتاج الصوديوم بشكل تجاري إلى أواخر القرن التاسع عشر،[20] وذلك بواسطة الاختزال الكربوحراري لمركّب كربونات الصوديوم (النطرون) عند درجات حرارة تفوق 1100 °س، وذلك كخطوة أولى في عملية ديفيل لإنتاج الألومنيوم:[21][22][23]
إلّا أنّ هذه الطريقة لم تعد تستخدم للحصول على الصوديوم وذلك بعد تطوير عملية هول-هيرو لإنتاج الألومنيوم، والتي استغنت عن إنتاج الصوديوم كخطوة مرحلية. كما تمّ الاستغناء بسبب الكلفة المرتفعة عن عملية كاستنر، والتي طُوّرت سنة 1886،[21] بالاعتماد على التحليل الكهربائي لهيدروكسيد الصوديوم.[24]
يُنتج الصوديوم حالياً بشكل تجاري من التحليل الكهربائي لمصهور كلوريد الصوديوم، اعتماداً على عملية حازت على براءة اختراع سنة 1924.[25][26] تتمّ العملية في خلية داونز، والتي يمزج فيها ملح كلوريد الصوديوم مع كلوريد الكالسيوم (40% NaCl و60% CaCl2) للحصول على نظام أصهري من أجل تخفيض نقطة الانصهار دون 700 °س، واختير الكالسيوم لأنه أقلّ كهرإيجابية من الصوديوم، فلا يترسّب على المهبط.[27] لإنتاج كيلوغرام واحد من الصوديوم يتمّ استهلاك 10 كيلوواط ساعي من التيّار أثناء التحليل الكهربائي، وحوالي 12 كيلوواط ساعي في العملية ككلّ.[28] تتكوّن خلايا التحليل الكهربائي الأسطوانية من مصعد من الغرافيت في المنتصف، يحيط به مهبط من الحديد، بالإضافة إلى وجود قفص على شكل جرس لسحب أبخرة الكلور أثناء العملية. يُجمّع الصوديوم المتشكّل على المهبط، ويُسحب بواسطة أنبوب صاعد من الخلية ومبرّد خارجها. يتشكّل الكالسيوم أيضاً كناتج ثانوي للعملية على شكل بلّورات، والذي يعاد مرة أخرى إلى مزيج الصهارة.
نظراً للفاعلية الكيميائية الكبيرة لفلز الصوديوم، فهناك صعوبات تقنية ترافق تخزينه ونقله، ممّا أدّى إلى محدودية انتشار إنتاجه. فالفلزّ يجب أن يحفظ إمّا في جوّ من غاز خامل أو في زيت معدني لامائي لتجنّب تشكّل طبقة سطحية من أكسيد الصوديوم أو فوق أكسيد الصوديوم.[29]
هناك عشرون نظير مكتشف للصوديوم، تتراوح كتلها الذرّية من 18Na إلى 33Na،[30] إلّا أنّه فقط يوجد نظير واحد مستقر، وهو صوديوم-23 23Na، بالتالي فالصوديوم عنصر أحادي النويدة. يتشكّل النظير 23Na في عملية احتراق الكربون في النجوم باندماج ذرّتي كربون، والذي يتطلّب درجات حرارة تتجاوز 600 ميغاكلفن، ونجم له ثلاث كتل شمسية على الأقلّ.[31]
للصوديوم نظيران مشعَّان ذَوا أصلٍ كوني، واللذان يتشكّلان من تشظية الأشعة الكونية وهما: صوديوم-22 22Na، الذي له عمر نصف مقداره 2.6 سنة، وصوديوم-24 24Na، الذي عمر النصف له يبلغ 15 ساعة.[30] أمّا باقي نظائر الصوديوم فعمر النصف لها أقلّ من دقيقة واحدة.[32] يُستخدم نظيرا الصوديوم 22Na و24Na في الطب النووي كمواد اقتفاء.
اكتشف مصاوغان نووريان للصوديوم، أطولهما عمراً هو 24mNa (عمر النصف حوالي 20.2 ميلي ثانية. يؤدّي التعرّض للإشعاع النووي في الحالات الحرجة إلى تحويل بعض من ذرّات النظير المستقرّ 23Na في الدمّ إلى 24Na، ويمكن معرفة مدى جرعة التعرض للإشعاع النيوتروني بحساب نسبة تركيز النظير 24Na إلى 23Na.[33]

يكون الصوديوم في الظروف القياسية من الضغط ودرجة الحرارة على شكل فلزّ طري فضّي اللون، والذي يتّحد مع أكسجين الهواء ليشكّل طبقة رمادية اللون من الأكسيد. للحيلولة دون ذلك يتمّ عادةً غمس الصوديوم الفلزي في زيت معدني أو أحد مشتقّات النفط، أو أن يحفظ في جوّ من غاز خامل. يمكن قطع فلز الصوديوم بسهولة بالسكّين، فله قيمة صلادة تبلغ 0.5 حسب مقياس موس.[34] وهو ناقل جيّد للكهرباء وللحرارة، وذلك بسبب سهولة التخلّص من الإلكترون الوحيد الموجود في غلاف التكافؤ، بالتالي يؤدّي هذا التشكيل الإلكتروني للصوديوم إلى ضعف الرابطة الفلزية. بسبب قلّة الوزن الذرّي وكبر نصف قطر ذرّة الصوديوم نسبياً، فإنّه يصنّف من الفلزّات الخفيفة، وهو ثالث أقلّ الفلزّات كثافة (0.968 غ/سم3)[13] بعد الليثيوم والبوتاسيوم، والتي هي الوحيدة القادرة من بين الفلزات على العوم على سطح الماء.[35] يقع الصوديوم في العديد من خواصه بين الليثيوم والبوتاسيوم، فله نقطة انصهار (97.82 °س) أخفض من الليثيوم (180.54 °س)، إلّا أنّها أعلى من البوتاسيوم (63.6 °س)؛ وكذلك الأمر بالنسبة في نقطة الغليان (883 °س) والحرارة النوعية.[13]
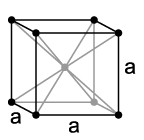
يتبلور الصوديوم كما هو الحال مع باقي الفلزّات القلوية وفق نظام بلوري مكعّب مركزي الجسم، له زمرة فراغية Im3m مع وجود وحدتي صيغة لكلّ وحدة خلية. عند درجات حرارة أدنى من 51 كلفن تتغيّر البنية البلّورية إلى نظام تعبئة متراصّة سداسية، تبلغ قيمة ثابت الشبكة البلورية لها a = 376 pm وc = 615 pm.[36] تتغيّر خواص الصوديوم الظاهرية بشكل كبير عند ضغوط مرتفعة؛ فعند ضغط مقداره 1.5 ميغابار يتغيّر اللون إلى الأسود، وعند ضغط 1.9 ميغابار يصبح ذا لون أحمر شفاف، وعند 3 ميغابار يصبح الصوديوم ذا هيئة صلبة شفافة صافية، وتكون جميع هذه المتآصلات عازلة وذات صفة إلكتريدية.[37]
يتكوّن بخار الصوديوم، وهو ذو لون أصفر إلى أرجواني، من ذرّات فلزّية منفردة، ومن ثنائيات لها الشكل Na2، والأخيرة تكون بنسبة 16% عند نقطة الغليان.[13] يشكّل الصوديوم مع البوتاسيوم ضمن مجال عريض من التراكيز مزائج سائلة، حيث يظهر المخطّط الطوري عند الدرجة 7 °س (وهي نقطة انصهار لا متطابقة Peritectic) التركيب Na2K، أمّا النقطة الأصهرية فهي عند − 12.6 °س، بوجود تركيز من البوتاسيوم مقداره 77% (كسر كتلي).[38]

يشكّل الصوديوم سبائكاً مع العديد من الفلزّات مثل البوتاسيوم والكالسيوم والرصاص، بالإضافة إلى عناصر المجموعتين الحادية عشرة والثانية عشرة. يستطيع الصوديوم أن يشكّل مع البوتاسيوم سبيكة NaK، وتتراوح نسبة البوتاسيوم في تركيبها من 40–90% وهي سائلة في درجة الحرارة المعتدلة، وتتميّز بأنّ لها خواص موصلية حرارية وكهربائية ممتازة. تعدّ سبائك صوديوم-كالسيوم منتجات ثانوية أثناء إنتاج الصوديوم من عملية التحليل الكهربائي بوجود المزيج الملحي من NaCl-CaCl2، على الرغم من أنّ الكالسيوم يمتزج بشكل جزئي فقط مع الصوديوم.
في الحالة السائلة يمتزج الصوديوم مع الرصاص بشكل كامل. هناك العديد من الوسائل التي تمكّن من صنع سبائك صوديوم-رصاص، من بينها الصهر المشترك، وأخرى تتمثّل بترسيب الصوديوم كهربائياً على مهابط مصهورة مصنوعة من الرصاص. من الأمثلة على تركيبات سبائك صوديوم-رصاص كل من NaPb3 وNaPb وNa9Pb4 وNa5Pb2 وNa15Pb4.
من الممكن أيضاً الحصول على سبائك للصوديوم مع الذهب NaAu2 والفضة NaAg2. كذلك الأمر مع عناصر الزنك NaZn13 والكادميوم NaCd2 والزئبق، والعنصر الأخير يشكل ما يسمى ملغمة صوديوم: NaHg وNaHg4 وNaHg2 وNa3Hg2 وNa3Hg.[40]
يظهر التشكيل الإلكتروني للصوديوم وجود 11 إلكترون في الغلاف الإلكتروني، وهو يزيد بذلك بإلكترون واحد عن التشكيل الإلكتروني عالي الاستقرار للغاز النبيل المجاور وهو النيون. لهذا السبب، ولانخفاض قيمة طاقة التأيّن الأولى (495.8 كيلوجول/مول)، فإنّ ذرّات الصوديوم تميل لفقدان الإلكترون الأخير الموجود في غلاف التكافؤ ولتشكيل كاتيون (أيون موجب الشحنة) +Na، وذلك بشكل أكبر من اكتساب إلكترون آخر ليصبح سالب الشحنة.[41] لذلك فالصوديوم يميل إلى تشكيل مركّبات أيونية، يكون للصوديوم فيها رقم تكافؤ مقداره +1 (طاقة التأيّن الثانية لها قيمة مرتفعة جدّاً نسبيّاً: 4562 كيلوجول/مول).[42] يكون الصوديوم في مركّباته الكيميائية مرتبطاً أيونياً إلى الأنيونات الأخرى، ويصنّف أيون الصوديوم من أحماض لويس القاسية.[43]
إنّ الصوديوم أكثر نشاطاً كيميائياً من الليثيوم، لكنّه أقلّ من البوتاسيوم.[44] فهو يتفاعل بسهولة مع العديد من العناصر وبعض المركّبات، ويكون تفاعله عنيفاً مع اللافلزّات مثل الكلور والكبريت، حيث يترافق ذلك مع لهب أصفر. يعدّ الصوديوم الفلزّي من المختزلات القويّة، إذ يتطلّب اختزال أيونات الصوديوم جهداً مقداره −2.71 فولت،[45] على الرغم من أنّ جهد الاختزال لكلّ من البوتاسيوم والليثيوم ذو قيم سالبة أكبر.[46]
يعدّ تفاعل الصوديوم مع الأكسجين حالة خاصة، إذ أنّ التفاعل بينهما مرهون بوجود الرطوبة، فبغياب الماء لا يتفاعل الصوديوم مع الأكسجين عند درجة حرارة الغرفة، وحتّى عند التسخين لا يتمّ التفاعل بشكل مباشر بينهما، كما يمكن صهر الصوديوم بجوّ من الأكسجين خالٍ من الماء بشكل تامّ دون حدوث تفاعل أيضاً. يتغيّر الأمر تماماً عند وجود الماء (الرطوبة)، فحينئذ يحترق الصوديوم بسهولة ليشكّل بيروكسيد الصوديوم:[13]
يتفاعل الصوديوم مثل باقي الفلزات القلوية مع الماء بتفاعل عنيف ناشر للحرارة، حيث يتشكّل هيدروكسيد الصوديوم وينطلق غاز الهيدروجين. بيّنت صور ملتقطة بسرعات فائقة أنّ تفاعل الفلزّات القلوية مع الماء يحدث بشكل أقرب ما يكون لانفجار كولوم.[47]
يتفاعل الصوديوم بشكل عنيف أيضاً مع الكحولات، ولكن بشكل أخفّ من تفاعله مع الماء، ليشكّل الألكوكسيدات الموافقة، وغالباً مع انصهار الفلز بسبب حرارة التفاعل. يكون تفاعل الصوديوم عنيفاً أيضاً مع المذيبات العضوية الكلورية مثل ثنائي كلورو الميثان والكلوروفورم ورباعي كلوريد الكربون.
يميل الصوديوم إلى تشكيل مركّبات كيميائية منحلّة مثل أملاح الهاليدات والكبريتات والنترات والكربونات والكربوكسيلات. تكون الأنواع الكيميائية المائية الرئيسية على شكل المعقّد: +[Na(H2O)n] أثناء عملية الإماهة، حيث n = 4–8، مع العلم أنّ قيمة n = 6 حُدّدت بواسطة بيانات حيود الأشعة السينية والمحاكاة الحاسوبية.[48] للصوديوم انحلالية أقلّ في المذيبات العضوية، فعلى سبيل المثال ينحلّ فقط 0.35 غ/ل من كلوريد الصوديوم في الإيثانول.[49]

كما هو الحال مع باقي الفلزات القلوية فإنّ الصوديوم ينحلّ في الأمونيا وبعض الأمينات الأخرى ليعطي محاليل ملوّنة غامقة، والتي يعود تلوّنها إلى الإلكترونات الحرّة التي يمنحها الصوديوم إلى المحلول. بالتالي فالمحلول موصل للكهرباء، وعند تمديده يكون ذا مغناطيسية مسايرة.
يؤدّي تبخير هذه المحاليل إلى ترك طبقة رقيقة (فيلم) لامعة من الصوديوم الفلزّي. تحوي هذه المحاليل على معقدات تناسقية من النمط +(Na(NH3)6)، حيث تُعاكَس الشحنة الموجبة بشكل مساوٍ عن طريق الإلكتريدات (الإلكترونات كأنيونات). يمكن استخدام الإيثرات التاجية، كحفّازات انتقال طوري؛[50] كما تسمح مركّبات كريبتاند بعزل هذه المعقّدات كمواد صلبة بلّورية، إذ أنّ الصوديوم يشكّل معقّدات معها أيضاً ومع ربيطات أخرى.[51] على سبيل المثال، فإنّ لمركّب إيثر 15-تاج-5 ألفة عالية تجاه الصوديوم، لأنّ حجم التجويف للمركّب يتراوح بين 1.7–2.2 أنغستروم (Å)، وهو مقدار كافٍ لينحشر أيون صوديوم داخله.[52][53] إنّ الكريبتاندات، مثلها مثل الإيثرات التاجية وحاملات الأيون الأخرى، ذات ألفة عالية تجاه أيون الصوديوم، بحيث يمكن في النهاية الحصول على مشتقّات من القلويدات −Na (ناتريد Natride: أنيون صوديوم)،[54] بواسطة إضافة مركّبات الكريبتاند إلى محاليل من الصوديوم في الأمونيا عن طريق تفاعل عدم تناسب.[55][56]
تعد المركّبات الكيميائية للصوديوم ذات أهمّيّة كبيرة، وذلك على مرّ التاريخ وخاصّة في المجال التجاري والصناعي، حيث كان لها استخدام مركزي خاصّ في صناعات مختلفة، منها صناعة الزجاج والورق والصابون والنسيج.[19]
يعدّ كلوريد الصوديوم (ملح الطعام أو NaCl)، هو أكثر مركّبات الصوديوم اللاعضوية شيوعاً، وذلك مع كربونات الصوديوم (رماد الصودا Na2CO3) وبيكربونات الصوديوم (صودا الخبز NaHCO3) وهيدروكسيد الصوديوم (الصودا الكاوية NaOH) ونترات الصوديوم (نتر الصودا NaNO3)، وكذلك أملاح فوسفات الصوديوم الثنائية والثلاثية، بالإضافة إلى ثيوكبريتات الصوديوم Na2S2O3·5H2O والبورق Na2B4O7·10H2O.[57]
أشهر هاليدات الصوديوم هو مركب كلوريد الصوديوم NaCl المتوفّر بكثرة، ويعدّ المصدر الأساسي للحصول على الصوديوم في الطبيعة. أمّا باقي الهاليدات فهي مركّبات ثابتة ومعروفة، وهي: فلوريد الصوديوم NaF، وبروميد الصوديوم NaBr، ويوديد الصوديوم NaI.

للصوديوم مركّبين ينتميان إلى الهيدريدات وهما هيدريد الصوديوم NaH، وبورهيدريد الصوديوم NaBH4، واللذان يستخدمان في الاصطناع العضوي كمختزلات.
يرتبط الصوديوم مع الأكسجين ليشكّل عدّة أكاسيد أشهرها: أكسيد الصوديوم Na2O، وبيروكسيد الصوديوم Na2O2، وفوق أكسيد الصوديوم NaO2. تستخدم أكاسيد الصوديوم المختلفة في صناعة الزجاج والورق والنسيج. يعدّ هيدروكسيد الصوديوم NaOH من القلويات الشائعة، حيث يستخدم محلوله بشكل كبير في الصناعة.
يعطي الصوديوم مع كبريتيد الهيدروجين ملحين وهما: كبريتيد الصوديوم Na2S وبيكبريتيد الصوديوم NaHS، واللذان يستخدمان في تعدين الفلزّات الثقيلة. يستخدم كبريتات الصوديوم Na2SO4 في صناعة الورق، أمّا بيكبريتات الصوديوم فيستخدم في منتجات التنظيف. من مركّبات الصوديوم الكبريتية أيضاً مركب ثيوكبريتات الصوديوم الذي يستخدم في التصوير الضوئي.
يصنّف مركبا كربونات الصوديوم Na2CO3 وبيكربونات الصوديوم NaHCO3 على أنّهما أملاح صوديومية لحمض الكربونيك، وهي واسعة الانتشار والاستخدام على الصعيدين المنزلي والصناعي، وذلك بالإضافة إلى نترات الصوديوم NaNO3 ومركّبات فوسفات الصوديوم المختلفة.
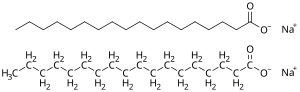
إنّ أغلب منتجات الصابون هي أملاح صوديوم للأحماض الدهنية، حيث تمتاز هذه المنتجات بأنّ لها قوام صلب متماسك، وذلك بالمقارنة مع نظيراتها من أملاح البوتاسيوم، والتي تدخل في تركيب الصابون السائل.[57]
جرى تحضير العديد من مركّبات الصوديوم العضوية، وبسبب استقطاب الرابطة الكيميائية بين C-Na فإنّ هذه المركّبات تعدّ كمصدر للكربانيونات. من بين هذه المركّبات حلقي بنتاديينيد الصوديوم NaC5H5 وتريتيل الصوديوم C6H5)3CNa).[58]
بسبب كبر حجم وضعف القوة المستقطبة للكاتيون +Na فإنّه يستطيع أن يثبّت الأنيونات العطرية الجذرية الكبيرة القابلة للاستقطاب، مثلما هو الحال في نفثالينيد الصوديوم −[•Na+[C10H8، وهو مختزل قويّ جدّاً.[59]

عند إجراء اختبار اللهب يعطي الصوديوم ومركّباته لوناً أصفر مميّز،[60] وذلك بسبب أنّ الإلكترونات في المدار الذري 3s تتهيّج وتثار بسبب امتصاص الحرارة وتقفز إلى المدار 3p، وعند عودتها إلى المدار 3s تصدر طاقة على شكل فوتون له طول موجة عند 589.3 نانومتر، ويرمز له الخطّ D في خطوط فراونهوفر. يؤدّي التآثر المغزلي المداري للإلكترونات إلى انفصام الخط D إلى خطّين D1 وD2، كما تسبّب البنى فائقة الدقة في المدارات إلى الحصول على خطوط ضعيفة أخرى.[61]
من النادر حدوث عملية ترسيب لأملاح الصوديوم، لأنّ لها ألفة كيميائية عالية تجاه الماء، باستثناء ملح بزموتات الصوديوم NaBiO3.[62] كما أنّه من الممكن إجراء ترسيب للصوديوم باستخدام ملح مزدوج صوديومي من الكبريتات والبزموت 3Na2SO4*2Bi2(SO4)3*2H2O.[63]
يمكن تحديد المحتوى الصوديومي في المواد بالمعالجة مع كمّيّة فائضة من أسيتات يورانيل الزنك؛ حيث يترسّب سداسي الهيدرات UO2)2ZnNa(CH3CO2)·6H2O) ويحدد وزنه. لا يتداخل السيزيوم والروبيديوم في تفاعل الكشف هذا، ولكن التداخلات تحدث مع عنصري البوتاسيوم والليثيوم.[64] كما يمكن أن يتمّ الكشف بالترسيب باستخدام أسيتات يورانيل الصوديوم والمغنسيوم [65] حيث يعطي راسب أصفر من NaMg(UO2)3(CH3COO)9·9 H2O؛ أو باستخدام سداسي هيدروكسي إثمدات الصوديوم [Na[Sb(OH)6 الذي يعطي راسب عديم اللون.[66]
تحدّد التراكيز الضئيلة من الصوديوم بواسطة مطيافية الامتصاص الذري،[67] أو بإجراء معايرة بمقياس الجهد باستخدام أقطاب انتقائية لأيونات الصوديوم.[68]
للصوديوم دور حيويّ مهمّ في جسم الإنسان، فهو من العناصر الغذائية الضرورية التي تلعب أدواراً متنوّعة في العديد من العمليّات الفسيولوجية مثل ضغط الدم وحموضة (pH) الوسط في الجسم، بالإضافة إلى تنظيم التوازن المائي داخل وخارج الخلايا. يوجد الصوديوم في الجسم على شكل أيونات +Na، وهي من الكهارل (الإلكتروليتات) المهمّة في أداء العصبونات؛ وهي السائدة في السائل خارج الخلوي،[69] حيث تقوم بضبط الضغط التناضحي (الإسموزي) بين الخلايا وخارجها عن طريق مضخّة الصوديوم والبوتاسيوم (Na+/K+-ATPase)، وهو إنزيم مسؤول عن النقل الفعّال للأيونات عبر القنوات المخصّصة.[70]
يقوم نظام الرينين-أنجيوتنسين بتنظيم كمّيّة السوائل وبالتالي تركيز الصوديوم في الجسم، وتلعب الكلية الدور الرئيسي في ذلك.[71] عند انخفاض ضغط الدم وتركيز الصوديوم، فإنّ الجسم يستجيب بإفراز الرينين، والذي بدوره يسبّب إفراز الألدوستيرون والأنجيوتنسين، إلى أن يصبح تركيز الصوديوم طبيعياً، فينخفض إفراز الرينين.[72] كما يلعب هرمون فازوبرسين والببتيد الأذيني المدرّ للصوديوم دوراً في عملية التنظيم هذه.[73]
يقع تركيز الصوديوم الطبيعي في مصل الدم بين حوالي 135–145 ميلي مول/ليتر. توصف الحالات في الطبّ التي ترافق حدوث ارتفاع غير عادي من الصوديوم في الدم باسم فرط صوديوم الدم، والذي يترافق بانكماش الخلايا؛ بالمقابل فإنّ الانخفاض غير العادي يسمى نقص صوديوم الدم، والذي يترافق بازدياد حجم الخلايا. قد يعود سبب هذه الحالات المرضية إلى عوامل وراثية أو تقدّم العمر أو الحالات المطوّلة من الإقياء أو الإسهال.[74]
لا تتوزّع أيونات الصوديوم +Na في أجسام الكائنات الحية بانتظام، فهي متفاوتة بين داخل الخلايا وخارجها، ممّا يؤدّي في النهاية إلى التأثير على الجهد الغشائي فيها. يعدّ الجهد الغشائي وتدرّج تراكيز الأيونات من العوامل المؤثّرة على أداء الخلايا، وفي هذا السياق تلعب مضخّة الصوديوم والبوتاسيوم دوراً مهمّاً في ذلك، حيث تُدخل البوتاسيوم وتُخرج الصوديوم بعملية مستهلكة للطاقة.[75]
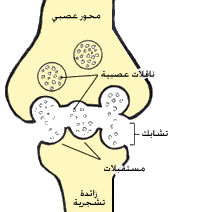
لأيونات الصوديوم +Na دور مهمّ في تشكيل ونقل الإثارات الحسّية في العصبونات، فعند التشابك العصبي (وكذلك عند المشابك العصبية العضلية أيضاً) توجد هناك مستقبلات بروتينية عبر غشائية محدّدة، والتي بعد تحفيزها من النواقل العصبية المفرَزة من الخليّة العصبية المجاورة تقوم بفتح المجال لعبور أيونات الصوديوم. عند مرور تيّار من أيونات الصوديوم يحدث هناك تغيّر موضعي في الجهد الغشائي للخليّة، حيث يصبح الكمون الداخلي أقل سلبيّة من الكمون الخارجي، ويحدث ما يسمى بعملية إزالة الاستقطاب، والتي تتكرّر على طول المحور العصبي بفتح وإغلاق للقنوات الأيونية، ممّا يؤدّي إلى حدوث جهد الفعل.[75]
يمثّل كلوريد الصوديوم المصدر الرئيسي للصوديوم في النظام الغذائي للإنسان، حيث يستخدم كملح للطعام، بالإضافة إلى استخداماته المختلفة في وسائل حفظ المأكولات المختلفة مثل التخليل والتقديد، كما يستخدم بشكل كبير في المأكولات سهلة التحضير.[76][ْ 2]
بالإضافة إلى المصادر الطبيعية للصوديوم، فإنّ الجسم يحصل عليه من الإضافات الغذائية مثل أحادي غلوتامات الصوديوم (E621) ونتريت الصوديوم (E250) وبنزوات الصوديوم (E211) وصوديوم السكارين وبيكربونات الصوديوم (صودا الخَبْز - ذرور الخبز).[77]
في جسم إنسان متوسّط وزنه 70 كغ يوجد حوالي 100 غ من أيونات الصوديوم.[78] إنّ الحدّ الأدنى المتطلّب فسيولوجياً من الصوديوم هو 500 ميليغرام في اليوم وسطيّاً،[79] وحدّدته الجمعية الألمانية للتغذية بمقدار 550 مغ/اليوم للبالغين، وحوالي 460 مغ/اليوم للأطفال بين عمر السابعة والعاشرة.[80] هناك توصيات من عدّة منظّمات لضبط الكمّيّة الأعظمية من الصوديوم في الغذاء، حيث حدّدته منظّمة الصحّة العالمية بمقدار 2 غ/اليوم،[81] في حين أنّ الأكاديمية الوطنية الأمريكية للطبّ حدّدت الكمّيّة الغذائية المرجعية من الصوديوم بمقدار 2.3 غ يومياً كحدّ أعظمي.[82] بيّنت الدراسات أنّ تقليل كمّيّات الصوديوم المتناولة إلى 2 غ في اليوم يسهم في تخفيض ضغط الدم بمقدار 2 - 4 ميليمتر زئبقي؛[83] ممّا يؤدّي إلى نسبة حالات أقل من ارتفاع ضغط الدم تتراوح ما بين 9 - 17 %؛ [83] مع العلم أنّ ارتفاع ضغط الدم يسبّب 7.6 مليون حالة وفاة مبكّرة سنويّاً حول العالم.[84] بملاحظة أنّ ملح الطعام يحوي على 39.3% من تركيبه على صوديوم،[85] بالتالي فإنّ الحدّ الأعظمي المذكور آنفاً من 2.3 غ صوديوم يكافئ حوالي 6 غ من الملح في اليوم (ملعقة شاي تقريباً).[86] مع العلم أنّ جمعية القلب الأمريكية [87] توصي بأن تكون كمّيّة الصوديوم في الغذاء حوالي 1.5 غ يومياً؛ وهي الكمّيّة الموصى بها من إدارة الغذاء والدواء الأمريكية للمصابين بفرط الضغط أو أعراضه.[86] هناك الكثير ممّن يتناولون كمّيّات من الصوديوم أكبر بكثير من التي يحتاجون إليها،[ْ 3] ممّا يعرّضهم للخطر، لذا يجب مراقبة تركيز الصوديوم بإجراء ما يسمى اختبار الصوديوم لعينة من الدم،[ْ 4] أو من البول؛[88] إذ بيّنت دراسة أنّ المستويات المرتفعة من الصوديوم في البول (حوالي 7 غ في اليوم) عند المصابين بارتفاع الضغط يمكن أن يعرّضهم لأزمات قلبية ويرفع من نسبة حدوث الوفاة.[89]
في النباتات ذات التمثيل الضوئي رباعي الكربون فإنّ الصوديوم يعدّ من المغذيات الأصغرية التي لها دور ثانوي ولكن مهمّ؛ حيث تسهم في عملية الاستقلاب، وخاصّة في إعادة توليد فوسفوإينول حمض البيروفيك واصطناع الكلوروفيل.[90] كما يحلّ الصوديوم مكان البوتاسيوم في بعض النباتات الأخرى، كما هو الحال مع النباتات الملحية، حيث يقوم بالإبقاء على ضغط الامتلاء ويساعد في فتح وإغلاق الثغور النباتية،[91]
يسبّب ارتفاع تركيز الصوديوم في التربة إلى الحدّ والتقليل من استهلاك الماء في النبات عبر جهد الماء، والذي يؤدّي بدوره إلى الذبول.[92][93] كما أنّ ارتفاع تركيز الصوديوم في السيتوبلازم يمكن أن يسبّب تثبيط الإنزيمات، والذي بدوره يؤدّي إلى النخر وشحوب الأوراق.[94] كردّ فعل، تقوم بعض النباتات بتطوير آلية للحدّ من استجلاب الصوديوم في الجذور النباتية، أو بتخزينه في الفجوات العصارية، أو بالحدّ من نقل الملح من الجذور إلى الأوراق.[95] تسمّى هذه النباتات التي تقوم بذلك أنّها كارهة للصوديوم، ومن أمثلتها الفاصولياء الشائعة والذرة.

هناك طلب كبير على مركّبات الصوديوم في الصناعة، وخاصّة أملاح الكلوريد والهيدروكسيد والكربونات لاستخداماتها المتنوّعة، وذلك بشكل أكبر من الطلب على الصوديوم الفلزّي بحدّ ذاته. يستخدم الصوديوم مع البوتاسيوم على شكل أيون في العديد من الأدوية والمستحضرات الصيدلانية لتحسين التوافر الحيوي؛ على الرغم من أفضليّة أيون البوتاسيوم في حالات عدّة، إلّا أنّ الصوديوم هو الذي يتم اختياره لانخفاض سعره ووزنه الذرّي.[96] يدخل الصوديوم في تركيب بطارية أيونات الصوديوم، التي تعد من البدائل المحتملة لبطاربات أيونات الليثيوم. يستخدم الصوديوم بشكل مباشر في تحضير مركّبات الصوديوم قليلة الانتشار في الطبيعة، والتي لا يمكن تحضيرها من كلوريد الصوديوم، وذات التطبيقات الخاصة مثل بيروكسيد الصوديوم وأميد الصوديوم وسيانيد الصوديوم وهيدريد الصوديوم وبورهيدريد الصوديوم وأزيد الصوديوم؛ بالإضافة إلى تحضير صبغة النيلة ومركّب ثلاثي فينيل الفوسفين.
كان الصوديوم مستخدماً لوقت طويل في إنتاج رباعي إيثيل الرصاص من كلورو الإيثان، والذي كان يمزج في الماضي بكثرة مع وقود السيارات كمانع للخبط في محركات الاحتراق الداخلي؛ قبل أن يمنع لأسباب صحّية وبيئية في أغلب دول العالم، ممّا أدّى إلى انخفاض إنتاج الصوديوم عالميّاً منذ سبعينات القرن العشرين.[19]
يستخدم الصوديوم في تحفيز بلمرة 3،1-بوتاديين والإيزوبرين، وفي إنتاج المطّاط الاصطناعي.[97] كان يطلق على المطّاط الاصطناعي المنتَج باستخدام الصوديوم كحفّاز اسم بونا Buna، وكان من أوائل أنواع المطّاط الاصطناعي المنتج في العالم.[98]
يستخدم الصوديوم السائل في تبريد المفاعلات النووية لقدرته العالية على نقل الحرارة.[ْ 5] فللصوديوم ناقلية حرارية تبلغ 140 واط/م.كلفن، وهي قيمة تفوق التي للفولاذ (الصلب، 58 واط/م.كلفن)، كما أنّه سهل الانصهار وذو نقطة غليان مرتفعة نسبيّاً ممّا يمكّن من العمل في المفاعلات تحت ضغوط عادية غير مرتفعة.[99] كما أنّ له مقطع تصادم صغير مع النيوترونات،[99] ممّا يجعله جيّداً للاستخدام كمادة تبريد للمفاعلات النووية مثل مفاعل الاستنسال السريع،[100] والتي لا يستخدم الماء للتبريد فيها لتجنّب كبح النيوترونات.[101]
لكن من مساوئ استخدام الصوديوم في تبريد المفاعلات النووية هو عدم شفافيّته (اعتامه)، ممّا يعيق إصلاح الأعطال بصرياً، بالإضافة إلى خطر وقوع حوادث انفجارية.[102] كما يمكن أن يتكوّن النظير صوديوم-24 عبر تنشيط النيوترون أثناء التشغيل، ممّا قد يشكّل خطر إشعاع بسيط؛ فالنشاط الإشعاعي يتوقّف بعد عدّة أيام من إزالته من المفاعل.[103] عندما تكون هناك الحاجة لإيقاف وإعادة تشغيل المفاعل لعدّة مرات، فإنّه من الأفضل استخدام سبيكة صوديوم-بوتاسيوم NaK للتبريد، إذ أنّها سائلة عند درجة حرارة الغرفة، بالتالي لا تتصلّب مادة التبريد في الأنابيب؛[104] ولكن بالمقابل يُخشى من تلقائية اشتعال البوتاسيوم، ممّا يستدعي اتخاذ إجراءات احترازية إضافية.[105]
من التطبيقات الحرارية للصوديوم أيضاً استخدامه في الصمّامات القَفَّازة في محرّكات الاحتراق الداخلي عالية الأداء؛ إذ أنّ ساق الصمام تكون مملوءةً جزئياً بالصوديوم وتعمل كأنبوب حراري لتبريد الصمّام.[106]
لإنارة الشوارع يستخدم أحياناً مصابيح بخار الصوديوم، والتي تتميّز بلونها الأصفر البرتقالي، والذي يتشكّل عند تعريض بخار الصوديوم إلى تفريغ كهربائي.[107]
يتميّز الصوديوم بأنّه من المختزلات القويّة، ولذلك يستخدم في تعدين بعض الفلزّات التي لا يمكن اختزالها بالكربون مثل التيتانيوم والزركونيوم والتانتالوم واليورانيوم والألومنيوم والمغنسيوم، لأنّ هذه الفلزات تشكّل كربيدات ثابتة حرارياً صعبة التفكك. كما يمكن استخدام البوتاسيوم لهذا الغرض أيضاً.
في المجال المخبري يستخدم الصوديوم كمختزل مهمّ في الاصطناع العضوي،[108] مثل اختزال بيرتش وتفاعل ازدواج البيناكول.[109] يستخدم ناتج إذابة الصوديوم في الأمونيا لاختزال الألكاينات إلى ألكينات المفروقة (ترانس).[110][111]
بسبب القابلية المرتفعة للتفاعل حتى مع آثار من الماء، يمكن أن يستخدم سلك مضغوط من الصوديوم كمجفّف للمذيبات العضوية مثل ثنائي إيثيل الإيثر والتولوين. بالمقابل لا يمكن استخدام هذه الطريقة لتجفيف الكحولات أو المذيبات الهالوجينية (مثل ثنائي كلورو الميثان) لأنّ الصوديوم يتفاعل معها. يمكن استخدام NaK لغرض التجفيف أيضاً، حيث تبدي ميّزات نوعية في هذا المجال. يعطي ناتج عملية التجفيف بالصوديوم (أو NaK) لوناً شديد الزرقة مع مركّب بنزوفينون.[112]
| صوديوم | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |   |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H260, H314 |
| بيانات وقائية وفق GHS | P223, P231+232, P280, P305+351+338, P370+378, P422[113] |
| NFPA 704 |
|
| - تعديل | |
عند التماس مع الماء يشكّل الصوديوم غاز الهيدروجين القابل للاشتعال، بالإضافة إلى محلول هيدروكسيد الصوديوم الأكّال.[114] بالتالي فإن ابتلاع الصوديوم وتماسّه مع الجلد أو العين أو الأغشية المخاطية يسبّب حروقاً شديدة.[115][116] ينفجر الصوديوم بشكل تلقائي بوجود المؤكسدات.[117]
إنّ مطافئ الحريق ذات الأساس المائي غير مناسبة لإطفاء حرائق الصوديوم، فهي تعمل بالعكس على تسريعها، كما ينبغي تجنّب استعمال مطافئ ذات أساس من ثنائي أكسيد الكربون وبرومو كلورو ثنائي فلورو الميثان (هالون 1211) أيضاً.[116] يستخدم لإطفاء حرائق الفلزّات مطافئ من الصنف D (بودرة جافّة)، والتي يعتمد بعضها مثلاً (Lith-X) على مسحوق من الغرافيت والرمل ومثبّط لهب فوسفاتي عضوي.[118]
تُكافَح حرائق الصوديوم في المفاعلات النووية بعزل الصوديوم عن الأكسجين بإحاطة أنابيب الصوديوم بغاز خامل.[119] أمّا حرائق الصوديوم ذات النمط البِرَكي فتكافَح بأسلوب مختلف يعتمد على تجميع الصوديوم المتسرّب وسَوقِه إلى خزّانات استرجاع لعزله عن الأكسجين.[119]
{{استشهاد ويب}}: تحقق من التاريخ في: |تاريخ= (مساعدة)
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في: |date= (مساعدة) ويحتوي الاستشهاد على وسيط غير معروف وفارغ: |1= (مساعدة)صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link)
{{استشهاد بدورية محكمة}}: |archive-date= / |archive-url= timestamp mismatch (مساعدة)
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link)
{{استشهاد بكتاب}}: الوسيط غير المعروف |المحررين= تم تجاهله (مساعدة)
{{استشهاد بكتاب}}: |عمل= تُجوهل (مساعدة)
{{استشهاد بكتاب}}: |عمل= تُجوهل (مساعدة)
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||