Infrastructure tools to support an effective radiation oncology learning health system
Indice
| Titanio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | titanio, Ti, 22 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | metalli del blocco d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | 4, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 4 507 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Durezza | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | 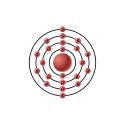 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 3F2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 47,867 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calc.) | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 136 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [Ar]3d2 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per livello energetico | 2, 8, 10, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | esagonale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | solido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 1 941 K (1 668 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 3 560 K (3 290 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 10,64×10−6 m³/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 421 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 15,45 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensione di vapore | 0,49 Pa a 1 933 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 4140 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | 1,54 (Scala di Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 520 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 1,798×106S/m[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 21,9 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 658,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 1 309,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di terza ionizzazione | 2 652,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quarta ionizzazione | 4 174,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quinta ionizzazione | 9 581 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di sesta ionizzazione | 11 533 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di settima ionizzazione | 13 590 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di ottava ionizzazione | 16 440 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di nona ionizzazione | 18 530 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di decima ionizzazione | 20 833 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Il titanio è l'elemento chimico della tavola periodica degli elementi che ha numero atomico 22 e simbolo Ti. È il primo elemento del gruppo 4 del sistema periodico, facente parte del blocco d, ed è quindi un elemento di transizione. È un metallo leggero, resistente, di colore bianco metallico, lucido, resistente alla corrosione. Il titanio viene utilizzato in molte leghe leggere e resistenti. Il suo biossido, un pigmento bianco, si trova in numerosi minerali, principalmente rutilo e ilmenite. Il titanio non è tossico e non risulta essenziale per nessuna specie vivente.[2]
Storia
Il titanio (dal latino Titanus, Titano, nome del dodicesimo figlio di Gea e Urano[3] tra i titani) fu scoperto nel 1791 dal reverendo, mineralogista e chimico britannico William Gregor, individuandolo senza isolarlo nelle rocce di ilmenite della Cornovaglia; lo chiamò "menacanite", dal nome della Valle di Manaccan dove aveva raccolto i campioni di roccia.
Nel 1795, il chimico tedesco Heinrich Klaproth[3] lo isolò dai minerali di rutilo, dimostrò che era lo stesso minerale di W. Gregor e battezzò l'elemento con il nome dei titani della mitologia greca.[3] Il titanio metallico puro (99,9%) venne preparato per la prima volta nel 1910 dall'ingegnere neozelandese Matthew Albert Hunter tramite riscaldamento di TiCl4 con del sodio a 700-800 °C.
Il titanio metallico non venne usato al di fuori dei laboratori fino al 1946, quando l'ingegnere lussemburghese William Justin Kroll dimostrò che il titanio poteva essere prodotto commercialmente tramite riduzione del tetracloruro di titanio con il magnesio. Finora, questo è il metodo più usato e prende il nome di processo Kroll.
Caratteristiche
Il titanio è un elemento metallico ben conosciuto per la sua resistenza alla corrosione, quasi pari a quella del platino, e per il suo alto rapporto tra resistenza e peso. È leggero, duro, con bassa densità. Allo stato puro è abbastanza duttile, lucido, di colore bianco metallico. Tuttavia le leghe di titanio non sono facilmente lavorabili e la difficoltà di lavorazione alle macchine utensili è paragonabile a quella dell'acciaio inossidabile, notoriamente il più difficile da lavorare per asportazione di truciolo. Il punto di fusione relativamente alto di questo elemento lo rende utile come metallo refrattario. Il titanio è resistente come l'acciaio pur essendo il 40% più leggero, pesa il 60% in più dell'alluminio con resistenza doppia. Queste proprietà rendono il titanio molto resistente alle forme usuali di fatica dei metalli.
Questo metallo forma una patina di ossido passivo se esposto all'aria a temperatura ambiente e quando si trova in un'atmosfera libera da ossigeno è molto duttile. Il titanio brucia se riscaldato nell'aria o in atmosfera di azoto, reagendo anche con idrogeno e alogeni. Il titanio è resistente all'acido solforico diluito e all'acido cloridrico, oltre che ai gas di cloro, alle soluzioni di cloruri, alla maggior parte degli acidi carbossilici e gli alcali acquosi a caldo.
Esperimenti hanno mostrato che il titanio naturale diventa altamente radioattivo se bombardato con nuclei di deuterio, emettendo principalmente positroni e raggi gamma. Il metallo è dimorfico con forma alfa esagonale che diventa beta cubica molto lentamente, alla temperatura di circa 880 °C. Quando raggiunge il colore rosso il titanio si combina con l'ossigeno e quando raggiunge i 550 °C si combina con il cloro.
Isotopi
Il titanio è il primo elemento con Z pari per il quale, per avere un isotopo stabile, occorre che i neutroni nel nucleo superino i protoni (cioè: N > Z), cosa che si verifica nel suo primo isotopo stabile, il 46Ti, che ha 22 protoni e 24 neutroni. L'ultimo elemento con Z pari ad avere un isotopo stabile (o almeno osservativamente stabile) con N = Z è il calcio con l'isotopo 40Ca.
Dell'elemento titanio si conoscono almeno 26 isotopi, con numeri di massa che vanno da A = 38 ad A = 63. Tra questi, gli isotopi naturali dell'elemento, tutti stabili, sono i cinque che seguono, con le loro abbondanze relative in parentesi: 46Ti (8,25%), 47Ti (7,44%), 48Ti (73,72%), 49Ti (5,41%) e 50Ti (5,18%).[4] I restanti sono tutti radioattivi.[5]
Isotopi stabili
Gli isotopi stabili del titanio partono da un nucleo (46Ti) avente un eccesso di 2 neutroni rispetto ai protoni e arrivano ad un nucleo (50Ti) con un eccesso di 6 neutroni, passando per il 48Ti (il più abbondante) con eccesso di 4 neutroni.
Questi isotopi e le loro abbondanze relative(rapporti isotopici) hanno rilevanza in cosmochimica,[6][7][8] geochimica[9] e archeologia.[10]
I nuclidi di titanio aventi A dispari, 47Ti e 49Ti, sono i soli ad avere spin nucleare (7/2- e 5/2-, rispettivamente) e in quanto tali sono assoggettabili alla risonanza magnetica nucleare e quindi rivestono importanza per la caratterizzazione chimica di composti e complessi del titanio.[11][12][13]
Isotopi radioattivi
Il 44Ti (spin 0), con un numero di protoni e neutroni uguale, non è stabile e decade per sola cattura elettronica (ε) a scandio-44 (Q = 267,63 keV, T1/2 = 60,25 anni), che poi decade a sua volta ε/β+, ma principalmente in modalità β+ (94,3%, emissione di positrone),[14] a calcio-44, stabile.[15]
Il 45Ti (spin 7/2-), decade ε per il 15,2% dei casi e decade β+ per il restante 84,2% dei casi,[16] dando scandio-45 (Q = 1,04 MeV, T1/2 = 3,08 ore), stabile.[17]
Il 51Ti (spin 3/2-), decade β− a vanadio-51 (Q = 2,474 MeV, T1/2 = 5,77 minuti), stabile.[18]
Il 52Ti (spin 0), decade β− a vanadio-52 (Q = 1,976 MeV, T1/2 = 1,7 minuti), che poi decade a sua volta, in modalità β−, a cromo-52, stabile.[19]
Tutti i restanti isotopi radioattivi hanno emivita inferiore ai 33 secondi e la maggior parte di questi ha emivita inferiore al mezzo secondo.
Disponibilità
Il titanio è il nono elemento per abbondanza nella crosta terrestre (0,6% della massa), non si trova libero in natura ed è presente in molte rocce magmatiche e nei sedimenti da esse derivanti. Si trova principalmente nei seguenti minerali: anatasio, brookite, ilmenite, leucoxene, perovskite, rutilo e titanite, nonché nei titanati e in molti minerali ferrosi. Di questi minerali solo l'ilmenite, il leucoxene e il rutilo hanno un'importanza economica significativa. Significativi depositi di minerali di titanio si trovano in Australia, Scandinavia, Nord America, Malaysia e nel Parco naturale regionale del Beigua in Liguria.
Poiché il titanio metallico può bruciare in atmosfera di azoto puro [20] e alle alte temperature reagisce facilmente con l'ossigeno e il carbonio, è difficoltoso preparare il titanio metallico puro. Il metallo si trova nei meteoriti ed è stato rintracciato nel Sole e nelle stelle di classe M. Le rocce portate dalla Luna durante la missione Apollo 17 erano composte per il 12,1% di TiO2. Il titanio si trova inoltre nelle ceneri di carbone, nelle piante e anche nel corpo umano.
Produzione

Il primo processo di produzione commerciale del titanio è stato il processo van Arkel-de Boer. Invece oggi il titanio viene ottenuto tramite riduzione di TiCl4 con il magnesio, un processo sviluppato nel 1946 da William Justin Kroll, oppure col processo Hunter che è analogo al processo Kroll, ma effettuato con sodio metallico. Questo processo è complicato e costoso, ma un nuovo procedimento, chiamato metodo "FFC-Cambridge" potrebbe rimpiazzarlo. Questo nuovo metodo usa come materiale di base la polvere di diossido di titanio, una forma raffinata di rutilo, per ottenere il prodotto finale, un flusso continuo di titanio fuso adatto all'utilizzo immediato per la manifattura di leghe.
Si spera che il metodo FFC-Cambridge renda il titanio un materiale meno raro e costoso per l'industria aerospaziale e il mercato dei beni di lusso, e che verrà impiegato in molti prodotti attualmente fabbricati con alluminio o acciai speciali.
Applicazioni


All'incirca il 95% del titanio viene consumato in forma di diossido di titanio (TiO2) nelle vernici, nella carta e nei cementi per renderli più brillanti, e nelle plastiche. Le vernici fatte con il biossido di titanio riflettono molto bene la radiazione infrarossa e sono quindi molto usate dagli astronomi.
Le leghe di titanio vengono utilizzate principalmente nell'industria aeronautica e aerospaziale, anche se il loro utilizzo in prodotti di consumo come mazze da golf, biciclette, componenti motociclistici e computer portatili sta diventando sempre più comune. Il titanio viene spesso messo in lega con alluminio, ferro, manganese, molibdeno e altri metalli.
Il carburo di titanio (TiC; peso specifico 4,93; punto di fusione 2 940 °C) il nitruro di titanio (TiN; peso specifico 5,40; punto di fusione 2 960 °C) e più recentemente, il derivato carbonitrurico (Ti10C7N3; peso specifico 5,02; punto di fusione 3 520 °C) sono composti altamente refrattari, inerti sotto le comuni condizioni di temperatura e resistenti all'attacco della maggior parte degli acidi minerali e alcali.
Per queste ragioni sono impiegati nella costruzione di utensili e macchinari che possiedono parti destinate alle alte velocità con attrito, nel rivestimento di crogioli per contenere acidi o basi molto forti e componenti di missili sottoposti a usura termica, ad esempio ugelli.
Altri impieghi:
- Grazie all'eccellente resistenza all'acqua di mare e alle soluzioni saline in generale, viene usato per fabbricare parti dei propulsori marini e molto spesso anche nella fabbricazione delle casse degli orologi;
- Un uso tecnologico molto importante, legato alla sua resistenza alle soluzioni saline, è come materiale metallico di contatto con i fluidi ad alta concentrazione salina negli impianti di dissalazione dell'acqua marina;
- Viene utilizzato per produrre gemme artificiali relativamente morbide;
- Il tetracloruro di titanio (TiCl4), un liquido incolore, viene usato per ottenere l'iridescenza del vetro e viene anche usato per la fabbricazione di fumogeni poiché emette un fumo denso nell'aria umida;
- Oltre a essere un importante pigmento, il biossido di titanio viene impiegato nei filtri solari grazie alla sua capacità di proteggere la pelle;
- Ha la proprietà di essere biocompatibile, in quanto lo strato di ossido che forma in superficie è un valido supporto a cui i tessuti biologici aderiscono, in particolare quello osseo. Per questo motivo il titanio puro CP4 e la lega a base di titanio Ti6Al4V vengono utilizzati nelle componenti protesiche di anca e ginocchio, per la fabbricazione di clip chirurgiche da sutura permanente e in odontoiatria per la realizzazione di impianti dentali[21]. Tuttavia, dato l'alto coefficiente di attrito, non viene mai utilizzato come componente di giunzione articolare;
- Il suo essere inerte e la colorazione attraente lo rendono un metallo popolare per l'uso nei piercing.
- Il titanio viene usato per le lenti degli occhiali;
- Il carburo e il nitruro di titanio (TiC e TiN) vengono utilizzati nella fabbricazione di inserti per utensili adatti al taglio dei metalli ad alta velocità, cioè i cosiddetti inserti in "metallo duro". In particolare il carburo di titanio viene utilizzato, insieme al carburo di tungsteno (WC), al cobalto e ad altri carburi (carburo di niobio e carburo di tantalio) per realizzare il corpo degli inserti, mentre il nitruro di titanio serve per il rivestimento superficiale degli inserti;
- L'Alluminuro di Titanio, grazie alle doti di tenacità ad alte temperature, leggerezza e resistenza all'ossidazione sta lentamente iniziando a soppiantare le Superleghe base nichel nella produzione delle pale utilizzate nelle turbine dei motori aeronautici;
- Facendo passare una corrente elettrica in strati sottili di nitruro di titanio a temperatura molto bassa si verifica un fenomeno detto di superisolamento;
- In alcune occasioni è stato utilizzato per la fabbricazione di penne stilografiche. Nel 1970, all'indomani dell'allunaggio, la Parker produsse per un breve periodo la T-1, una stilografica interamente in titanio, in omaggio ai materiali usati nella missione spaziale. Nel 2000 la casa produttrice italiana Omas produsse una serie di stilografiche del modello classico a dodici facce "arte italiana" interamente in titanio, sia il corpo sia il pennino. La serie venne denominata T-2 ed è stata commercializzata solo per un breve periodo.
Composti
Il Titanio forma numerosi complessi soprattutto con numero di ossidazione +4, il massimo per il gruppo IV; sono tutti composti o complessi diamagnetici e il numero di coordinazione più comune per il Ti è il 6.
I principali sono l'ossido TiO2 e gli alogenuri TiX4 (X = F, Cl, Br, I). Fra questi, TiCl4 e TiBr4 sono importanti acidi di Lewis che si prestano bene a essere usati come catalizzatori in sintesi organica. È noto anche il nitruro TiN, molto duro e pressoché inerte, con punto di fusione 2950 °C.
Forma composti o complessi a numero di ossidazione +3 e anche +2 che si ossidano facilmente all'aria, specialmente i secondi. Forma anche complessi con numero di ossidazione formale 0, ad esempio un metallocarbonile in cui il Ti è complessato da 6 molecole di monossido di carbonio che non rispetta la regola dei 18 elettroni (formalmente 16 e), che può essere ridotto a ione [Ti(CO)6]2- (formalmente 18 e) in cui il numero di ossidazione formale di Ti è -2.
Gli ossidi possono essere ottenuti per reazione diretta del metallo con l'ossigeno ad alta temperatura. Gli alogenuri sono principalmente formati dall'azione di un alogeno sul biossido di titanio, hanno un comportamento di acido di Lewis per formare alogenocomplessi.
Si trovano in natura giacimenti di TiO2 cristallino, che prende nomi diversi a seconda della struttura cristallina che presenta, (rutilo, anatasio…).Altri minerali di titanio sono la ilmenite (titanato di ferro, FeTiO2) e la titanite (titanato di calcio, CaTiO2)
Diossido di titanio
Noto anche come titania in ambito ceramico o mineralogico. Alcune forme cristalline (polimorfi) sono il rutilo e l'anatasio. Anche se il metallo di titanio è relativamente poco comune a causa dei costi di estrazione, il diossido di titanio è economico, facilmente disponibile in grandi quantità e largamente utilizzato in campo industriale come pigmento bianco in vernici, plastiche e cemento da costruzione. La polvere di TiO2 è chimicamente inerte, non svanisce con la luce solare ed è molto opaca; ciò le permette di impartire un colore bianco brillante alle sostanze chimiche grigie o marroni che formano le plastiche normalmente usate.
Il diossido di titanio puro ha un indice di rifrazione molto alto e una dispersione ottica superiore al diamante. Zaffiri e rubini prendono il loro asterismo dal diossido di titanio in essi presente.
Note
- ^ NDT Education, Iowa State University (PDF), su nde-ed.org. URL consultato l'11 gennaio 2016 (archiviato dall'url originale il 4 marzo 2016).
- ^ Zierden e Valentine 2016.
- ^ a b c Titanio, in Treccani.it – Vocabolario Treccani on line, Roma, Istituto dell'Enciclopedia Italiana. URL consultato il 23 dicembre 2022.
- ^ Isotope data for titanium-48 in the Periodic Table, su periodictable.com. URL consultato il 15 marzo 2023.
- ^ Isotope data for titanium-48 in the Periodic Table, su periodictable.com. URL consultato il 30 luglio 2024.
- ^ (EN) Anne Trinquier, Tim Elliott e David Ulfbeck, Origin of Nucleosynthetic Isotope Heterogeneity in the Solar Protoplanetary Disk, in Science, vol. 324, n. 5925, 17 aprile 2009, pp. 374–376, DOI:10.1126/science.1168221. URL consultato il 15 marzo 2023.
- ^ (EN) Niel H. Williams, Manuela A. Fehr e Ian J. Parkinson, Titanium isotope fractionation in solar system materials, in Chemical Geology, vol. 568, 5 maggio 2021, pp. 120009, DOI:10.1016/j.chemgeo.2020.120009. URL consultato il 15 marzo 2023.
- ^ (EN) Thomas Stephan, TOF-SIMS in cosmochemistry, in Planetary and Space Science, vol. 49, n. 9, 1º agosto 2001, pp. 859–906, DOI:10.1016/S0032-0633(01)00037-X. URL consultato il 15 marzo 2023.
- ^ (EN) Wenzhong Wang, Shichun Huang e Fang Huang, Equilibrium inter-mineral titanium isotope fractionation: Implication for high-temperature titanium isotope geochemistry, in Geochimica et Cosmochimica Acta, vol. 269, 15 gennaio 2020, pp. 540–553, DOI:10.1016/j.gca.2019.11.008. URL consultato il 15 marzo 2023.
- ^ (EN) John Bintliff e Patrick Degryse, A review of soil geochemistry in archaeology, in Journal of Archaeological Science: Reports, vol. 43, 1º giugno 2022, pp. 103419, DOI:10.1016/j.jasrep.2022.103419. URL consultato il 15 marzo 2023.
- ^ (EN) Bryan E. G. Lucier, Wanli Zhang e Andre Sutrisno, 9.13 - A review of exotic quadrupolar metal nmr in mofs, Elsevier, 1º gennaio 2023, pp. 330–365, DOI:10.1016/b978-0-12-823144-9.00163-1, ISBN 978-0-12-823153-1. URL consultato il 15 marzo 2023.
- ^ (EN) Nguyen Hao, Brian G Sayer e Georges Dénès, Titanium-47 and -49 nuclear magnetic resonance spectroscopy: Chemical applications, in Journal of Magnetic Resonance (1969), vol. 50, n. 1, 15 ottobre 1982, pp. 50–63, DOI:10.1016/0022-2364(82)90030-0. URL consultato il 15 marzo 2023.
- ^ (EN) Didier Gourier e Edmond Samuel, Proton, titanium-47 and titanium-49 ENDOR study on frozen solutions of [(.eta.5-C5H5)Ti(.eta.8-C8H8)] and [(.eta.5-CH3C5H4)Ti(.eta.8-C8H8)], in Journal of the American Chemical Society, vol. 109, n. 15, 1987-07, pp. 4571–4578, DOI:10.1021/ja00249a020. URL consultato il 15 marzo 2023.
- ^ Decay information, su atom.kaeri.re.kr. URL consultato il 30 luglio 2024.
- ^ Isotope data for titanium-44 in the Periodic Table, su periodictable.com. URL consultato il 15 marzo 2023.
- ^ Decay information, su atom.kaeri.re.kr. URL consultato il 30 luglio 2024.
- ^ Table of Nuclides, su atom.kaeri.re.kr. URL consultato il 30 luglio 2024.
- ^ Isotope data for titanium-51 in the Periodic Table, su periodictable.com. URL consultato il 15 marzo 2023.
- ^ Isotope data for titanium-52 in the Periodic Table, su periodictable.com. URL consultato il 15 marzo 2023.
- ^ N. N. Greenwood e A. Earnshaw, Titanium, Zirconium and Hafnium, in Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 958, ISBN 0750633654.
- ^ (EN) Oshida Y, Tuna EB, Aktören O, Gençay K, Dental implant systems, in Int J Mol Sci, vol. 11, n. 4, MDPI, 12 aprile 2010, pp. 1580-1678, DOI:10.3390/ijms11041580, PMID 20480036, PMC 2871132.
Bibliografia
- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini, P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998 (archiviato dall'url originale il 22 ottobre 2010).
- (EN) M. R. Zierden e A. M. Valentine, Contemplating a role for titanium in organisms, in Metallomics, vol. 8, n. 1, 2016, pp. 9-16, DOI:10.1039/C5MT00231A.
Voci correlate
- Leghe di titanio
- Titanio nativo
- Taglio ad acqua – lavorazione di grossi spessori
- Electron beam melting (EBM) – fusione a fascio di elettroni
Altri progetti
 Wikiquote contiene citazioni sul titanio
Wikiquote contiene citazioni sul titanio Wikizionario contiene il lemma di dizionario «titanio»
Wikizionario contiene il lemma di dizionario «titanio» Wikimedia Commons contiene immagini o altri file sul titanio
Wikimedia Commons contiene immagini o altri file sul titanio
Collegamenti esterni
- titanio, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) titanium, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN, FR) Titanio, su Enciclopedia canadese.
| Controllo di autorità | Thesaurus BNCF 23638 · LCCN (EN) sh85135605 · GND (DE) 4140648-5 · BNE (ES) XX531321 (data) · BNF (FR) cb119375205 (data) · J9U (EN, HE) 987007538930505171 · NDL (EN, JA) 00573109 |
|---|



















