Informatics Educational Institutions & Programs
Vsebina
 | |||||||||||||||||||||||||||||||||
| Zlato | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Izgovarjava | IPA: [zlaˈtoː] | ||||||||||||||||||||||||||||||||
| Videz | kovinsko rumeno | ||||||||||||||||||||||||||||||||
| Standardna atomska teža Ar, std(Au) | 196,966570(4)[1] | ||||||||||||||||||||||||||||||||
| Zlato v periodnem sistemu | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Vrstno število (Z) | 79 | ||||||||||||||||||||||||||||||||
| Skupina | skupina 11 | ||||||||||||||||||||||||||||||||
| Perioda | perioda 6 | ||||||||||||||||||||||||||||||||
| Blok | blok d | ||||||||||||||||||||||||||||||||
| Razporeditev elektronov | [Xe] 4f14 5d10 6s1 | ||||||||||||||||||||||||||||||||
| Razporeditev elektronov po lupini | 2, 8, 18, 32, 18, 1 | ||||||||||||||||||||||||||||||||
| Fizikalne lastnosti | |||||||||||||||||||||||||||||||||
| Faza snovi pri STP | trdnina | ||||||||||||||||||||||||||||||||
| Tališče | 1064,18 °C | ||||||||||||||||||||||||||||||||
| Vrelišče | 2970 °C | ||||||||||||||||||||||||||||||||
| Gostota (blizu s.t.) | 19,30 g/cm3 | ||||||||||||||||||||||||||||||||
| v tekočem stanju (pri TT) | 17,31 g/cm3 | ||||||||||||||||||||||||||||||||
| Talilna toplota | 12,55 kJ/mol | ||||||||||||||||||||||||||||||||
| Izparilna toplota | 342 kJ/mol | ||||||||||||||||||||||||||||||||
| Toplotna kapaciteta | 25,418 J/(mol·K) | ||||||||||||||||||||||||||||||||
Parni tlak
| |||||||||||||||||||||||||||||||||
| Lastnosti atoma | |||||||||||||||||||||||||||||||||
| Oksidacijska stanja | −3, −2, −1, 0,[2] +1, +2, +3, +5 (amfoterni oksid) | ||||||||||||||||||||||||||||||||
| Elektronegativnost | Paulingova lestvica: 2,54 | ||||||||||||||||||||||||||||||||
| Ionizacijske energije |
| ||||||||||||||||||||||||||||||||
| Atomski polmer | empirično: 144 pm | ||||||||||||||||||||||||||||||||
| Kovalentni polmer | 136±6 pm | ||||||||||||||||||||||||||||||||
| Van der Waalsov polmer | 166 pm | ||||||||||||||||||||||||||||||||
| Druge lastnosti | |||||||||||||||||||||||||||||||||
| Pojavljanje v naravi | prvobitno | ||||||||||||||||||||||||||||||||
| Kristalna struktura | ploskovno centrirana kocka (pck) | ||||||||||||||||||||||||||||||||
| Hitrost zvoka tanka palica | 2030 m/s (pri r.t.) | ||||||||||||||||||||||||||||||||
| Temperaturni raztezek | 14,2 µm/(m⋅K) (pri 25 °C) | ||||||||||||||||||||||||||||||||
| Toplotna prevodnost | 318 W/(m⋅K) | ||||||||||||||||||||||||||||||||
| Električna upornost | 22,14 nΩ⋅m (pri 20 °C) | ||||||||||||||||||||||||||||||||
| Magnetna ureditev | diamagnetik[3] | ||||||||||||||||||||||||||||||||
| Magnetna susceptibilnost | −28,0·10−6 cm3/mol (at 296 K)[4] | ||||||||||||||||||||||||||||||||
| Natezna trdnost | 120 MPa | ||||||||||||||||||||||||||||||||
| Youngov modul | 79 GPa | ||||||||||||||||||||||||||||||||
| Strižni modul | 27 GPa | ||||||||||||||||||||||||||||||||
| Stisljivostni modul | 180 GPa[5] | ||||||||||||||||||||||||||||||||
| Poissonovo razmerje | 0,4 | ||||||||||||||||||||||||||||||||
| Mohsova trdota | 2,5 | ||||||||||||||||||||||||||||||||
| Trdota po Vickersu | 188–216 MPa | ||||||||||||||||||||||||||||||||
| Trdota po Brinellu | 188–245 MPa | ||||||||||||||||||||||||||||||||
| Številka CAS | 7440-57-5 | ||||||||||||||||||||||||||||||||
| Zgodovina | |||||||||||||||||||||||||||||||||
| Poimenovanje | iz latinščine aurum, pomeni zlato | ||||||||||||||||||||||||||||||||
| Odkritje | Na Srednjem vzhodu (pred 6. tisočletjem pr. n. št.) | ||||||||||||||||||||||||||||||||
| Simbol | "Au": iz lat. aurum | ||||||||||||||||||||||||||||||||
| Najpomembnejši izotopi zlata | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Zlato je kemični element s simbolom Au (latinsko aurum) in atomskim številom 79, zaradi česar je eden od elementov višjih atomskih števil, ki se pojavljajo naravno. V čisti obliki je svetla, rahlo rdečkasto rumena, gosta, mehka, lahko kovna in gnetljiva kovina. Kemično je zlato prehodna kovina iz skupine 11. Je eden najmanj reaktivnih kemičnih elementov in v običajnih pogojih trdna snov. Zlato se pogosto pojavlja v elementarni obliki, kot kepe ali zrna, v skalah, v žilah in naplavinah. Pojavlja se v seriji trdnih raztopin z naravnim srebrom (kot elektrum), ki je naravna zlitina z drugimi kovinami, kot sta baker in paladij; najti je tudi v obliki mineralnih vključkov, na primer v piritu. Manj pogosto se pojavlja v mineralih v obliki zlatih spojin, pogosto s telurjem (teluridi zlata).
Zlato je odporno na večino kislin, čeprav se raztopi v aqua regia (mešanica dušikove kisline in klorovodikove kisline), pri čemer tvori topni tetrakloroavratni anion. Zlato ni topno v dušikovi kislini, ki raztaplja srebro in navadne kovine, lastnost, ki se že dolgo uporablja za prečiščevanje zlata in za dokazovanje prisotnosti zlata v kovinskih predmetih, kar je izvor izraza kislinski test. Zlato se topi tudi v alkalnih raztopinah cianida, kar se uporablja v rudarstvu in galvanizaciji. Zlato se topi v živem srebru in tvori amalgamske zlitine, vendar pri tem ne gre za kemično reakcijo.
Zlato je sorazmerno redek element [6][7], plemenita kovina, ki se je skozi zgodovino uporabljala za kovanje denarja, nakit in druge namene umetnosti. V preteklosti so zlati standard pogosto uporabili kot temelj za denarno politiko, vendar se v 30. letih zlati kovanci niso več kovali kot plačilno sredstvo; svetovni zlati standard so po letu 1971 zamenjale fiat valute.
Do leta 2019 je človek iz zemlje izkopal 197.576 ton zlata.[8] To ustreza kocki z stranicami 21,7 metra. Od novega zlata gre približno 50% v nakit, 40% v naložbe in 10% v industrijo.[9] Visoka voljnost in gnetljivost zlata, odpornost proti koroziji in večini drugih kemičnih reakcij ter prevodnost elektrike so privedle do dodatne uporabe v korozijsko odpornih električnih priključkih v vseh vrstah računalniških naprav (njegova glavna industrijska uporaba). Zlato se uporablja tudi pri zaščiti pred infrardečimi žarki, proizvodnji barvnega stekla, proizvodnji listov zlata in v zobozdravstvu. Nekatere zlate soli se v medicini še vedno uporabljajo kot protivnetna zdravila. Od 2017 je največja svetovna proizvajalka zlata na svetu Kitajska s 440 tonami letno.[10]
Značilnosti
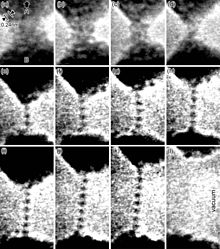

Zlato je od vseh kovin najlaže kovati. Lahko ga raztegnemo v žico debeline enega atoma, ki jo nato lahko občutno dalje raztegujemo, preden se pretrga.[11] Take vrste nano žice se deformirajo z nastajanjem, preusmeritvijo in selitvijo dislokacij in kristalnih dvojčkov, ne da bi pri tem prišlo do opaznega povečanja trdote.[12] En gram zlata lahko razvaljamo v list velikosti 1 m2. Zlate liste lahko tanjšamo tako dolgo, da postanejo polprozorni. Prepuščena svetloba je videti zelenkasto modra, ker zlato močno odbija rumeno in rdečo svetlobo.[13] Taki polprozorni listi močno odbijajo tudi infrardečo svetlobo, zaradi česar so uporabne kot toplotna zaščita v vizirjih toplotno odpornih oblek in vesoljskih skafandrov.[14] Zlato je dober prevodnik toplote in električne energije .
Zlato ima gostoto 19,3 g/cm3, skoraj popolnoma enako gostoti volframa pri 19.25 g/cm 3 ; z volframom so zato pogosto ponarejali zlate opeke (Bullion), na primer tako da so kvadre iz volframa prevlekli z zlatom,[15][16][17][18] ali pa so v zlate kvadre vrtali luknje, ki so jih zadelali z ničvrednim volframom.[19] Za primerjavo, gostota svinca je 11,34 g/cm 3, najgostejši element, osmij, pa ima gostoto 22588±0015.[20]
Barva
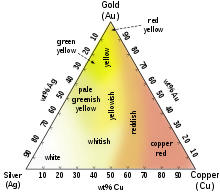
Medtem ko je večina kovin sive ali srebrno bele barve, je zlato rahlo rdečkasto rumene barve.[21] Ta barva je določena s frekvenco plazmonskih oscilacij med valentnimi elektroni v kovini, za večino kovin na ultravijoličnem območju , za zlato zaradi relativističnih učinkov, ki vplivajo na orbitale atomov v vidnem območju.[22][23] Podobni učinki dajejo zlati odtenek kovinskemu ceziju .
Med pogoste barvne zlitine spada značilno osemnajstkaratno rožnato zlato, ki nastane z dodatkom bakra. Zlitine s paladijem ali nikljem, tako imenovano belo zlato, so prav tako pomembne pri komercialnem nakitu. Štirinajstkaratna zlato-bakrena zlitina zlata in bakra je skoraj iste barve kot nekatere vrste brona, uporablja se za izdelavo policijskih in drugih značk. Štirinajst- in osemnajst-karatne zlitine s srebrom imajo zelenkasto rumeno barvo, od tod ime zeleno zlato. Modro zlato imajo zlitine z železom, vijolično pa zitine z aluminijem. Lahko se tudi dodajajo mangan, indij in drugi elementi za bolj nenavadne barve in namene.[24]
Koloidno zlato, ki ga uporabljajo elektronski mikroskopi, je rdeče barve, če so delci majhni; večji delci koloidnega zlata pa so modri.[25]
Izotopi
Zlato ima samo en stabilen izotop, 197
Au, ki je tudi njegov edini naravni izotop, zato je zlato mononuklidni in monoizotopski element. Sintetiziranih je bilo 36 radioizotopov z atomsko maso od 169 do 205. Najbolj stabilen med njimi je z razpolovno dobo 186,1 dni. Najmanj stabilen je 171
Au, ki razpada z emisijo protona z razpolovno dobo 30 µs. Večina zlatih radioizotopov z atomskimi masami pod 197 razpade s kombinacijo protonske emisije, α razpada in β + razpada. Izjema sta 195
Au, ki razpada z zajemom elektronov, in 196
Au , ki najpogosteje razpade z zajemom elektronov (93%) z manjšo potjo prek β - razpada (7%).[26] Vsi zlati radioizotopi z atomskimi masami nad 197 razpadajo po β - poti.
Kemija

Čeprav je zlato najplemenitejša med plemenitimi kovinami,[27][28] še vedno tvori veliko raznolikih spojin. Stopnja oksidacije zlata v njegovih spojinah je od -1 do +5, vendar Au (I) in Au (III) v njegovi kemiji prevladujeta. Au (I), imenovan polarni ion, je najpogostejše oksidacijsko stanje z mehkimi ligandi, kot so tioetri, tiolati in terciarni fosfini. Spojine Au (I) so praviloma linearne. Dober primer je Au (CN)<sub id="mwASc">2</sub><sup id="mwASg">-</sup>, topna oblika zlata, ki se pojavlja v rudarstvu. Binarni zlati halogenidi, kot je AuCl, tvorijo cik-cak polimerne verige, ki pri Au spet vsebujejo linearno koordinacijo. Večina zdravil na osnovi zlata so derivati Au(I).[29]
Au (III) (imenovan aurik) je običajno oksidacijsko stanje, ki ga ponazarja klorid zlata (III) , Au2Cl6. Središča zlatih atomov v kompleksih Au(III) so, tako kot pri drugih spojinah d8, običajno kvadratično razporejena v ravnini, s kemičnimi vezmi, ki imajo kovalentni in ionski značaj.
Zlato ne reagira s kisikom pri nobeni temperaturi [30] in je do 100 °C odporen proti napadu ozona.[31]
Nekateri prosti halogeni reagirajo z zlatom.[32] Fluor pri temno rdeči vročini močno napada zlato [33] in tvori Au(III) fluorid. Zlato v prahu reagira s klorom pri 180 °C, da nastane AuCl<sub id="mwAUU">3</sub>.[34] Zlato reagira z bromom pri 140 °C, da tvori zlati (III) bromid, z jodom pa reagira le zelo počasi in tvori monojodid .
Zlato ne reagira neposredno z žveplom [35] zlati (III) sulfid pa lahko dobimo s vpihavanjem vodikovega sulfida v razredčeno raztopino Au (III) klorida ali kloravrične kisline .
Zlato se pri sobni temperaturi zlahka raztopi v živem srebru in tvori amalgam, pri višjih temperaturah pa tvori zlitine s številnimi drugimi kovinami. Te zlitine omogočajo nadzorovati barvo, temperaturo tališča, trdoto in druge metalurške lastnosti izdelka.[24]
Večina kislin na zlato ne vpliva. Zlato ne reagira s fluorovodikovo, klorovodikovo, bromovodikovo, hidriodno, žveplovo ali dušikovo kislino. Reagira pa s selensko kislino in se raztaplja v zlatotopki , mešanici dušikove in klorovodikove kisline v razmerju 1: 3 Dušikova kislina kovino oksidira na ione +3, vendar le v majhnih količinah, ki jih v čisti kislini običajno ni mogoče zaznati zaradi kemijskega ravnovesja reakcije. Vendar se ioni iz ravnotežja odstranijo s klorovodikovo kislino, pri čemer nastanejo AuCl4- ioni ali kloroavrinska kislina, kar omogoča nadaljnjo oksidacijo.
Na zlato večina baz prav tako ne vpliva. Ne reagira z vodnim, trdnim ali staljenim natrijevim ali kalijevim hidroksidom. Vendar pa reagira z natrijevim ali kalijevim cianidom v alkalnih pogojih, kadar je prisoten kisik, da prihaja do nastanka topnih kompleksov.[35]
Običajna oksidacijska stanja zlata vso med drugimi +1 (zlato (I)) in +3 (zlato (III)). Ioni zlata v raztopini se zlahka reducirajo in oborijo kot kovina z dodajanjem katere koli druge kovine kot redukcijskega sredstva. Dodana kovina se oksidira in raztopi, kar omogoča, da se zlato iz raztopine odstrani in pridobi kot trdna oborina.
Redka oksidacijska stanja
Manj pogosta oksidacijska stanja zlata so med drugim -1, +2 in +5.Stopnja oksidacije -1 se pojavi v auridih, spojinah, ki vsebujejo anion Au-. Cezijev aurid (CsAu) na primer kristalizira v motivu cezijevega klorida; [36] Znani so tudi rubidijev, kalijev in tetrametilamonijev avrid.[37] Zlato ima največjo afiniteto do elektronov od vseh kovin, in sicer 222,8 kJ/mol, zaradi česar je Au- stabilna vrsta.[38]
Spojine zlata (II) so običajno diamagnetne z vezmi Au – Au, kot je [Au(CH2)2P(C6H5)2]2Cl2. Izhlapevanje raztopine Au(OH)
3 v koncentriranem H
2SO
4 tvori rdeče kristale Au (II) sulfata, Au2(SO4)2. Prvotno so mislili, da gre za spojino mešanih valenc, vendar so ugotovili, da vsebuje katione Au4+
2, podobno kot bolj znani ion živega srebra (I) Hg2+
2.[39][40] V [AuXe4] (Sb2 F11)2 se pojavi zlati (II) kompleks, tetraksenonozlat (II) kation, ki vsebuje ksenon kot ligand.[41] Pentafluorid zlata, skupaj z derivatnim anionom AuF−
6 in njegov difluorski kompleks, zlati heptafluorid, je edini preverjeni primer zlata (V) v najvišjem oksidacijskem stanju.[42] Nekatere zlate spojine kažejo avrofilno vez, ki opisuje težnjo zlatih ionov, da medsebojno delujejo na razdaljah, ki so predolge za običajne vezi Au-Au, vendar krajše od van der Waals vezi. Meni se, da je interakcija po moči primerljiva z močjo vodikove vezi.Dobro opredeljenih cluster-spojin je veliko.[37] V takih primerih ima zlato fraktionalno oksidacijsko stanje. Reprezentativen primer je oktaedrska vrsta{Au(P(C6H5)3}}62+. Halkogenidi zlata, na primer sulfid, vsebujejo enake količine Au (I) in Au (III).
Uporaba v medicini
Zdravilne aplikacije zlata in njegovih kompleksov imajo tisočletno zgodovino.[43] Za zdravljenje revmatoidnega artritisa se je uporabljalo več kompleksov zlata, najpogosteje uporabljeni avrotiomalat, avrotioglukoza in auranofin. Spojine zlata (I) in zlata (III) so bile raziskovali kot možna zdravila proti raku. Za komplekse zlata (III) je treba upoštevati redukcijo na zlato (0/I) v fizioloških pogojih. Stabilne komplekse je mogoče ustvariti z uporabo različnih vrst bi-, tri- in tetradentatnih ligandskih sistemov, njihova učinkovitost pa so dokazali in vitro in in vivo. [44]
Izvor
Nastanek zlata v vesolju
Zlato naj bi nastalo v nukleosintezi supernove in med trkom nevtronskih zvezd [45], prisotno naj bi bilo že v prahu, iz katerega je nastalo Osončje.[46]
Tradicionalno naj bi zlato v vesolju nastalo z r-procesom (hitrim zajemanjem nevtronov) v nukleosintezi supernove,[47] zadnje čase pa se domneva, da lahko zlato in drugi elementi, težji od železa, nastajajo v r-procesu med trkom nevtronskih zvezd.[48] V obeh primerih so satelitski spektrometri najprej le posredno zaznali nastalo zlato.[49] Avgusta 2017 pa so elektromagnetni observatoriji v združitvi nevtronskih zvezd GW170817 opazili spektroskopske podpise težkih elementov, med drugim tudi zlata, detektorji gravitacijskih valov pa so sočasno potrdili, da gre pri dogodku za združitev nevtronskih zvezd.[50] Trenutni astrofizični modeli kažejo, da je samo ta združitev nevtronskih zvezd morala ustvariti zlata za 3 do 13 zemeljskih mas. Ta znesek, skupaj z ocenami za pogostnost te vrste dogodkov, kaže, da lahko takšne združitve proizvedejo dovolj zlata za količino tega elementa, ki je najti v vesolju.[51]
Najdišča
Na Zemlji zlato najdemo kot rudo v kamninah, nastalih od pred-kambrijskega časa naprej.[52] Najpogosteje se pojavlja kot naravna kovina, običajno v trdni kovinski raztopini s srebrom (tj. kot zlitina zlata in srebra). Takšne zlitine vsebujejo običajno8–10% srebra. Elektrum je elementarno zlato z več kot 20% srebra. Barvo ima od zlato-srebrne do srebrne, odvisno od vsebnosti srebra. Več srebra, manjša je specifična teža .
Izvorno zlato se pojavlja kot zelo majhni do mikroskopski delci, vsajeni v kamnine, pogosto skupaj s kremenovimi ali sulfidnimi minerali, kot je pirit [1].[53] Kovino v avtohtonem stanju najdemo tudi v obliki prostih kosmičev, zrn ali večjih grud [52] ki so erodirale iz kamnin in končale v naplavinah. Tako prosto zlato je vedno bogatejše na površju zlatonosnih žil. Spremljajoči minerali oksidirajo, vreme izpira zlati prah v potoke in reke, kjer se zbira in pod vplivom vode združuje , v kepe.
Zlato se včasih pojavlja v kombinaciji s telurjem, kot so minerali kalaverit, krennerit, nagyagit, petzit in silvanit (glej minerale telurja) ter kot redek bizmutid maldonit (Au2Bi) in antimonid avrostibit (AuSb2). Zlato se pojavlja tudi v redkih zlitinah z bakrom, svincem in živim srebrom : minerali avrikuprid (Cu3 Au), novodneprit (AuPb 3) in vweishanit ((Au,Ag)3Hg2).Nedavne raziskave kažejo, da lahko mikrobi včasih igrajo pomembno vlogo pri oblikovanju, transportu in obarjanju zlata v zrna in grude, ki se zoščujejo v naplavinah.[54]
Morska voda
Oceani naše zemlje vsebujejo zlato. Izmerjene koncentracije zlata v Atlantiku in severovzhodnem Tihem oceanu so 50–150 femtomol/L ali 10–30 delov na kvadrilion (približno 10–30 g/km3). Na splošno so koncentracije zlata za vzorce južnega Atlantika in osrednjega Pacifika enakega reda velikosti (~ 50 femtomol/L), vendar manj zanesljive. Sredozemske globoke vode vsebujejo nekoliko višje koncentracije zlata (100–150 femtomol/L), ki se pripisujejo prahu, ki ga prenaša veter, in/ali rekam. Tako na bi imeli zemeljski oceani vsebovali 15.000 ton zlata.[55] Ti podatki so za tri velikostne razrede manjši, kot so poročali v literaturi pred letom 1988, kar kaže na težave s kontaminacijo prejšnjih podatkov.
Številni ljudje so trdili, da lahko ekonomsko pridobivajo zlato iz morske vode, vendar so se motili ali pa so namerno zavajali. Prescott Jernegan je v ZDA v 1890-ih vodil prevaro z zlatom iz morske vode, prav tako nek angleški prevarant v zgodnjih 1900-ih.[56] Fritz Haber je raziskal pridobivanje zlata iz morske vode, da bi pomagal Nemčiji plačati reparacije po prvi svetovni vojni.[57] Na podlagi objavljenih vrednosti 2 do 64 x 10−9 zlata v morski vodi se je zdelo mogoče, da bi komercialno pridobivanje bilo uspešno. Po analizi 4.000 vzorcev vode, ki je v povprečju dala 0,004 x 10−9 , je postalo jasno, da možnost ekstrakcije ni realna, zato je projekt odpisal.[58]
Zgodovina


Miniaturo splava Muisca je mogoče videti v muzeju zlata v Bogoti v Kolumbiji.
Najzgodnejša zabeležena kovina, ki so jo ljudje rabili, je bilo zlato, ki ga je bilo najti na prostem kot tako imenovano samorodno zlato. Majhne količine naravnega zlata so našli v Španiji v jamah, v katerih so v poznem paleolitiku, ok. 40.000 pr. n. št. živeli naši predniki.[60] Predmeti iz zlata so se prvič pojavili v Egiptu konec 5. in na začetku 4. st. pr. n. št., taljenje pa so odkrili v 4. tisočletju; zlati predmeti se v pojavljajo v arheologiji Spodnje Mezopotamije zgodnjega 4. tisočletja.[61] Zlati artefakti se na Balkanu pojavljajo od 4. tisočletja pr. n. št dalje, na primer v nekropoli v bližini Varniškega jezera v Bolgariji, za katerega en vir (La Niece 2009) meni, da gre za najzgodnejšo "dobro datirano" najdbo zlatih predmetov.[52] Leta 1990 so na pokopališču jame Vadi Kana na Zahodnem bregu odkrili zlate predmete iz 4. tisočletja pr. n. št., ki so najzgodnejši med najdbami iz Levanta.[62] Zlati predmeti, kot so zlati klobuki in Nebesni disk iz Nebre so se v srednji Evropi pojavili v bronasti dobi (2. tisočletja pr. n. št.).
Najstarejši znani zemljevid rudnika zlata je bil narisan v 19. dinastiji starega Egipta (1320–1200 pr. n. št.), medtem ko je bilo prvo pisno sklicevanje na zlato zabeleženo v 12. dinastiji okoli leta 1900 pr. n. št.[63] Egipčanski hieroglifi iz leta 2600 pr. n. št. opisujejo zlato, za katerega je kralj [[mitanski Tušratta trdil, da ga je bilo v Egiptu »več kot smeti«.[64] Egipt in še posebej Nubija sta imela dovolj sredstev, da sta skozi večino zgodovine bili med pomembnimi območji za pridobivanje zlata. Eden najzgodnejših znanih zemljevidov, znan kot Torinski papirus, kaže načrt rudnika zlata v Nubiji skupaj z navedbami o lokalni geologiji. Strabon in Diodor Sicilski sta opisala primitivne delovne metode, med drugim z ognjem. Velike rudnike je bilo najti onkraj Rdečega morja v današnji Saudovi Arabiji.

Zlato se pogosto omenja v Stari zavezi, najprej v Genezi 1Mz 2,11 (pri Havilah), z zgodbo o zlatem teletu in številnih zlatih predmetih v templju, kot sta Menora in zlati oltar. V Novi zavezi je omenjen med darovi Treh kraljev v prvih poglavjih Mateja. Knjiga Razodetja Raz 21,21 piše, da bo mesto Novi Jeruzalem imelo ulice »iz čistega zlata, čiste kot kristal«. Izkoriščanje zlata v jugovzhodnem delu Črnega morja naj bi izviralo iz časov kralja Midasa in to zlato je bilo pomembno za verjetno prvo kovnico denarja na svetu v Lidiji okoli leta 610 pr. n. št..[65] Legenda o zlatem runu iz 8. stoletja pr. n. št. se lahko nanaša na uporabo runa za zajemanje zlatega prahu iz usedlin v starih časih. Od 6. ali 5. stoletja pred našim štetjem je država Ču uporabljala Jing Juan, štirioglate zlate kovance.
V rimski metalurgiji so razvili nove metode za pridobivanje zlata v velikem obsegu z uvedbo hidravličnih rudarskih metod, zlasti v Španiji od 25. pr. n. št. dalje in v Daciji od 106 n. št. Eden največjih rudnikov je bil v kraju Las Médulas v Leonu, kjer so s pomočjo sedmih dolgih vodovodov lahko obdelovali večino velikega naplavinskega nahajališča. Tudi rudniki v kraju Roşia Montană v Transilvaniji so bili zelo veliki, do nedavnega so jih še vedno izkoriščali. Poznana so tudi manjša nahajališča v Rimski Britaniji, kot so diluvialne in trdne kamnine v Dolaucothiju. Različne metode, ki so jih uporabljali, je dobro opisal Plinij starejši v svoji enciklopediji Naturalis Historia, spisani proti koncu 1. stoletja našega štetja.
Na hadžu v Meko leta 1324, ko je bil Mansa Musa (vladar Malijskega imperija od 1312 do 1337) julija 1324 na poti skozi Kairo, pišejo, da ga je spremljala karavana tisoč ljudi in skoraj sto kamel in da je pri tem podaril toliko zlata, da je cena zlata v Egiptu več let padla tako nizko, da je prišlo do visoke inflacije.[66]

Evropsko raziskovanje obeh Amerik so nemalo spodbujala poročila o zlatem okrasju, ki so ga indijanski prebivalci obilno nosili, zlasti v Mezoameriki, Peruju, Ekvadorju in Kolumbiji. Azteki so zlato obravnavali kot proizvod bogov in ga dobesedno imenovali "božji iztrebki" (teocuitlatl v Nahuatlu), po umoru Moctezume II pa so večino tega zlata poslali v Španijo.[68] Za avtohtone prebivalce Severne Amerike pa je bilo zlato neuporabno in veliko večjo vrednost so videli v drugih mineralih, ki so bili veliko bolj uporabni, tako obsidian, kremen in skrilavci.[69]
-
Minojski nakit; 2300 – 2100 pr. n. št. različne velikosti; Metropolitanski muzej umetnosti (New York City)
-
Staroegipčanski kipec Amona ; 945 – 715 Pr. zlato; Metropolitanski muzej umetnosti
-
Staroegipčanski pečatni prstan; 664 – 525 pr. n. št. zlato; premer: 30 mm × 34 mm (1,2 in × 1,3 in); Britanski muzej (London)
-
Starogrški starter ; 323 – 315 pr. n. št. 18 mm (0,71 in) ; Metropolitanski muzej umetnosti
-
Etruščanski pogrebni venec; 4. – 3. stoletje pr. n. št. dolžina: 333 mm (13,1 in) ; Metropolitanski muzej umetnosti
-
Posoda za apno Quimbaya civilizacija 5. – 9. stoletje; zlato; višina: 230 mm (9,1 in) ; Metropolitanski muzej umetnosti
-
Bizantinski skifat ; 1059 – 1067; premer: 25 mm (0,98 in) ; Cleveland Museum of Art Cleveland, Ohio, ZDA)
-
Predkolumbovski obesek z dvema vojakoma; 11. – 16. stoletje; zlato; skupaj: 76,2 mm (3,00 in) ; iz province Chiriqui ( Panama ); Metropolitanski muzej umetnosti
-
Angleški neoklasicistični etui - rimski heroj Gaij Mukij Scaevola pred etruščanskim kraljem Larsom Porseno; 1741; skupaj: 44 mm × 116 mm × 92 mm (1,7 in × 4,6 in × 3,6 in) ; Metropolitanski muzej umetnosti
-
Francoska steklenica iz rokokoja iz zlata; približno 1775; 70 mm × 29 mm (2,8 in × 1,1 in) ; Clevelandski muzej umetnosti
Etimologija

Gold je soroden s podobnimi besedami v mnogih germanskih jezikih, ki izhajajo preko Proto-germanskega * gulþą proto-indo-evropskih * ǵʰelh₃- ( " sijati, lesketati, biti rumene ali zelene barve").[70]
Simbol Au zvira iz latinskega latinsko aurum , to je za "zlato".[71] Proto-indoevropski prednik auruma je bil * h₂é-h₂us-o-, kar pomeni "sijaj". Ta beseda izhaja iz istega korena (proto-indoevropsko * h₂u̯es- "zori") kot * h₂éu̯sōs, prednik latinske besede Aurora, "zarja".[72] Verjetno je to etimološko razmerje v ozadju pogostih trditev v znanstvenih publikacijah, da je aurum pomenil sijočo zarjo.[73]
Proizvodnja
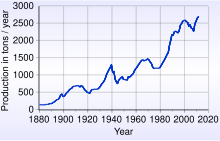
Svetovni svet za zlato navaja, da je bilo konec leta 2017 "iz tal dobljenih 187.200 ton zalog". To lahko predstavlja kocka z dolžino roba približno 21 m (69 ft).[74] V višini 1.349 dolarjev za unčo bi 187.200 ton zlata imelo vrednost 8,9 bilijona dolarjev. Po podatkih Geološke službe ZDA leta 2016 je človeštvo proizvedlo približno 5.726 milijonov troj unč zlata od začetka civilizacije, od tega 85% ostaja v uporabi.[75]
Leta 2017 je bila največja svetovna proizvajalka zlata Kitajska s 440 tonami. Drugi največji proizvajalec, Avstralija, je istega leta izkopala 300 ton, sledi jima Rusija s 255 tonami.[10]
Rudarstvo in raziskovanje najdišč


Od osemdesetih let dvajsetega stoletja je Južna Afrika vir velikega dela svetovne oskrbe z zlatom, približno 22% zlata, ki je trenutno v obtoku, je iz Južne Afrike. Proizvodnja leta 1970 je predstavljala 79% svetovne oskrbe, približno 1.480 ton. Leta 2007 je Kitajska (s 276 tonami) prvič po letu 1905 prehitela Južno Afriko kot največja svetovna proizvajalka zlata.[76]
Od leta 2017 dalje je Kitajska vodilna za pridobivanje zlata na svetu, sledijo ji Avstralija, Rusija, ZDA, Kanada in Peru. Južna Afrika, ki je večino 20. stoletja prevladovala v svetovni proizvodnji zlata, je padla na šesto mesto. Drugi pomembni proizvajalci so Gana, Burkina Faso, Mali, Indonezija in Uzbekistan.
Ekstrakcija in rafiniranje
| Država | 2009 | 2010 | 2011 | 2012 | 2013 |
|---|---|---|---|---|---|
| 442,37 | 745,70 | 986,3 | 864 | 974 | |
| 376,96 | 428,00 | 921,5 | 817,5 | 1120,1 | |
| 150,28 | 128,61 | 199,5 | 161 | 190 | |
| 75,16 | 74,07 | 143 | 118 | 175,2 | |
| 77,75 | 72,95 | 69,1 | 58,5 | 72,2 | |
| 60,12 | 67,50 | 76,7 | 81,9 | 73,3 | |
| 67,60 | 63,37 | 60,9 | 58,1 | 77,1 | |
| 56,68 | 53,43 | 36 | 47,8 | 57,3 | |
| 41,00 | 32,75 | 55 | 52,3 | 68 | |
| 31,75 | 27,35 | 22,6 | 21,1 | 23,4 | |
| Druge države Perzijskega zaliva | 24,10 | 21,97 | 22, | 19,9 | 24,6 |
| 21,85 | 18,50 | −30,1 | 7,6 | 21,3 | |
| 18,83 | 15,87 | 15,5 | 12,1 | 17,5 | |
| 15,08 | 14,36 | 100,8 | 77 | 92,2 | |
| 7,33 | 6,28 | 107,4 | 80,9 | 140,1 | |
| Skupaj | 1466,86 | 1770,71 | 2786,12 | 2477,7 | 3126,1 |
| Druge države | 251,6 | 254,0 | 390,4 | 393,5 | 450,7 |
| Svetovno skupaj | 1718,46 | 2024,71 | 3176,52 | 2871,2 | 3576,8 |
Pridobivanje zlata je najbolj ekonomično na velikih nahajališčih, ki se brez težav izkoriščajo. Razred rude že 0,5 delov na milijon (ppm) je lahko ekonomičen. Tipični donos v odprtih rudnikih je 1–5 dnm; v podzemnih rudnikih ali rudnikih s trdo kamenino je običajno najmanj 3 dnm - bolj konkretno, tri grame zlata na tono rude. Ker rude razreda 30 Običajno je potrebnih 30 dnm, preden lahko zlato vidmo s prostim očesom; tako da je v večini rudnikov zlato nevidno.
Povprečni stroški pridobivanja in ekstracije zlata so leta 2007 znašali približno 317 USD za trojno unčo, glede na vrsto rudarjenja in kakovost rude obstajajo pri tem velike razlike; Svetovna proizvodnja rudnikov je znašala 2.471,1 tone.[80]
Po začetni proizvodnji se zlato pogosto nato industrijsko rafinira po Wohlwillovem postopku, ki temelji na elektrolizi ali Millerjevem postopku, to je s kloriranjem v talini. Proces Wohlwill vodi do večje čistosti, vendar je bolj zapleten in se uporablja le v manjših instalacijah.[81][82]
Od leta 2020 dalje je vsak pridobljen kilogram zlata pusti za sabo16 ton CO2, recikliran kilogram zlata pa le 53 ekvivalentnih kilogramov CO2. Približno 30 odstotkov svetovne oskrbe z zlatom se po letu 2020 reciklira in ne izkoplje.[83]
Poraba
Proizvedeno zlato konča približno 50% v nakitu, 40% v naložbah in 10% v industriji.[9][84][85] Po podatkih Svetovnega sveta za zlato je Kitajska leta 2013 največji posamični porabnik zlata in je prvič prehitela Indijo. kitajska potrošnja se je v enem letu povečala za 32 odstotkov, indijska pa le 13 odstotkov, porast svetovne potrošnje je 21 odstotkov. Za razliko od Indije,kjerse zlato večinoma uporablja za nakit, Kitajska zlato uporablja za proizvodnjo in prodajo na drobno.[86]
Onesnaževanje
Pridelava zlata ima za posledico nevarna onesnaževanja.[87][88]
Ruda nizke vsebnosti lahko vsebuje manj kot eno pnm kovinskega zlata; takšna ruda se zmelje in zmeša z natrijevim cianidom, da se zlato raztopi. Cianid je zelo strupena kemikalija, ki lahko v majhnih količinah umori živa bitja. V razvitih državah in državah v razvoju je prišlo do številnih izlivov cianida [89] iz rudnikov zlata, ki so v dolgih odsekih prizadetih rek ubili vodno življenje. Okoljevarstveniki štejejo te dogodke za velike okoljske katastrofe.[90][91] Odlagališča zlate rude so vir številnih težkih elementov, kot so kadmij, svinec, cink, baker, arzen, selen in živo srebro. Minerali, ki vsebujejo sulfide, so naodlagališčih izpostavljeni zraku in vodi, tako da se sulfid pretvori v žveplovo kislino. Kislina nato raztopi težke kovine, kar olajša njihov prenos v površinsko vodo in podtalnico. Ta odlagališča zlate rude so dolgotrajni, zelo nevarni odpadki, ki so na drugem mestu odlagališč jedrskih odpadkov.
Nekoč se je živo srebro uporabljalo za izločanje zlata iz rude danes; danes je uporaba živega srebra v veliki meri omejena na majhne posamezne rudarje.[92] Tudi najmanjše količine živosrebrovih spojin, ki pridejo v vode, imajo za posledico onesnaženje s težkimi kovinami. Živo srebro lahko nato vstopi v človeško prehranjevalno verigo v obliki metil živega srebra. Zastrupitev z živim srebrom pri ljudeh povzroči neozdravljivo škodo v možganih in močno zaostajanje.
Cena

Od marec 2021, Marca 2021 je cena zlata €46 na gram (€1,445 na troy ounce).
Tako kot druge plemenite kovine se tudi zlato meri s troy unčami in v gramih. Delež zlata v zlitini se meri s karatom (k), pri čemer je 24 karatov (24k) čisto zlato, nižja karatna števila pa so sorazmerno manjša. Čistost zlate palice ali kovanca lahko izrazimo tudi kot decimalno številko v območju od 0 do 1, znano kot millezimalna finost, na primer 0,995.
Cena zlata se določi s trgovanjem na trgih zlata in derivatov, vendar postopek, znan kot Gold Fixing v Londonu, od septembra 1919 dalje industriji zagotavlja dnevno referenčno ceno.
Strupenost
Čisto kovinsko (elementarn0) zlato pri zaužitju ni strupeno in ne draži [93]; včasih se uporablja kot okras za hrano v obliki zlatih lističev.[94] Kovinsko zlato je tudi sestavina alkoholnih pijač Goldschläger, Gold Strike in Goldwasser. Kovinsko zlato je v EU odobreno kot aditiv za živila (E175 v Codex Alimentarius ). Čeprav je zlati ion strupen, je sprejem kovinskega zlata kot aditiva za živila posledica njegove relativne kemične inertnosti in odpornosti proti koroziji ali pretvorbi v topne soli (zlate spojine) s katerim koli znanim kemijskim postopkom, ki bi ga lahko srečali pri človeku. telo.

Topne spojine ( zlate soli ), kot je zlati klorid, so strupene za jetra in ledvice. Običajne cianidne soli zlata, kot je kalijev cianid zlata, ki se uporabljajo pri galvanizaciji zlata, so strupene zaradi vsebnosti cianida in zlata. Primeri smrtonosne zastrupitve s kalijevim zlatim cianidom so redki.[95][96]
Ameriško društvo za kontaktni dermatitis je leta 2001 kovinsko zlato razglasilo za alergen leta; kontaktne alergije na zlato prizadenejo predvsem ženske.[97] Kljub temu je zlato v primerjavi s kovinami, kot je nikelj, relativno šibek kontaktni alergen.[98]
Sklici
- ↑ Meija, Juris; in sod. (2016). »Atomic weights of the elements 2013 (IUPAC Technical Report)«. Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ Mézaille, Nicolas; Avarvari, Narcis; Maigrot, Nicole; Ricard, Louis; Mathey, François; Le Floch, Pascal; Cataldo, Laurent; Berclaz, Théo; Geoffroy, Michel (1999). »Gold(I) and Gold(0) Complexes of Phosphinine‐Based Macrocycles«. Angewandte Chemie International Edition. 38 (21): 3194–3197. doi:10.1002/(SICI)1521-3773(19991102)38:21<3194::AID-ANIE3194>3.0.CO;2-O. PMID 10556900.
- ↑ Lide, D. R., ur. (2005). »Magnetic susceptibility of the elements and inorganic compounds«. CRC Handbook of Chemistry and Physics (PDF) (86th izd.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. str. E110. ISBN 0-8493-0464-4.
- ↑ Kelly, P. F. (2015). Properties of Materials. CRC Press. str. 355. ISBN 978-1-4822-0624-1.
- ↑ Duckenfield, Mark (2016). The Monetary History of Gold: A Documentary History, 1660–1999. Routledge. str. 4. ISBN 9781315476124.
Its scarcity makes it a useful store of value; however, its relative rarity reduced its utility as a currency, especially for transactions in small denominations.
- ↑ Pearce, Susan M. (1993). Museums, Objects, and Collections: A Cultural Study. Smithsonian Books. str. 53. ISBN 9781588345172.
Its scarcity makes it a useful store of value; however, its relative rarity reduced its utility as a currency, especially for transactions in small denominations. ... Rarity is, nevertheless, in itself a source of value, and so is the degree of difficulty which surrounds the winning of the raw material, especially if it is exotic and has to be brought some distance. Gold is, geologically, a relatively rare material on earth and occurs only in specific places which are remote from most other places.
- ↑ »How much gold has been mined?«. gold.org. Pridobljeno 28. maja 2020.
- ↑ 9,0 9,1 Soos, Andy (6. januar 2011). »Gold Mining Boom Increasing Mercury Pollution Risk«. Advanced Media Solutions, Inc. Oilprice.com. Pridobljeno 26. marca 2011.
- ↑ 10,0 10,1 »Gold« (PDF). U.S. Geological Survey, Mineral Commodity Summaries. 2018.
- ↑ 11,0 11,1 Kizuka, Tokushi (1. april 2008). »Atomic configuration and mechanical and electrical properties of stable gold wires of single-atom width«. Physical Review B (v angleščini). 77 (15): 155401. Bibcode:2008PhRvB..77o5401K. doi:10.1103/PhysRevB.77.155401. ISSN 1098-0121.
- ↑ Che Lah, Nurul Akmal; Trigueros, Sonia (2019). »Synthesis and modelling of the mechanical properties of Ag, Au and Cu nanowires«. Sci. Technol. Adv. Mater. 20 (1): 225–261. Bibcode:2019STAdM..20..225L. doi:10.1080/14686996.2019.1585145. ISSN 1468-6996. PMC 6442207. PMID 30956731.
- ↑ »Gold: causes of color«. Arhivirano iz prvotnega spletišča dne 5. maja 2017. Pridobljeno 6. junija 2009.
- ↑ Mallan, Lloyd (1971). Suiting up for space: the evolution of the space suit. John Day Co. str. 216. ISBN 978-0-381-98150-1.
- ↑ Gray, Theo (14. marec 2008). »How to Make Convincing Fake-Gold Bars«. Popular Science. Pridobljeno 18. junija 2008.
- ↑ Willie, Jim (18 November 2009) "Zinc Dimes, Tungsten Gold & Lost Respect Arhivirano 8 October 2011 na Wayback Machine.".
- ↑ »Largest Private Refinery Discovers Gold-Plated Tungsten Bar | Coin Update«. news.coinupdate.com.
- ↑ »Austrians Seize False Gold Tied to London Bullion Theft«. The New York Times. Reuters. 22. december 1983. Pridobljeno 25. marca 2012.
- ↑ Tungsten filled Gold bars, ABC Bullion, Thursday, 22 March 2012
- ↑ Arblaster, J. W. (1995). »Osmium, the Densest Metal Known« (PDF). Platinum Metals Review. 39 (4): 164. Arhivirano iz prvotnega spletišča (PDF) dne 18. oktobra 2016. Pridobljeno 18. marca 2021.
- ↑ Encyclopædia of Chemistry, Theoretical, Practical, and Analytical, as Applied to the Arts and Manufacturers: Glass-zinc. J.B. Lippincott & Company. 1880. str. 70–.
- ↑ »Relativity in Chemistry«. Math.ucr.edu. Pridobljeno 5. aprila 2009.
- ↑ Schmidbaur, Hubert; Cronje, Stephanie; Djordjevic, Bratislav; Schuster, Oliver (2005). »Understanding gold chemistry through relativity«. Chemical Physics. 311 (1–2): 151–161. Bibcode:2005CP....311..151S. doi:10.1016/j.chemphys.2004.09.023.
- ↑ 24,0 24,1 Jewellery Alloys.
- ↑ Electron Microscopy in Microbiology. Academic Press. 1988. ISBN 978-0-08-086049-7.
- ↑ »Nudat 2«. National Nuclear Data Center. Pridobljeno 12. aprila 2012.
- ↑ Hammer, B.; Norskov, J. K. (1995). »Why gold is the noblest of all the metals«. Nature. 376 (6537): 238–240. Bibcode:1995Natur.376..238H. doi:10.1038/376238a0.
- ↑ Johnson, P. B.; Christy, R. W. (1972). »Optical Constants of the Noble Metals«. Physical Review B. 6 (12): 4370–4379. Bibcode:1972PhRvB...6.4370J. doi:10.1103/PhysRevB.6.4370.
- ↑ Shaw III, C. F. (1999). »Gold-Based Medicinal Agents«. Chemical Reviews. 99 (9): 2589–2600. doi:10.1021/cr980431o. PMID 11749494.
- ↑ »Chemistry of Oxygen«. Chemwiki UC Davis. 2. oktober 2013. Arhivirano iz prvotnega spletišča dne 14. julija 2016. Pridobljeno 1. maja 2016.
- ↑ Craig, ur. (1995). Handbook of Corrosion Data. Materials Park, Ohio: ASM International. str. 587. ISBN 978-0-87170-518-1.
- ↑ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry (101. izd.). Academic Press. str. 1286. ISBN 978-0-12-352651-9.
- ↑ Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry. Academic Press. str. 404. ISBN 978-0-12-352651-9.
- ↑ Wiberg, Wiberg & Holleman 2001
- ↑ 35,0 35,1 Emery, J. F.; Ledditcotte, G. W. (Maj 1961). »Nuclear Science Series (NAS-NS 3036) The Radio Chemistry of Gold« (PDF). Oak Ridge, TN: National Academy of Sciences — National Research Council — Subcommittee on Radio Chemistry. Arhivirano iz prvotnega spletišča (PDF) dne 10. novembra 2004. Pridobljeno 24. februarja 2021.
- ↑ Jansen, Martin (2005). »Effects of relativistic motion of electrons on the chemistry of gold and platinum«. Solid State Sciences. 7 (12): 1464–1474. Bibcode:2005SSSci...7.1464J. doi:10.1016/j.solidstatesciences.2005.06.015.
- ↑ 37,0 37,1 Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ↑ Jansen, Martin (2008). »The chemistry of gold as an anion«. Chemical Society Reviews. 37 (9): 1826–1835. doi:10.1039/b708844m. PMID 18762832.
- ↑ Wickleder, Mathias S. (2001). »AuSO4: A True Gold(II) Sulfate with an Au24+ Ion«. Journal of Inorganic and General Chemistry. 627 (9): 2112–2114. doi:10.1002/1521-3749(200109)627:9<2112::AID-ZAAC2112>3.0.CO;2-2.
- ↑ Wickleder, Mathias S. (2007). Devillanova, Francesco A. (ur.). Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium. Royal Society of Chemistry. str. 359–361. ISBN 978-0-85404-366-8.
- ↑ Seidel, S.; Seppelt, K. (2000). »Xenon as a Complex Ligand: The Tetra Xenono Gold(II) Cation in AuXe42+(Sb2F11−)2«. Science. 290 (5489): 117–118. Bibcode:2000Sci...290..117S. doi:10.1126/science.290.5489.117. PMID 11021792.
- ↑ Riedel, S.; Kaupp, M. (2006). »Revising the Highest Oxidation States of the 5d Elements: The Case of Iridium(+VII)«. Angewandte Chemie International Edition. 45 (22): 3708–3711. doi:10.1002/anie.200600274. PMID 16639770.
- ↑ Berners-Price, Susan J. (2011) [2011]. »Gold-Based Therapeutic Agents: A New Perspective«. V Alessio, E. (ur.). Bioinorganic Medicinal Chemistry. Weinheim: Wiley-VCH Verlag GmbH. str. 197–221. doi:10.1002/9783527633104.ch7. ISBN 9783527633104.
- ↑ Casini, Angela; Wai-Yin-Sun, Raymond; Ott, Ingo (2018). »Chapter 7. Medicinal Chemistry of Gold Anticancer Metallodrugs«. V Sigel, Astrid (ur.). Metallo-Drugs:Development and Action of Anticancer Agents. Metal Ions in Life Sciences. Zv. 18. str. 199–217. doi:10.1515/9783110470734-013. ISBN 9783110470734. PMID 29394026.
- ↑ »Earth's Gold Came from Colliding Dead Stars«. David A. Aguilar & Christine Pulliam. cfa.harvard.edu. 17. julij 2013. Pridobljeno 18. februarja 2018.
- ↑ Seeger, Philip A.; Fowler, William A.; Clayton, Donald D. (1965). »Nucleosynthesis of Heavy Elements by Neutron Capture«. The Astrophysical Journal Supplement Series. 11: 121. Bibcode:1965ApJS...11..121S. doi:10.1086/190111.
- ↑ »Supernovas & Supernova Remnants«. Chandra X-ray Observatory. Pridobljeno 28. februarja 2014.
- ↑ Berger, E.; Fong, W.; Chornock, R. (2013). »An r-process Kilonova Associated with the Short-hard GRB 130603B«. The Astrophysical Journal Letters. 774 (2): 4. arXiv:1306.3960. Bibcode:2013ApJ...774L..23B. doi:10.1088/2041-8205/774/2/L23.
- ↑ "we have no spectroscopic evidence that [such] elements have truly been produced," wrote author Stephan Rosswog.Rosswog, Stephan (29. avgust 2013). »Astrophysics: Radioactive glow as a smoking gun«. Nature. 500 (7464): 535–536. Bibcode:2013Natur.500..535R. doi:10.1038/500535a. PMID 23985867.
- ↑ »LIGO and Virgo make first detection of gravitational waves produced by colliding neutron stars« (PDF). LIGO & Virgo collaborations. 16. oktober 2017. Pridobljeno 15. februarja 2018.
- ↑ »Neutron star mergers may create much of the universe's gold«. Sid Perkins. Science AAAS. 20. marec 2018. Pridobljeno 24. marca 2018.
- ↑ 52,0 52,1 52,2 La Niece, Susan (senior metallurgist in the British Museum Department of Conservation and Scientific Research) (15. december 2009). Gold. Harvard University Press. str. 10. ISBN 978-0-674-03590-4. Pridobljeno 10. aprila 2012.
- ↑ Heike, Brian. »Formation of Lode Gold Deposits«. Arizona Gold Prospectors. Arhivirano iz prvotnega spletišča dne 22. januarja 2013. Pridobljeno 24. februarja 2021.
- ↑ »Environment & Nature News – Bugs grow gold that looks like coral«. abc.net.au. 28. januar 2004. Pridobljeno 22. julija 2006.
- ↑ Kenison Falkner, K.; Edmond, J. (1990). »Gold in seawater«. Earth and Planetary Science Letters. 98 (2): 208–221. Bibcode:1990E&PSL..98..208K. doi:10.1016/0012-821X(90)90060-B.
- ↑ Plazak, Dan A Hole in the Ground with a Liar at the Top (Salt Lake: Univ. of Utah Press, 2006) ISBN 0-87480-840-5 (contains a chapter on gold-from seawater swindles)
- ↑ Haber, F. (1927). »Das Gold im Meerwasser«. Zeitschrift für Angewandte Chemie. 40 (11): 303–314. doi:10.1002/ange.19270401103.
- ↑ McHugh, J. B. (1988). »Concentration of gold in natural waters«. Journal of Geochemical Exploration. 30 (1–3): 85–94. doi:10.1016/0375-6742(88)90051-9. Arhivirano iz prvotnega spletišča dne 7. marca 2020.
- ↑ "Furthermore the second member of Delegation XVIII is carrying four small but evidently heavy jars on a yoke, probably containing the gold dust which was the tribute paid by the Indians." in Iran, Délégation archéologique française en (1972). Cahiers de la Délégation archéologique française en Iran. Institut français de recherches en Iran (section archéologique). str. 146.
- ↑ »History of Gold«. Gold Digest. Pridobljeno 4. februarja 2007.
- ↑ Sutherland, C.H.V, Gold (London, Thames & Hudson, 1959) p 27 ff.
- ↑ Gopher, A.; Tsuk, T.; Shalev, S.; Gophna, R. (Avgust–oktober 1990). »Earliest Gold Artifacts in the Levant«. Current Anthropology. 31 (4): 436–443. doi:10.1086/203868. JSTOR 2743275.
- ↑ Pohl, Walter L. (2011) Economic Geology Principles and Practice.
- ↑ Montserrat, Dominic (21. februar 2003). Akhenaten: History, Fantasy and Ancient Egypt. ISBN 978-0-415-30186-2.
- ↑ »A Case for the World's Oldest Coin: Lydian Lion«. Rg.ancients.info. 2. oktober 2003. Pridobljeno 27. oktobra 2013.
- ↑ Mansa Musa.
- ↑ Monnaie, Eucratide I. (roi de Bactriane) Autorité émettrice de. [Monnaie : 20 Statères, Or, Incertain, Bactriane, Eucratide I].
- ↑ Berdan, Frances; Anawalt, Patricia Rieff (1992). The Codex Mendoza. Zv. 2. University of California Press. str. 151. ISBN 978-0-520-06234-4.
- ↑ Sierra Nevada Virtual Museum.
- ↑ Hesse, R W. (2007) Jewelrymaking Through History: An Encyclopedia, Greenwood Publishing Group. ISBN 0313335079
- ↑ Notre Dame University Latin Dictionary Retrieved 7 June 2012
- ↑ de Vaan, Michel (2008). Etymological Dictionary of Latin and the other Italic languages. Leiden: Boston: Brill. str. 63. ISBN 978-90-04-16797-1.
- ↑ Christie, A and Brathwaite, R. (Last updated 2 November 2011) Mineral Commodity Report 14 — Gold, Institute of geological and Nuclear sciences Ltd – Retrieved 7 June 2012
- ↑ »Gold Supply – Mining & Recycling«. World Gold Council.
- ↑ Munteen, John L.; Davis, David A.; Ayling, Bridget (2017). The Nevada Mineral Industry 2016 (PDF) (poročilo). University of Nevada, Reno. OCLC 1061602920. Arhivirano iz prvotnega spletišča (PDF) dne 9. februarja 2019. Pridobljeno 9. februarja 2019.
- ↑ Mandaro, Laura (17. januar 2008). »China now world's largest gold producer; foreign miners at door«. MarketWatch. Pridobljeno 5. aprila 2009.
- ↑ »Gold jewellery consumption by country«. Reuters. 28. februar 2011. Arhivirano iz prvotnega spletišča dne 12. januarja 2012.
- ↑ »Gold Demand Trends | Investment | World Gold Council«. Gold.org. Pridobljeno 12. septembra 2013.
- ↑ »Gold Demand Trends«. 12. november 2015.
- ↑ O'Connell, Rhona (13. april 2007). »Gold mine production costs up by 17% in 2006 while output fell«. Arhivirano iz prvotnega spletišča dne 6. oktobra 2014.
- ↑ Noyes, Robert (1993). Pollution prevention technology handbook. William Andrew. str. 342. ISBN 978-0-8155-1311-7.
- ↑ Pletcher, Derek; Walsh, Frank (1990). Industrial electrochemistry. Springer. str. 244. ISBN 978-0-412-30410-1.
- ↑ Baraniuk, Chris (27. oktober 2020). »Why it's getting harder to mine gold«. BBC. Pridobljeno 29. oktobra 2020.
- ↑ »Country wise gold demand«. Pridobljeno 2. oktobra 2015.
- ↑ »Country wise gold demand«. Pridobljeno 2. oktobra 2015.
- ↑ Harjani, Ansuya (18. februar 2014). »It's official: China overtakes India as top consumer of gold«. Pridobljeno 2. julija 2014.
- ↑ Abdul-Wahab, Sabah Ahmed; Ameer, Marikar, Fouzul (24. oktober 2011). »The environmental impact of gold mines: pollution by heavy metals«. Central European Journal of Engineering. 2 (2): 304–313. Bibcode:2012CEJE....2..304A. doi:10.2478/s13531-011-0052-3.
- ↑ Summit declaration, Peoples' Gold summit, San Juan Ridge, California in June 1999.
- ↑ Cyanide spills from gold mine compared to Chernobyls nuclear disaster Arhivirano 2018-07-14 na Wayback Machine..
- ↑ Death of a river.
- ↑ Cyanide spill second only to Chernobyl.
- ↑ »Pollution from Artisanal Gold Mining, Blacksmith Institute Report 2012« (PDF). Pridobljeno 22. septembra 2015.
- ↑ Dierks, S. (Maj 2005). »Gold MSDS«. Electronic Space Products International. Arhivirano iz prvotnega spletišča dne 10. novembra 2006.
- ↑ Louis, Catherine; Pluchery, Olivier (2012). Gold Nanoparticles for Physics, Chemistry and Biology. World Scientific. ISBN 978-1-84816-807-7.
- ↑ Wright, I. H.; Vesey, J. C. (1986). »Acute poisoning with gold cyanide«. Anaesthesia. 41 (79): 936–939. doi:10.1111/j.1365-2044.1986.tb12920.x. PMID 3022615.
- ↑ Wu, Ming-Ling; Tsai, Wei-Jen; Ger, Jiin; Deng, Jou-Fang; Tsay, Shyh-Haw; in sod. (2001). »Cholestatic Hepatitis Caused by Acute Gold Potassium Cyanide Poisoning«. Clinical Toxicology. 39 (7): 739–743. doi:10.1081/CLT-100108516. PMID 11778673.
- ↑ Tsuruta, Kyoko; Matsunaga, Kayoko; Suzuki, Kayoko; Suzuki, Rie; Akita, Hirotaka; Washimi, Yasuko; Tomitaka, Akiko; Ueda, Hiroshi (2001). »Female predominance of gold allergy«. Contact Dermatitis. 44 (1): 48–49. doi:10.1034/j.1600-0536.2001.440107-22.x. PMID 11156030.
- ↑ Brunk, Doug (15. februar 2008). »Ubiquitous nickel wins skin contact allergy award for 2008«. Arhivirano iz prvotnega spletišča dne 24. junija 2011.































