Informatics Educational Institutions & Programs
Innhold
| Klor | |||
|---|---|---|---|
 | |||
| Basisdata | |||
| Navn | Klor | ||
| Symbol | Cl | ||
| Atomnummer | 17 | ||
| Utseende | Gulaktig grønn | ||
| Plass i periodesystemet | |||
| Gruppe | 17 | ||
| Periode | 3 | ||
| Blokk | p | ||
| Kjemisk serie | halogen | ||
| Atomegenskaper | |||
| Atomvekt | 35,453 u | ||
| Empirisk atomradius | 100 pm | ||
| Kalkulert atomradius | 79 pm | ||
| Kovalent atomradius | 99 pm | ||
| Elektronkonfigurasjon | [Ne] 3s2 3p5 | ||
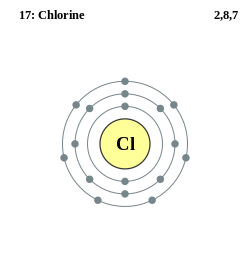
| Elektroner per energinivå | 2, 8, 7 | ||
| Oksidasjonstilstander | ±1, 3, 5, 7 | ||
| Krystallstruktur | ortorombisk | ||
| Fysiske egenskaper | |||
| Stofftilstand | gass | ||
| Smeltepunkt | −101,5 °C | ||
| Kokepunkt | −34,04 °C | ||
| Molart volum | 22,1 · 10-3 m³/mol | ||
| Tetthet | 3,214 kg/m³ | ||
| Kritisk temperatur | 416,9 K | ||
| Kritisk trykk | 7,991 MPa | ||
| Kritisk tetthet | 567 kg/m³ | ||
| Fordampningsvarme | 10,2 kJ/mol | ||
| Smeltevarme | 3,203 kJ/mol | ||
| Damptrykk | 3,67 · 106 Pa | ||
| Lydfart | 206 m/s | ||
| Diverse | |||
| Elektronegativitet etter Pauling-skalaen | 3,16 | ||
| Spesifikk varmekapasitet | 480 J/(kg · K) | ||
| Elektrisk ledningsevne | 0 S/m | ||
| Termisk konduktivitet | 0,0089 W/(m · K) | ||
Klor er et grunnstoff med kjemisk symbol Cl (av gresk chloros) og atomnummer 17.
Historie
Klor ble første gang isolert i 1774 av den svenske kjemikeren Carl Wilhelm Scheele ved å la mangandioksid (MnO2) reagere med saltsyre (HCl). Han var overbevist om at han hadde funnet en oksygen-forbindelse, men i 1810 slo den engelske kjemikeren Humphry Davy fast at det dreide seg om et grunnstoff.
Davy døpte det nye grunnstoffet chlorine fra gresk χλωρός chloros som betyr gulgrønn.
Egenskaper
Klor er et halogen som vi finner i gruppe 17 i det periodiske systemet. Ved romtemperatur er rent klor en diatomisk (Cl2) gul-grønn gass. Den er to og en halv ganger så tung som luft, har en intens ubehagelig kvelende lukt og er giftig. Klor inngår lett kjemiske forbindelser med alle andre grunnstoff bortsett fra O2, N2 og edelgassene, men brenner ikke i luft. Det er imidlertid ikke like reaktivt som fluor. Klor løses lett opp i vann. Sammen med hydrogen – i det som kalles klorknallgass – reagerer det kraftig ved oppvarming. Ren klorgass er giftig.
Isotoper
Naturlig forekommende klor består av to stabile isotoper: 35Cl (75,77 %) og 37Cl (24,23 %). I tillegg finnes 22 kunstig fremstilte ustabile (og dermed radioaktive) isotoper hvorav de mest stabile er 36Cl med halveringstid 3,01 · 105 år, 39Cl med halveringstid 55,6 minutter, 38Cl med halveringstid 37,24 minutter, 34mCl med halveringstid 32 minutter og 40Cl med halveringstid 1,35 minutter. Alle de resterende isotopene har halveringstider kortere enn 1 minutt, og de fleste kortere enn 10 sekunder.[1]
CAS-nummer: 7782-50-5
Forekomst

Klor forekommer ikke i ren form naturlig, men finnes særlig i klorid-forbindelser, siden det er et svært reaktivt (reaksjonsvillig) grunnstoff. Som bestanddel i salter (som for eksempel natriumklorid, kaliumklorid og sinkklorid) finnes det i store mengder over hele jorden. Andelen av klor i jordskorpen er omtrent 0,05 %. Det finnes over 2 400 kjente naturlige klorforbindelser.[2]
Fremstilling av klor foregår ved elektrolyse av natriumklorid eller kaliumklorid.
Anvendelse
Klor brukes i en rekke produkter, og brukes i tillegg til desinfisering av svømmebasseng og drikkevann. Klorgass har også vært brukt som stridsgass i krig.
Se også
Referanser
- ^ Ernest O. Lawrence Berkeley National Laboratory – Isotoptabell for klor Arkivert 23. august 2007 hos Wayback Machine.
- ^ Risk assessment and cycling of natural organochlorines (pdf) Arkivert 22. april 2008 hos Wayback Machine.

















