Informatics Educational Institutions & Programs
Contingut

En l'àmbit de la química, un complex de coordinació o complex metàl·lic és una estructura composta per un àtom central o ió (generalment metàl·lic), unit a una sèrie de molècules o anions, ja siguin lligands o agents complexants,[1][2] que s'hi troben al voltant. L'àtom d'un lligand que està directament unit a l'àtom central o ió s'anomena àtom donador. El lligand dona almenys un parell d'electrons a l'àtom o ió central.
Els compostos que contenen un complex de coordinació s'anomenen compostos de coordinació. L'àtom o ió central, juntament amb tots els lligands, formen l'esfera de coordinació.[3] [4]
El terme coordinació es refereix a "coordinació dels enllaços covalents" (enllaços dipolars) entre els lligands i l'àtom central. Originalment, un complex implica una associació reversible de molècules, àtoms o ions entre enllaços químics febles. Tot i així, aquest significat ha evolucionat en aplicar-se a la química de la coordinació. Actualment, alguns complexos metàl·lics es formen de manera gairebé irreversible i molts d'ells s'uneixen mitjançant enllaços molt forts.[5][6]
Història
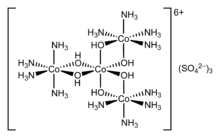
Els complexos de coordinació eren coneguts, encara que no fossin entesos en cap sentit, des dels començaments de la química (s'utilitzaven per exemple el blau de Prússia i el vidriol de coure). L'avenç fonamental es va produir quan Alfred Werner va proposar, entre altres coses, que el Co(III) portava sis lligands, donant lloc a una geometria octaèdrica. Va resoldre el primer complex de coordinació, anomenat hexol, en isòmers òptics, enderrocant la teoria segons la qual la quiralitat estava necessàriament associada amb els compostos de carboni. Aquesta teoria permet entendre la diferència entre el clorur coordinat i el clorur iònic en els clorurs aminats de cobalt, així com explicar molts dels isòmers prèviament inexplicables.
Estructura dels complexos de coordinació
Els ions o molècules que envolten l'àtom central s'anomenen lligands. Aquests es troben generalment units a l'esmentat àtom central mitjançant un enllaç covalent coordinat, donant electrons des d'un parell d'electrons solitari en un orbital metàl·lic buit. Per tant, es diu que estan coordinats amb l'àtom.
Geometria
En la química de coordinació, una estructura és primerament descrita pel seu nombre de coordinació, consistent en el nombre de lligands units al metall (més específicament, el nombre d'enllaços σ entre lligands i l'àtom central). Normalment es poden contar aquests lligands, però de vegades fins i tot el recompte pot resultar ambigu. Els nombres de coordinació es troben sovint entre dos i nou, però no és estrany trobar-ne de més grans en els lantànids i actínids. El nombre d'enllaços depèn de la mida, la càrrega i la configuració electrònica de l'ió metàl·lic i els lligands. Els ions metàl·lics poden tenir més d'un nombre de coordinació.
En general, la química dels complexos està dominada per interaccions entre orbitals moleculars s i p dels lligands i orbitals d dels ions metàl·lics. Els orbitals s, p i d del metall poden acomodar 18 electrons (vegeu la regla dels 18 electrons). El nombre de coordinació màxim per un determinat metall està per tant relacionat amb la configuració electrònica de l'ió metàl·lic (més específicament, el nombre d'orbitals buits) i la relació entre la mida dels lligands i l'ió metàl·lic. Els metalls grans amb lligands petits arriben a nombres de coordinació molt elevats, per exemple el [Mo(CN)8]4-. Per contra, els metalls petits amb lligands grans arriben a nombres de coordinació petits, per exemple el Pt[P(CMe3)]2. Com a conseqüència de la seva mida tan gran, els lantànids, els actínids i els metalls de transició solen tenir nombres de coordinació elevats.
Depenent del nombre de coordinació es poden trobar diferents organitzacions estructurals dels lligands. La majoria de les estructures segueixen el model de punts en una esfera (com si l'àtom central es trobés al mig d'un poliedre i els lligands en els vèrtexs de la figura), on els orbitals dels lligands i els orbitals metàl·lics se superposen i les repulsions lligand-lligand donen lloc a determinades geometries regulars. Les geometries més observades es troben posteriorment en una llista, però hi ha diversos casos que es desvien d'una geometria regular. És el cas de l'ús de lligands de diferent tipus, la qual cosa fa que la llargada dels enllaços no sigui la mateixa i la coordinació dels àtoms no segueixi el model de punts en una esfera. També pot ser degut a la mida dels lligands o als efectes electrònics (vegeu l'efecte Jahn-Teller).
- Lineal: coordinació de dos
- Plana triangular: coordinació de tres
- Tetraèdrica o plana quadrada: coordinació de quatre
- Bipiràmide trigonal o piràmide quadrada: coordinació de cinc
- Octaèdrica o prismàtica trigonal: coordinació de sis
- Bipiràmide pentagonal: coordinació de set
- Quadrada antiprismàtica: coordinació de vuit
- Prismàtica trigonal de tres capes: coordinació de nou
Cal tenir en compte algunes excepcions:
- Les descripcions idealitzades de les coordinacions de 5, 7, 8 i 9 són sovint geomètricament indiferents d'estructures alternatives amb angles L-M-L (lligand-metall-lligand) lleugerament diferents, L'exemple clàssic d'això és la diferència entre l'estructura de piràmide quadrada i l'estructura de bipiràmide trigonal.
- Degut a efectes electrònics especials, com és el cas de l'efecte Jahn-Teller, algunes geometries s'estabilitzen en relació amb altres possibilitats. Per exemple, alguns compostos de la geometria prismàtica trigonal s'estabilitzen en relació a les estructures octaèdriques en la coordinació de sis.
Isomeria
La disposició dels lligands està fixada per cada complex, però en alguns casos és variable mitjançant una reacció que constitueix un altre isòmer estable. Existeixen diversos tipus d'isomeries en els complexos de coordinació, així com em molts altres compostos.
Estereoisomeria
L'estereoisomeria té lloc quan els mateixos enllaços adquireixen diferents orientacions. Es pot classificar en:
Isomeria cis-trans i isomeria facial-meridional
La isomeria cis-trans succeeix en els complexos octaèdrics i plans quadrats, però no en els tetraèdrics. Quan dos lligands són mútuament adjacents s'anomenen cis, mentre que quan s'oposen entre si s'anomenen trans. Quan tres lligands idèntics ocupen la cara d'un octaedre, es diu que l'isòmer és facial, o bé fac. En un isòmer fac, dos lligands qualsevol són adjacents o cis. Si aquests tres lligands i els ions metàl·lics es troben en un mateix pla, es diu que l'isòmer és meridional, o bé mer. Un isòmer mer es pot considerar com una combinació de trans i cis, ja que conté ambdós isòmers en els parells de lligands idèntics.
Isomeria òptica
La isomeria òptica té lloc quan la imatge de mirall d'un compost no és superposable amb el compost original (un és la imatge especular de l'altre). S'anomena així perquè alguns compostos són òpticament actius, és a dir, desvien el pla de la llum polaritzada en diferent direcció. L'isòmer dextrogir o forma dextro ho fa cap a la dreta (en sentit de les agulles del rellotge) i es representa amb la lletra D o el signe +. Per contra, l'isòmer levogir o forma levo ho fa cap a l'esquerra (en sentit contrari a les agulles del rellotge) i es representa amb una lletra L o el signe -.[7]
Isomeria estructural
La isomeria estructural té lloc quan els enllaços són diferents entre si. La isomeria de connexió és només un dels diversos tipus d'isomeria estructural en els complexos de coordinació (així com altres classes de compostos químics). La isomeria de connexió succeeix amb els lligands que poden unir-se a més d'un lloc, per exemple, el NO2: pot unir-se a l'àtom de N o a l'àtom d'O.
Propietats electròniques dels complexos metàl·lics
Moltes de les propietats dels complexos metàl·lics es regeixen per les seves estructures electròniques. L'estructura electrònica es pot descriure per un model iònic que atribueix càrregues als metalls i lligands. Aquest punt de vista és l'essència de la teoria del camp cristal·lí. Aquesta, introduïda per Hans Bethe el 1929, ofereix una mecànica quàntica basada en l'intent de comprensió dels complexos. Però la teoria del camp cristal·lí tracta totes les interaccions en un complex com interaccions iòniques i assumeix que els lligands es poden aproximar per càrregues puntuals negatives.
Alguns models més sofisticats inclouen la covalència. Aquesta visió és descrita per la teoria del camp de lligands i la teoria de l'orbital molecular. La teoria del camp de lligands, introduïda el 1935 i construïda a partir de la teoria de l'orbital molecular, pot manejar una gamma més àmplia de complexos i pot explicar complexos en què les interaccions són covalents. Les aplicacions químiques de la teoria de grups pot ajudar a entendre la teoria del camp de lligands i la teoria del camp cristal·lí, ja que permet solucions simples, basades en la simetria, a les equacions formals.
Els químics tendeixen a utilitzar el model més simple requerit per predir les propietats d'interès. Per aquest motiu, la teoria del camp cristal·lí ha estat la favorita per utilitzar en els debats, sempre que ha estat possible. La teoria del camp de lligands i la teoria de l'orbital molecular són més complicades, però proporcionen una perspectiva més realista.
La configuració electrònica dels complexos els dona algunes propietats importants:
Color
Els complexos metàl·lics tenen sovint colors espectaculars, causats per les transicions electròniques mitjançant l'absorció de la llum. La majoria de transicions que estan relacionades amb els complexos metàl·lics de color són transicions d-d o bé bandes de transferència de càrregues. En les transicions d-d, un electró en un orbital d del metall és excitat per un fotó a un altre orbital d de més energia. D'altra banda, una banda de transferència de càrregues implica la transferència d'electrons des de l'orbital d'un metall a l'orbital buit d'un lligand. També es pot donar el contrari: l'excitació d'un electró de l'orbital d'un lligand a l'orbital buit d'un metall. Aquests fenòmens es poden observar amb l'ajuda de l'espectroscòpia electrònica, coneguda també com a UV-Vis.[8] Per compostos simples amb una clara simetria, les transicions d-d es poden assignar utilitzant els diagrames de Tanabe-Sugano. Aquestes assignacions s'estan realitzant, cada vegada més, amb el suport de la química computacional.
Magnetisme
Els complexos metàl·lics que tenen electrons desaparellats són magnètics. Considerant únicament els complexos monometàl·lics, els electrons desaparellats sorgeixen perquè el complex té un nombre senar d'electrons, o perquè l'aparellament d'electrons està desestabilitzat. D'aquesta manera, les espècies monomèriques de Ti(III), que tenen un electró desaparellat, han de ser magnètiques, independentment de la geometria o la naturalesa dels lligands. El Ti (II), amb dos electrons desaparellats, forma complexos que tenen dos electrons desaparellats i altres sense cap electró desaparellat. Aquest efecte es pot il·lustrar amb el compost TiX2[(CH3)2PCH2CH2P(CH3)2]2: quan X=Cl, el complex és paramagnètic (configuració de high-spin), mentre que quan X=CH3, el complex és diamagnètic (configuració de low-spin). És important adonar-se que els lligands proporcionen un important instrument d'ajust de les propietats de l'estat fonamental.
En els complexos bimetàl·lics i polimetàl·lics, on els centres individuals tenen un nombre senar d'electrons o són high-spin, la situació és més complicada. Si hi ha una interacció (ja sigui directa o a través del lligand) entre dos o més centres metàl·lics, els electrons es poden aparellar (aparellament antiferromagnètic, donant lloc a un compost diamagnètic), o bé reforçar mútuament (aparellament ferromagnètic). Quan no hi ha interacció, els dos o més centres metàl·lics individuals es comporten com en dues molècules separades.
Reactivitat
Els complexos mostren una varietat de possibles reactivitats:
- Transferència electrònica
Una reacció comuna entre els lligands dels complexos de coordinació és la transferència d'electrons dins i fora de l'esfera. Es tracta de dos mecanismes diferents de transferència d'electrons mitjançant reaccions redox, principalment definit per Henry Taube. En una reacció de dins de l'esfera, un lligand amb dos parells d'electrons solitaris actua com un lligand pont, és a dir, un lligand al qual poden unir-se ambdós centres de coordinació. Mitjançant aquest, els electrons són transferits des d'un centre a un altre.
- Intercanvi de lligands degenerats
- Un important indicador de la reactivitat és la taxa de l'intercanvi de lligands degenerats. Per exemple, la taxa d'intercanvi de l'aigua coordinada en el complexos de tipus [M(H2O)6]n+ varia més de 20 ordres de magnitud. Els complexos en què els lligands són alliberats i units de nou ràpidament són classificats com a làbils. Aquests complexos làbils poden ser, termodinàmicament, força estables. Els complexos metàl·lics làbils típics tenen càrrega petita (Na+), electrons en els orbitals d que són antienllaçants respecte als lligands (Zn2+) o bé manca de covalència (Ln3+, on Ln és qualsevol lantànid). La labilitat d'un complex metàl·lic també depèn de la configuració high-spin o low-spin, quan això és possible. Així, el Fe(II) i el Co(III), quan tenen conformació high-spin, formen complexos làbils, mentre que els seus anàlegs amb conformació low-spin són inerts. El Cr(III) només pot existir en l'estat low-spin (quartet), que és inert degut al seu elevat estat d'oxidació i a l'absència d'electrons en els orbitals antienllaçants M-L, a més de l'estabilització del camp de lligands associada amb la configuració d3.
- Processos associatius
- Els complexos que tenen orbitals buits o semi-buits, tenen sovint la capacitat de reaccionar amb substrats. La majoria de substrats tenen un singlet ground-state, la qual cosa significa que tenen parelles d'electrons solitaris (per exemple l'aigua, les maines i els èters), així que aquests substrats necessiten un orbital lliure per reaccionar amb un centre metàl·lic. Alguns substrats (per exemple l'oxigen molecular) tenen un triplet ground-state, per la qual cosa els metalls amb orbitals semi-buits tenen tendència a reaccionar amb aquests substrats (cal dir que la molècula de dioxigen també té parells d'electrons en solitari, així que també és capaç de reaccionar com una base de Lewis "normal"). Si els lligands al voltant del metall són acuradament seleccionats, el metall pot ajudar en les transformacions (estequiomètrica o catalítica) de molècules, o ser usat com a sensor.
Classificació
Els complexos metàl·lics, també coneguts com a compostos de coordinació, inclouen tots els compostos metàl·lics, a més dels vapors de metalls, plasmes i aliatges. L'estudi de la "química de la coordinació" és l'estudi de la química inorgànica de tots els alcalins, alcalinoterris, metalls de transició, lantànids, actínids i metal·loides. Així, la química de la coordinació és la química de la majoria de la taula periòdica. Els metalls i els ions metàl·lics només existeixen, almenys en les fases condensades, envoltats per lligands.
Les àrees de la química de la coordinació es poden classificar segons la naturalesa dels lligands, a grans trets:
- Clàssica (o "Complexos de Werner")
- Els lligands en la química de la coordinació clàssica s'uneixen als metalls, gairebé exclusivament mitjançant els seus parells solitaris d'electrons residents al grup principal d'àtoms del lligand. Els lligands típics són H₂O, NH₃, Cl−, CN−, en− Exemples: [Co(EDTA)]−, [Co(NH3)6]Cl3, [Fe(C₂O₄)₃]K₃.
- Química organometàl·lica
- Els lligands són orgànics (alquens, alquins o alquils), així com lligands semblants als orgànics, com és el cas de les fosfines, l'hídrid i el CO. Exemple: (C₅H₅)Fe(CO)₂CH₃.
- Química bioinorgànica
- Els lligands són proporcionats per la natura, incloent especialment les cadenes laterals dels aminoàcids i la majoria dels cofactors, com ara les porfirines. Exemple: hemoglobina. La majoria de lligands naturals són clàssics, especialment l'aigua.
- Química dels agregats
- Els lligands són tots els anteriors, a més d'altres metalls que funcionen com a lligands.
Exemple: Ru₃(CO)₁₂
- En alguns casos, podem trobar combinacions de diferents tipus de lligands
Exemple [Fe4S4(Escisteinil)₄]2−, en què un agregat està integrat en una espècie biològicament activa.
La mineralogia, la ciència dels materials i la química de l'estat sòlid, les quals s'apliquen als ions metàl·lics, són subconjunts de la química de la coordinació en el sentit que els materials estan envoltats per lligands. En molts casos, aquests lligands són òxids o sulfits, però, no obstant això, els metalls estan coordinats. Els principis i directrius discutits s'apliquen a continuació. És veritat que el focus de la mineralogia, la ciència dels materials i la química de l'estat sòlid difereix del focus usual de la química de la coordinació o la química inorgànica. Els primers s'ocupen principalment d'estructures de polímers, propietats derivades d'un efecte col·lectiu de molts metalls altament interconnectats. Per contra, la química de la coordinació se centra en la reactivitat i les propietats dels complexos que contenen àtoms metàl·lics individuals o petits conjunts d'àtoms metàl·lics.
Classificació tradicional d'isomeria
La classificació tradicional dels tipus d'isomeria s'ha convertit en arcaica amb l'arribada de la química estructural moderna. En la literatura antiga, podem trobar:
- Isomeria d'ionització
- Descriu els possibles isòmers derivats de l'intercanvi entre l'esfera interna i l'esfera externa. Aquesta classificació es basa en una classificació arcaica de l'esfera interna i l'esfera externa. En aquesta classificació, els "lligands de l'esfera externa", quan es tracta d'ions en dissolució, poden passar a ser "lligands de l'esfera interna" per donar lloc a un isòmer.
- Isomeria de solvatació
- Té lloc quan un lligand de l'esfera interna és reemplaçat per una molècula de dissolvent. Aquesta classificació és obsoleta perquè considera que els solvents són diferents de la resta de lligands. Alguns dels problemes s'analitzen sota l'aigua de cristal·lització.
Nomenclatura
El procés bàsic per a la denominació d'un complex és el següent:
- En denominar un ió complex, els lligands es mencionen abans que l'ió metàl·lic.
- Escriure els noms dels lligands en ordre alfabètic (els prefixos numèrics no afecten l'ordre).
- Múltiples lligands monodentats (un únic punt d'unió) reben un prefix d'acord amb el nombre d'ocurrències: di-, tri-, tetra-, penta- o hexa-. Els lligands polidentats (més d'un punt d'unió),com ara l'etilendiamina o l'oxalat, reben els prefixos bis-, tris-, tetraquis-, etc.
- Els anions acaben en o. Aquesta lletra s'afegeix al final del sufix quan l'anió acaba en "-at" (per exemple sulfat es transforma en sulfat) i substitueix el sufix "-ida" (per exemple cianida es transforma en ciano).
- Els lligands neutres conserven el seu nom comú, amb algunes excepcions: el grup NH3 es transforma en amino, l'H2O esdevé aquo, el CO es transforma en carbonil i l'NO esdevé nitrosil.
- Escriure el nom de l'àtom o ió central. Si el complex és un anió, el nom de l'àtom central acabarà en –at, i, si és possible, s'utilitzarà el seu nom en llatí (excepte en el cas del mercuri).
- Si l'estat d'oxidació de l'àtom central necessita ser especificat (quan n'hi ha més d'un possible), escriure'l en nombres romans (o 0) entre parèntesis.
- Anomenar cations i anions com a paraules separades.
Exemples:
[NiCl₄]2− → ió tetracloroniquelat(II)
[CuCl₅NH₃]3− → ió aminopentaclorocuprat(II)
[Cd(en)2(CN)₂] → dicianobis(etilendiamino)cadmi(II)
[CoCl(NH₃)₅]SO₄ → sulfat de pentaaminoclorocobalt(III)
El nombre de coordinació dels lligands adjunts a més d'un metall (lligands pont) s'indica mitjançant un subíndex del símbol grec μ col·locat abans del nom del lligand. Per tant, el dímer de triclorur d'alumini es descriu mitjançant Al2Cl4(μ2-Cl)2.
Aplicació dels compostos de coordinació
- S'utilitzen en fotografia. Per exemple, l'AgBr forma complexos solubles amb el tiosulfat de sodi en les fotografies.
- El K[Ag(CN)₂] s'utilitza en la galvanització de la plata i el K[Au(CN)2] en el recobriment d'or.
- Alguns lligands oxiden l'ió Co2+ a Co3+.
- L'EDTA (àcid etilendiaminotetraacètic) s'utilitza per estimar la quantitat de Ca2+ i Mg2+ de l'aigua dura.
- La plata i l'or s'extreuen mitjançant el tractament del zinc amb els seus complexos cianats.
Referències
- ↑ IUPAC definition of complex
- ↑ IUPAC definition of coordination entity
- ↑ chemistry-dictionary.com - Definition of coordination sphere
- ↑ What Is A Coordination Compound?
- ↑ Cotton, Frank Albert; Geoffrey Wilkinson, Carlos A. Murillo. Advanced Inorganic Chemistry, 1999, p. 1355. ISBN 0471199575, 9780471199571.
- ↑ Miessler, Gary L.; Donald Arthur Tarr. Inorganic Chemistry, 1999, p. 642. ISBN 0138418918, 9780138418915.
- ↑ Miessler, Gary L.; Donald Arthur Tarr. «9». A: Inorganic Chemistry, 1999, p. 315,316. ISBN 0138418918, 9780138418915.
- ↑ Harris, D., Bertolucci, M., Symmetry and Spectroscopy. 1989 New York, Dover Publications
Bibliografia
- De Vito, D.; Weber, J.; Merbach, A. E. "Calculated Volume and Energy Profiles for Water Exchange on t2g 6 Rhodium(III) and Iridium(III) Hexaaquaions: Conclusive Evidence for an Ia Mechanism" Inorganic Chemistry, 2005, Volume 43, pages 858-863.
- Zumdahl, Steven S. Chemical Principles, Fifth Edition. New York: Houghton Mifflin, 2005. 943-946, 957.
- Harris, D., Bertolucci, M., Symmetry and Spectroscopy. 1989 New York, Dover Publications
















![cis-[CoCl₂(NH₃)₄]+](https://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Cis-dichlorotetraamminecobalt%28III%29.png/132px-Cis-dichlorotetraamminecobalt%28III%29.png)
![trans-[CoCl₂(NH₃)₄]+](https://upload.wikimedia.org/wikipedia/commons/thumb/5/56/Trans-dichlorotetraamminecobalt%28III%29.png/150px-Trans-dichlorotetraamminecobalt%28III%29.png)
![fac-[CoCl₃(NH₃)₃]](https://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl₃(NH₃)₃]](https://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/136px-Mer-trichlorotriamminecobalt%28III%29.png)
![L-[Fe(ox)₃]3−](https://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png/110px-Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![D-[Fe(ox)₃]3−](https://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png/111px-Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![L-cis-[CoCl₂(en)₂]+](https://upload.wikimedia.org/wikipedia/commons/thumb/1/12/Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
![D-cis-[CoCl₂(en)₂]+](https://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)

