Histopathology image classification: Highlighting the gap between manual analysis and AI automation
Indice
Con stato della materia (o stato di aggregazione delle molecole) si intende una classificazione convenzionale degli stati che può assumere la materia a seconda delle proprietà meccaniche che manifesta.
I principali stati della materia
La distinzione tra gli stati della materia viene storicamente fatta basandosi sulle seguenti differenze qualitative:
- una materia allo stato solido ha un volume e una forma propria;
- una materia allo stato liquido ha un volume proprio, ma acquisisce la forma del recipiente che la contiene;
- una materia allo stato gassoso (o aeriforme) non ha né volume né forma propria, ma si espande fino a occupare tutto lo spazio disponibile.
- una materia allo stato plasmatico può somigliare a un gas non avendo forma propria e può espandersi come un aeriforme, dal quale si distingue per la sua ionizzazione.
- una materia allo stato condensato di Bose-Einstein è una nuvola di atomi ultrafreddi ad alta densità col comportamento di un superatomo.

Solido
Nello stato solido i costituenti della materia sono legati da forze molto intense che consentono soltanto moti di vibrazione attorno a posizioni di equilibrio; nella maggior parte dei casi gli atomi o le molecole costituenti si distribuiscono in maniera geometricamente regolare formando un reticolo cristallino, oppure in maniera non regolare (disordinata) formando una solido amorfo. L'unico modo per variare la forma di un solido consiste nell'applicazione di forze, ciò può causare deformazioni plastiche o elastiche.
Liquido
Nello stato liquido le forze tra i componenti della materia sono meno intense ed essi sono liberi di scorrere gli uni sugli altri. Un liquido va incontro a variazioni di volume molto meno marcate rispetto ai gas tanto che nel linguaggio comune si dice impropriamente che il volume dei liquidi non varia, ma questo non è vero: piuttosto, a parità di variazione di temperatura ΔT o variazione di pressione ΔP, la variazione di volume nei liquidi è molto più bassa della variazione di volume nei gas e il liquido tende ad assumere la forma del recipiente nel quale è contenuto.
Aeriforme
Nello stato aeriforme le interazioni sono estremamente deboli e ai costituenti è consentito muoversi indipendentemente; di conseguenza, gli aeriformi non hanno forma propria e tendono a espandersi e occupare tutto il volume disponibile, risultando comprimibili.
Particolari aeriformi sono i gas, i vapori e i fluidi supercritici.
Plasma
Lo stato plasmatico è simile a un gas ma è ionizzato, costituito da un insieme di elettroni e ioni e globalmente neutro (la cui carica elettrica totale è nulla). In quanto tale, il plasma è considerato come il quarto stato della materia, che si distingue quindi dal solido, dal liquido e dall'aeriforme, mentre il termine "ionizzato" indica che una frazione significativamente grande di elettroni è stata strappata dai rispettivi atomi.
Condensato di Bose-Einstein
Il condensato si forma quando dei bosoni sono raffreddati a temperature di poco superiori allo zero assoluto. In questo stato la maggior parte delle particelle del condensato occupa lo stato quantistico di minima energia, e gli effetti quantistici (come la sovrapposizione delle loro funzioni d'onda), che di solito sono rilevanti solo su scala microscopica, diventano osservabili anche a livello macroscopico. Possono essere formati a partire da gas a bassa densità di atomi ultrafreddi, o da alcune quasiparticelle all'interno di solidi, come gli eccitoni. Ha molte somiglianze con lo stato superfluido dell'elio-4.
Altri stati
Nella scienza moderna in realtà questa semplice classificazione risulta inadeguata a descrivere esaustivamente le numerose possibilità che ha la materia di organizzarsi. Il plasma e il condensato di Bose-Einstein sono stati probabilmente i primi nuovi stati della materia a essere aggiunti a questa catalogazione,[1] ma ce ne sono molti altri, i quali compaiono in condizioni particolari di temperatura e pressione:
- Ghiaccio - ce ne sono vari tipi, denominati ghiaccio I, ghiaccio II, ghiaccio III e così via fino al ghiaccio XIX;
- Superfluido: elio a bassissime temperature;
- Stato supercritico;
- Supersolido;
- Colloidale;
- Neutronio;
- Materia fortemente simmetrica;
- Materia fortemente asimmetrica;
- Materia strana;
- Condensato chirale;
- Materia degenere;
- Plasma di quark e gluoni;
- Cristallo liquido;
- Eccitonio;
- Condensato fermionico;
- Materia fotonica;
- Superconduttore;
- Fluido supercritico;
- Metallo di Jahn-Taller;
- Conduttore balistico;
- Fluido quasiparticellari;
- Dropletonio;
- Liquido di spin-quantico;
- Fluido string-net.
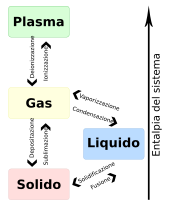
Cambiamenti di stato
Quando la materia viene sottoposta a variazione di pressione e temperatura può passare a uno stato di aggregazione diverso, si verifica quindi un passaggio di stato.
Ogni passaggio di stato è caratterizzato dalla rottura o dalla formazione di legami chimici, durante il cambiamento di stato la temperatura del sistema rimane costante e ogni sostanza per cambiare stato ha bisogno di una certa quantità di calore, il calore latente, di ioni o di energia.
I passaggi di stato sono i seguenti:[2][3]
- fusione: passaggio dallo stato solido a quello liquido, avviene con acquisto di calore (processo endotermico);
- solidificazione: passaggio dallo stato liquido a quello solido, viene ceduto del calore (processo esotermico);
- vaporizzazione: passaggio dallo stato liquido a quello aeriforme, viene acquisito calore (endotermico);
- condensazione: passaggio dallo stato aeriforme a quello liquido, avviene con cessione di calore (esotermico);
- liquefazione: passaggio dallo stato gassoso a quello liquido per compressione, soltanto se l'aeriforme è a temperatura inferiore alla temperatura critica (esotermico);
- brinamento: passaggio dallo stato gassoso a quello solido (esotermico);
- sublimazione: passaggio dallo stato solido a quello aeriforme (endotermico);
- ionizzazione: passaggio dallo stato aeriforme a quello plasmatico;
- deionizzazione: passaggio dallo stato plasmatico a quello aeriforme;
- condensazione quantistica: passaggio dallo stato aeriforme (liquido bosonico) a quello condensato di Bose-Einstein;
- decondensazione quantistica: passaggio dallo stato condensato di Bose-Einstein a quello aeriforme (liquido bosonico).
Note
- ^ Rolla, p. 89.
- ^ Sito web di riferimento, su gmpe.it.
- ^ chimica-online.it, https://www.chimica-online.it/download/passaggi-di-stato.htm.
Bibliografia
- Luigi Rolla, Chimica e mineralogia. Per le Scuole superiori, 29ª ed., Dante Alighieri, 1987.
Voci correlate
- Cristalli liquidi
- Fase (chimica)
- Aeriforme
- Liquido
- Solido
- Fisica del plasma
- Fluido
- Superfluido
- Colloide
- Stato supercritico
- Cambiamento di stato
- Entalpia
- Cristallo di Wigner
Altri progetti
 Wikimedia Commons contiene immagini o altri file sullo stato della materia
Wikimedia Commons contiene immagini o altri file sullo stato della materia
Collegamenti esterni
- aggregazióne, stati di, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- Esperienze in laboratorio - Gli stati di aggregazione della materia ed i passaggi di stato, su itchiavari.org.
| Controllo di autorità | GND (DE) 4141615-6 |
|---|