Histopathology image classification: Highlighting the gap between manual analysis and AI automation
Daftar isi
38Sr Stronsium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Stronsium dalam bentuk kristal sintetis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Garis spektrum stronsium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | metalik putih keperakan; dengan warna kuning pucat[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stronsium dalam tabel periodik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 2 (logam alkali tanah) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | logam alkali tanah | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Kr] 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 1050 K (777 °C, 1431 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik didih | 1650 K (1377 °C, 2511 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 2,64 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| saat cair, pada t.l. | 2,375 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 7,43 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 141 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 26,4 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | +1,[3] +2 (oksida basa kuat) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 0,95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 549,5 kJ/mol ke-2: 1064,2 kJ/mol ke-3: 4138 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 215 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 195±10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 249 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka (fcc) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekspansi kalor | 22,5 µm/(m·K) (suhu 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 35,4 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitas listrik | 132 nΩ·m (suhu 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arah magnet | paramagnetik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | −92,0×10−6 cm3/mol (298 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Young | 15,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Shear | 6,1 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rasio Poisson | 0,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skala Mohs | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-24-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penamaan | dari mineral stronsianit, ia sendiri dinamai dari Strontian, Skotlandia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | W. Cruickshank (1787) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isolasi pertama | H. Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop stronsium yang utama | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Stronsium adalah sebuah unsur kimia dengan lambang Sr dan nomor atom 38. Strontium merupakan logam alkali tanah dengan tekstur yang lunak dan berwarna putih keperakan kekuningan yang sangat reaktif secara kimiawi. Logam stronsium membentuk lapisan oksida gelap ketika terkena udara. Stronsium memiliki sifat fisik dan kimia yang mirip dengan dua tetangga vertikalnya dalam tabel periodik, kalsium dan barium. Ia terjadi secara alami terutama dalam mineral selestin dan stronsianit, dan sebagian besar ditambang dari mereka berdua.
Baik stronsium maupun stronsianit dinamai dari Strontian, sebuah desa di Skotlandia di mana mineral tersebut ditemukan pada tahun 1790 oleh Adair Crawford dan William Cruickshank; ia diidentifikasi sebagai unsur baru pada tahun berikutnya dari warna uji nyala merah lembayungnya. Stronsium pertama kali diisolasi sebagai logam pada tahun 1808 oleh Humphry Davy menggunakan proses elektrolisis yang baru ditemukan. Selama abad ke-19, stronsium banyak digunakan dalam produksi gula dari bit gula (lihat proses strontian). Pada puncak produksi tabung sinar katoda televisi, sebanyak 75% konsumsi stronsium di Amerika Serikat digunakan untuk kaca pelat muka.[5] Dengan penggantian tabung sinar katoda menjadi metode tampilan lainnya, konsumsi stronsium menurun drastis.[5]
Walaupun stronsium alami (yang sebagian besar merupakan isotop stronsium-88) itu stabil, stronsium-90 sintetis bersifat radioaktif dan merupakan salah satu komponen paling berbahaya dari luruhan nuklir, karena stronsium diserap oleh tubuh dengan cara yang mirip dengan kalsium. Sebaliknya, stronsium stabil alami tidak berbahaya bagi kesehatan.
Karakteristik

Stronsium adalah logam keperakan divalen dengan semburat kuning pucat yang sifatnya sebagian besar mirip dengan tetangganya kalsium dan barium.[6] Ia lebih lembut dari kalsium dan lebih keras dari barium. Titik lebur (777 °C) dan didihnya (1377 °C) lebih rendah daripada kalsium (masing-masing 842 °C dan 1484 °C); barium melanjutkan tren penurunan ini pada titik lebur (727 °C), tetapi tidak pada titik didihnya (1900 °C). Massa jenis stronsium (2,64 g/cm3) berada di antara massa jenis kalsium (1,54 g/cm3) dan barium (3,594 g/cm3).[7] Ada tiga alotrop metalik stronsium, dengan titik transisi pada suhu 235 dan 540 °C.[8]
Potensial elektroda standar untuk pasangan Sr2+/Sr adalah −2,89 V, kira-kira di tengah-tengah antara pasangan Ca2+/Ca (−2,84 V) dan Ba2+/Ba (−2,92 V), dan dekat dengan pasangan logam alkali tetangga.[9] Stronsium merupakan perantara antara kalsium dan barium dalam reaktivitasnya terhadap air, yang bereaksi pada kontak untuk menghasilkan stronsium hidroksida dan gas hidrogen. Logam stronsium terbakar di udara menghasilkan dan stronsium oksida serta stronsium nitrida, tetapi karena ia tidak bereaksi dengan nitrogen di bawah 380 °C, pada suhu kamar ia hanya membentuk oksida secara spontan.[7] Selain oksida SrO sederhana, peroksida SrO2 dapat dibuat dengan oksidasi langsung logam stronsium di bawah oksigen bertekanan tinggi, dan ada beberapa bukti untuk superoksida Sr(O2)2 kuning.[10] Stronsium hidroksida, Sr(OH)2, adalah basa kuat, meski tidak sekuat hidroksida barium atau logam alkali.[11] Keempat dihalida stronsium telah diketahui.[12]
Karena ukuran besar dari unsur blok-s yang berat, termasuk strontium, rentang bilangan koordinasi yang luas telah diketahui, mulai dari 2, 3, atau 4 hingga 22 atau 24 pada SrCd11 dan SrZn13. Ion Sr2+ cukup besar, sehingga bilangan koordinasi yang tinggi adalah aturannya.[13] Ukuran stronsium dan barium yang besar berperan penting dalam menstabilkan kompleks stronsium dengan ligan makrosiklik polidentat seperti eter mahkota: misalnya, walaupun 18-mahkota-6 membentuk kompleks yang relatif lemah dengan kalsium dan logam alkali, kompleks stronsium dan bariumnya jauh lebih kuat.[14]
Senyawa organostronsium mengandung satu atau lebih ikatan stronsium–karbon. Mereka telah dilaporkan sebagai perantara dalam reaksi jenis Barbier.[15][16][17] Meskipun stronsium berada dalam golongan yang sama dengan magnesium, dan senyawa organomagnesium sangat umum digunakan di seluruh kimia, senyawa organostronsium tidak tersebar luas karena lebih sulit dibuat dan lebih reaktif. Senyawa organostronsium cenderung lebih mirip dengan senyawa organoeuropium atau organosamarium karena kesamaan jari-jari ionik unsur-unsur tersebut (Sr2+ 118 pm; Eu2+ 117 pm; Sm2+ 122 pm). Sebagian besar senyawa ini hanya dapat dibuat pada suhu rendah; ligan besar cenderung mendukung stabilitas. Misalnya, stronsium disiklopentadienil, Sr(C5H5)2, harus dibuat dengan mereaksikan logam stronsium secara langsung dengan merkurosena atau siklopentadiena itu sendiri; menggantikan ligan C5H5 dengan ligan C5(CH3)5 yang lebih besar, di samping meningkatkan kelarutan, volatilitas, dan stabilitas kinetik senyawa tersebut.[18]
Karena reaktivitas ekstremnya dengan oksigen dan air, stronsium terjadi secara alami hanya dalam bentuk senyawa dengan unsur lain, seperti dalam mineral stronsianit dan selestin. Ia disimpan di bawah hidrokarbon cair seperti minyak mineral atau kerosin untuk mencegah oksidasi; logam stronsium baru yang terpapar akan dengan cepat berubah menjadi warna kekuningan dengan pembentukan oksida. Bubuk logam stronsium halus bersifat piroforik, artinya ia akan menyala secara spontan di udara pada suhu kamar. Garam stronsium yang volatil memberikan warna merah terang pada nyala api, dan garam ini digunakan dalam kembang api dan produksi suar.[7] Seperti kalsium dan barium, serta logam alkali dan lantanida divalen europium dan iterbium, logam stronsium akan langsung larut dalam amonia cair dan menghasilkan larutan elektron terlarut berwarna biru tua.[6]
Isotop
Stronsium alami adalah campuran dari empat isotop stabil: 84Sr, 86Sr, 87Sr, dan 88Sr.[7] Kelimpahan mereka meningkat seiring dengan meningkatnya nomor massa dan yang terberat, 88Sr, membentuk sekitar 82,6% dari semua stronsium alami, meskipun kelimpahannya bervariasi karena produksi 87Sr radiogenik sebagai turunan dari 87Rb yang meluruh melalui peluruhan beta dan berumur panjang.[19] Ini adalah dasar dari penanggalan rubidium–stronsium. Dari semua isotop stronsium yang tak stabil, mode peluruhan utama isotop yang lebih ringan dari 85Sr adalah penangkapan elektron atau emisi positron menjadi isotop rubidium, dan isotop yang lebih berat dari 88Sr adalah emisi elektron menjadi isotop itrium. Catatan khusus ditujukan kepada 89Sr dan 90Sr. Yang pertama memiliki waktu paruh 50,6 hari dan digunakan untuk mengobati kanker tulang karena kesamaan kimiawi stronsium dengan kalsium sehingga ia mampu menggantikannya.[20][21] Walaupun 90Sr (waktu paruh 28,90 tahun) telah digunakan dengan cara yang sama, ia juga merupakan isotop yang menjadi perhatian dalam luruhan dari senjata dan kecelakaan nuklir karena produksinya sebagai produk fisi. Kehadirannya di tulang dapat menyebabkan kanker tulang, kanker jaringan di sekitarnya, dan leukemia.[22] Kecelakaan nuklir Chernobyl tahun 1986 mengkontaminasi sekitar 30.000 km2 dengan lebih dari 10 kBq/m2 dengan 90Sr, yang menyumbang sekitar 5% dari 90Sr yang ada pada inti reaktor.[23]
Sejarah

Stronsium dinamai dari Strontian (Gaelik: Sròn an t-Sìthein), sebuah desa di Skotlandia, di mana ia ditemukan pada bijih dari tambang timbal.[24]
Pada tahun 1790, Adair Crawford, seorang dokter yang terlibat dalam persiapan barium, dan rekannya William Cruickshank, menyadari bahwa bijih dari Strontian menunjukkan sifat yang berbeda dari sumber "spar berat" lainnya.[25] Hal ini memungkinkan Crawford untuk menyimpulkan pada halaman 355 "... sangat mungkin, bahwa mineral skoc adalah spesies tanah baru yang sampai saat ini belum diteliti secara memadai." Dokter dan pengumpul mineral Friedrich Gabriel Sulzer bersama dengan Johann Friedrich Blumenbach menganalisis mineral dari Strontian dan menamainya stronsianit. Dia juga sampai pada kesimpulan bahwa mineral itu berbeda dari witerit dan mengandung tanah baru (neue Grunderde).[26] Pada tahun 1793 Thomas Charles Hope, seorang profesor kimia di Universitas Glasgow mempelajari mineral tersebut[27][28] dan mengusulkan nama strontites.[29][30][31] Dia mengonfirmasi karya Crawford sebelumnya dan menceritakan: "... Mengingat itu adalah tanah yang aneh, saya pikir perlu memberinya nama. Saya menyebutnya Strontites, dari tempat dimana ia ditemukan; menurut pendapat saya, sebuah mode turunan, sepenuhnya sesuai dengan kualitas apa pun yang mungkin dimilikinya, yang merupakan fesyen saat ini." Unsur ini akhirnya diisolasi oleh Sir Humphry Davy pada tahun 1808 melalui elektrolisis campuran yang mengandung stronsium klorida dan merkurat oksida, dan diumumkan olehnya dalam sebuah lektur di Royal Society pada tanggal 30 Juni 1808.[32] Sesuai dengan penamaan alkali tanah lainnya, dia mengubah nama unsur ini menjadi strontium.[33][34][35][36][37]
Aplikasi stronsium skala besar pertama adalah dalam produksi gula dari bit gula. Meskipun proses kristalisasi menggunakan stronsium hidroksida dipatenkan oleh Augustin-Pierre Dubrunfaut pada tahun 1849,[38] pengenalan skala besar datang dengan perbaikan proses pada awal tahun 1870-an. Industri gula Jerman menggunakan proses tersebut hingga abad ke-20. Sebelum Perang Dunia I, industri gula bit menggunakan 100.000 hingga 150.000 ton stronsium hidroksida untuk proses ini per tahun.[39] Stronsium hidroksida didaur ulang dalam prosesnya, tetapi permintaan untuk mengganti kerugian selama produksi cukup tinggi untuk menciptakan permintaan yang signifikan untuk memulai penambangan stronsianit di Münsterland. Penambangan stronsianit di Jerman berakhir ketika penambangan deposit selestin di Gloucestershire dimulai.[40] Tambang-tambang ini memasok sebagian besar pasokan stronsium dunia dari tahun 1884 hingga 1941. Meskipun endapan selestin di cekungan Granada telah dikenal selama beberapa waktu, penambangan skala besar tidak dimulai hingga tahun 1950-an.[41]
Selama pengujian senjata nuklir atmosfer, telah diamati bahwa stronsium-90 adalah salah satu produk fisi nuklir dengan hasil yang relatif tinggi. Kesamaan dengan kalsium dan kemungkinan bahwa stronsium-90 dapat diperkaya dalam tulang membuat penelitian tentang metabolisme stronsium menjadi topik penting.[42][43]
Keterjadian

Stronsium umumnya terdapat di alam, menjadi unsur paling melimpah ke-15 di Bumi (kongenernya yang lebih berat, barium, berada di urutan ke-14), diperkirakan jumlah rata-ratanya sekitar 360 bagian per juta di kerak Bumi[44] dan ditemukan terutama sebagai mineral sulfat selestin (SrSO4) dan karbonat stronsianit (SrCO3). Dari keduanya, selestin lebih sering terjadi pada endapan dengan ukuran yang cukup untuk ditambang. Karena stronsium paling sering digunakan dalam bentuk karbonat, stronsianit akan lebih bermanfaat dari dua mineral umum, tetapi hanya sedikit endapan yang ditemukan yang cocok untuk dikembangkan.[45] Karena caranya dalam bereaksi dengan udara dan air, stronsium hanya ada di alam bila dikombinasikan untuk membentuk mineral. Stronsium yang terjadi secara alami stabil, tetapi isotop sintetisnya, 90Sr, hanya dihasilkan oleh luruhan nuklir.
Dalam air tanah, stronsium berperilaku secara kimia seperti kalsium. Pada pH menengah hingga asam, Sr2+ merupakan spesies stronsium yang dominan. Dengan adanya ion kalsium, stronsium biasanya membentuk kopresipitat dengan mineral kalsium seperti kalsit dan anhidrit pada peningkatan pH. Pada pH menengah hingga asam, stronsium yay terlarut akan terikat pada partikel tanah melalui pertukaran kation.[46]
Kandungan rata-rata stronsium air laut adalah 8 mg/L.[47][48] Pada konsentrasi antara 82 dan 90 μmol/L stronsium, konsentrasinya jauh lebih rendah daripada konsentrasi kalsium, yang biasanya antara 9,6 dan 11,6 mmol/L.[49][50] Namun demikian, ia jauh lebih tinggi dari barium, dengan konsentrasi yang hanya sebesar 13 μg/L.[7]
Produksi
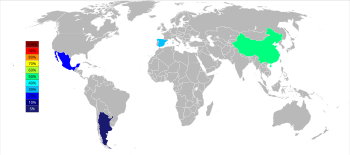
Tiga produsen utama stronsium sebagai selestin pada 2015 adalah Tiongkok (150.000 t), Spanyol (90.000 t), dan Meksiko (70.000 t); Argentina (10.000 t) dan Maroko (2.500 t) adalah produsen yang lebih kecil. Meskipun deposit stronsium terdapat secara luas di Amerika Serikat, mereka belum ditambang sejak tahun 1959.[51]
Sebagian besar selestin (SrSO4) yang ditambang diubah menjadi karbonat melalui dua proses, baik selestin langsung dicuci dengan larutan natrium karbonat ataupun selestin dipanggang dengan batu bara untuk membentuk sulfida. Tahap kedua menghasilkan bahan berwarna gelap yang sebagian besar mengandung stronsium sulfida. Yang disebut "abu hitam" ini dilarutkan dalam air dan disaring. Stronsium karbonat diendapkan dari larutan stronsium sulfida dengan memasukkan karbon dioksida.[52] Stronsium sulfat direduksi menjadi stronsium sulfida melalui reduksi karbotermik:
- SrSO4 + 2 C → SrS + 2 CO2
Sekitar 300.000 ton diproses dengan cara ini setiap tahunnya.[53]
Logam ini diproduksi secara komersial dengan mereduksi stronsium oksida dengan aluminium. Stronsium disuling dari campuran.[53] Logam stronsium juga dapat dibuat dalam skala kecil dengan elektrolisis larutan stronsium klorida dalam kalium klorida cair:[9]
- Sr2+ + 2 e− → Sr
- 2 Cl− → Cl2 + 2 e−
Aplikasi

Mengonsumsi 75% dari produksi, penggunaan utama stronsium adalah kaca untuk tabung sinar katoda televisi berwarna,[53] di mana ia mencegah emisi sinar-X.[54][55] Aplikasi untuk stronsium ini telah menurun karena CRT digantikan oleh metode tampilan lainnya. Penurunan ini memiliki pengaruh yang signifikan terhadap penambangan dan pemurnian stronsium.[45] Semua bagian CRT harus menyerap sinar-X. Di leher dan corong tabung, kaca timbal digunakan untuk tujuan ini, tetapi kaca jenis ini menunjukkan efek kecoklatan akibat interaksi sinar-X dengan kaca. Oleh karena itu, panel depan dibuat dari campuran kaca yang berbeda dengan stronsium dan barium untuk menyerap sinar-X. Nilai rata-rata campuran kaca yang ditentukan untuk studi daur ulang pada tahun 2005 adalah 8,5% stronsium oksida dan 10% barium oksida.[56]
Karena strontium sangat mirip dengan kalsium, ia akan tergabung dalam tulang. Keempat isotop stronsium yang stabil digabungkan, dalam proporsi yang kira-kira sama dengan yang ditemukan di alam. Namun, distribusi sebenarnya dari isotop tersebut cenderung sangat bervariasi dari satu lokasi geografis ke lokasi lainnya. Jadi, menganalisis tulang seseorang dapat membantu menentukan daerah asalnya.[57][58] Pendekatan ini membantu mengidentifikasi pola migrasi kuno dan asal-usul sisa-sisa manusia yang bercampur di situs pemakaman medan perang.[59]
Rasio 87Sr/86Sr umumnya digunakan untuk menentukan kemungkinan daerah asal sedimen dalam sistem alami, terutama pada lingkungan laut dan fluvial. Dasch (1969) menunjukkan bahwa sedimen permukaan Atlantik menampilkan rasio 87Sr/86Sr yang dapat dianggap sebagai rata-rata curah dari rasio 87Sr/86Sr medan geologis dari daratan yang berdekatan.[60] Sebuah contoh yang baik dari sistem fluvial-laut dimana studi sumber isotop Sr telah berhasil digunakan adalah sistem Sungai Nil-Mediterania.[61] Karena usia batuan yang berbeda yang merupakan mayoritas dari Nil Biru dan Putih, daerah tangkapan dari sumber perubahan sedimen mencapai Delta Sungai Nil dan Laut Mediterania Timur dapat dilihat melalui studi isotop strontium. Perubahan tersebut dikendalikan secara iklim pada Kuarter Akhir.[61]
Baru-baru ini, rasio 87Sr/86Sr juga telah digunakan untuk menentukan sumber bahan arkeologi kuno seperti kayu dan jagung di Chaco Canyon, New Mexico.[62][63] Rasio 87Sr/86Sr pada gigi juga dapat digunakan untuk melacak migrasi hewan.[64][65]
Stronsium aluminat sering digunakan dalam mainan yang dapat bersinar dalam kegelapan, karena bersifat lengai secara kimiawi dan biologis.[butuh rujukan]

Stronsium karbonat dan garam stronsium lainnya ditambahkan pada kembang api untuk memberikan warna merah tua.[66] Efek yang sama ini mengidentifikasi kation stronsium dalam uji nyala. Kembang api mengonsumsi sekitar 5% dari produksi dunia.[53] Stronsium karbonat digunakan dalam pembuatan magnet ferit keras.[67][68]
Stronsium klorida kadang-kadang digunakan dalam pasta gigi untuk gigi sensitif. Satu merek populer mencakup 10% total stronsium klorida heksahidrat dari beratnya.[69] Sejumlah kecil digunakan dalam pemurnian seng untuk menghilangkan sejumlah kecil pengotor timbal.[7] Logam stronsium itu sendiri memiliki penggunaan terbatas sebagai penangkap, untuk menghilangkan gas yang tak diinginkan dalam ruang hampa dengan mereaksikannya, meskipun barium juga dapat digunakan untuk tujuan ini.[9]
Transisi optik ultrasempit antara keadaan dasar elektronik [Kr]5s2 1S0 dan keadaan tereksitasi [Kr]5s5p 3P0 metastabil dari 87Sr adalah salah satu kandidat utama untuk definisi ulang detik di masa depan dalam hal transisi optik yang bertentangan dengan definisi saat ini yang berasal dari transisi gelombang mikro antara berbagai kondisi dasar hiperhalus dari 133Cs.[70] Jam atom optik saat ini yang beroperasi pada transisi ini telah melampaui presisi dan akurasi definisi detik saat ini.
Stronsium radioaktif
89Sr adalah bahan aktif dalam Metastron,[71] radiofarmasi yang digunakan untuk nyeri tulang akibat kanker tulang metastatis. Stronsium diproses seperti kalsium oleh tubuh, menggabungkannya ke dalam tulang di tempat peningkatan osteogenesis. Lokalisasi ini memfokuskan paparan radiasi pada lesi kanker.[21]

90Sr telah digunakan sebagai sumber daya untuk generator termoelektrik radioisotop (RTG). 90Sr menghasilkan sekitar 0,93 watt panas per gram (lebih rendah untuk bentuk 90Sr yang digunakan dalam RTG, yaitu stronsium fluorida).[72] Namun, 90Sr memiliki sepertiga masa pakai dan massa jenis lebih rendah dari 238Pu, bahan bakar RTG lainnya. Keuntungan utama dari 90Sr adalah ia lebih murah daripada 238Pu dan ditemukan dalam limbah nuklir. Uni Soviet mengerahkan hampir 1.000 RTG ini di pantai utaranya sebagai sumber listrik untuk mercusuar dan stasiun meteorologi.[73][74]
Peran biologis
| Bahaya | |
|---|---|
| Piktogram GHS |  
|
| Keterangan bahaya GHS | {{{value}}} |
| H261, H315 | |
| P223, P231+232, P370+378, P422[75] | |
Akantaria, kelompok protozoa radiolaria laut yang relatif besar, menghasilkan kerangka mineral rumit yang terdiri dari stronsium sulfat.[76] Dalam sistem biologis, sebagian kecil kalsium tersubstitusi oleh stronsium.[77] Dalam tubuh manusia, sebagian besar stronsium yang diserap akan disimpan di tulang. Rasio stronsium terhadap kalsium dalam tulang manusia adalah antara 1:1000 dan 1:2000, kira-kira dalam kisaran yang sama seperti dalam serum darah.[78]
Efek bagi tubuh manusia
Tubuh manusia menyerap stronsium seolah-olah ia adalah kongenernya yang lebih ringan, kalsium. Karena kedua unsur tersebut secara kimia sangat mirip, isotop stronsium yang stabil tidak menimbulkan ancaman kesehatan yang signifikan. Rata-rata manusia memiliki asupan sekitar dua miligram stronsium sehari.[79] Pada orang dewasa, stronsium yang dikonsumsi cenderung menempel hanya pada permukaan tulang, namun pada anak-anak, stronsium dapat menggantikan kalsium dalam mineral tulang yang sedang tumbuh sehingga menyebabkan masalah pertumbuhan tulang.[80]
Waktu paruh biologis stronsium pada manusia telah banyak dilaporkan mulai dari 14 hingga 600 hari,[81][82] 1.000 hari,[83] 18 tahun,[84] 30 tahun[85] dan, pada batas atas, 49 tahun.[86] Angka waktu paruh biologis yang dipublikasikan secara luas dijelaskan oleh metabolisme kompleks stronsium di dalam tubuh. Namun, dengan rata-rata semua jalur ekskresi, waktu paruh biologis secara keseluruhan diperkirakan sekitar 18 tahun.[87] Tingkat eliminasi stronsium sangat dipengaruhi oleh usia dan jenis kelamin, karena perbedaan metabolisme tulang.[88]
Obat stronsium ranelat dapat membantu pertumbuhan tulang, meningkatkan kepadatan tulang, dan mengurangi kejadian patah tulang belakang, perifer, dan pinggul.[89][90] Namun, stronsium ranelat juga meningkatkan risiko tromboemboli vena, emboli paru, dan gangguan kardiovaskular serius, termasuk infark miokard. Oleh karena itu, penggunaannya sekarang telah dibatasi.[91] Efek menguntungkannya juga dipertanyakan, karena peningkatan kepadatan tulang sebagian disebabkan oleh peningkatan kepadatan stronsium di atas kalsium yang digantikannya. Stronsium juga terbioakumulasi dalam tubuh.[92] Meskipun pembatasan stronsium ranelat, stronsium masih terkandung dalam beberapa suplemen.[93][94] Tidak banyak bukti ilmiah tentang risiko stronsium klorida saat diminum. Mereka yang memiliki riwayat gangguan pembekuan darah pribadi atau keluarga disarankan untuk menghindari stronsium.[93][94]
Stronsium telah terbukti menghambat iritasi sensorik saat dioleskan ke kulit.[95][96] Dioleskan secara topikal, stronsium telah terbukti mempercepat laju pemulihan penghalang permeabilitas epidermal (penghalang kulit).[97]
Limbah nuklir
Stronsium-90 adalah produk fisi radioaktif yang dihasilkan oleh reaktor nuklir yang digunakan dalam tenaga nuklir. Ia adalah komponen utama dari radioaktivitas tingkat tinggi dari limbah nuklir dan bahan bakar nuklir bekas. Waktu paruh 29 tahunnya cukup singkat sehingga panas peluruhannya telah digunakan untuk menyalakan mercusuar Arktik, tetapi cukup lama sehingga perlu waktu ratusan tahun untuk meluruh ke tingkat yang aman. Paparan dari air dan makanan yang terkontaminasi dapat meningkatkan risiko leukemia, kanker tulang,[98] dan hiperparatiroidisme primer.[99]
Remediasi
Alga telah menunjukkan selektivitas untuk stronsium dalam penelitian, di mana sebagian besar tanaman yang digunakan dalam bioremediasi belum menunjukkan selektivitas antara kalsium dan stronsium, seringkali menjadi jenuh dengan kalsium, yang jumlahnya lebih besar dan juga terdapat dalam limbah nuklir.[98]
Para peneliti telah melihat bioakumulasi stronsium oleh Scenedesmus spinosus (alga) dalam air limbah simulasi. Studi ini mengklaim kapasitas biosorpsi yang sangat selektif untuk stronsium dari S. spinosus, menunjukkan bahwa ia mungkin sesuai untuk penggunaan air limbah nuklir.[100]
Sebuah studi tentang ganggang tambak Closterium moniliferum menggunakan stronsium nonradioaktif menemukan bahwa memvariasikan rasio barium terhadap stronsium dalam air akan meningkatkan selektivitas stronsium.[98]
Lihat pula
Referensi
- ^ (Indonesia) "Strontium". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Greenwood and Earnshaw, hlm. 112
- ^ Colarusso, P.; Guo, B.; Zhang, K.-Q.; Bernath, P. F. (1996). "High-Resolution Infrared Emission Spectrum of Strontium Monofluoride" (PDF). J. Molecular Spectroscopy. 175 (1): 158. Bibcode:1996JMoSp.175..158C. doi:10.1006/jmsp.1996.0019.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ a b "Mineral Resource of the Month: Strontium". Survei Geologi A.S. 8 Desember 2014. Diakses tanggal 19 Maret 2023.
- ^ a b Greenwood dan Earnshaw, hlm. 112–13
- ^ a b c d e f C. R. Hammond The elements (hlm. 4–35) dalam Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Ropp, Richard C. (31 Desember 2012). Encyclopedia of the Alkaline Earth Compounds. hlm. 16. ISBN 978-0-444-59553-9.
- ^ a b c Greenwood dan Earnshaw, hlm. 111
- ^ Greenwood dan Earnshaw, hlm. 119
- ^ Greenwood dan Earnshaw, hlm. 121
- ^ Greenwood dan Earnshaw, hlm. 117
- ^ Greenwood dan Earnshaw, hlm. 115
- ^ Greenwood dan Earnshaw, hlm. 124
- ^ Miyoshi, N.; Kamiura, K.; Oka, H.; Kita, A.; Kuwata, R.; Ikehara, D.; Wada, M. (2004). "The Barbier-Type Alkylation of Aldehydes with Alkyl Halides in the Presence of Metallic Strontium". Bulletin of the Chemical Society of Japan. 77 (2): 341. doi:10.1246/bcsj.77.341.
- ^ Miyoshi, N.; Ikehara, D.; Kohno, T.; Matsui, A.; Wada, M. (2005). "The Chemistry of Alkylstrontium Halide Analogues: Barbier-type Alkylation of Imines with Alkyl Halides". Chemistry Letters. 34 (6): 760. doi:10.1246/cl.2005.760.
- ^ Miyoshi, N.; Matsuo, T.; Wada, M. (2005). "The Chemistry of Alkylstrontium Halide Analogues, Part 2: Barbier-Type Dialkylation of Esters with Alkyl Halides". European Journal of Organic Chemistry. 2005 (20): 4253. doi:10.1002/ejoc.200500484.
- ^ Greenwood dan Earnshaw, hlm. 136–37
- ^ Greenwood dan Earnshaw, hlm. 19
- ^ Halperin, Edward C.; Perez, Carlos A.; Brady, Luther W. (2008). Perez and Brady's principles and practice of radiation oncology. Lippincott Williams & Wilkins. hlm. 1997–. ISBN 978-0-7817-6369-1. Diakses tanggal 19 Maret 2023.
- ^ a b Bauman, Glenn; Charette, Manya; Reid, Robert; Sathya, Jinka (2005). "Radiopharmaceuticals for the palliation of painful bone metastases – a systematic review". Radiotherapy and Oncology. 75 (3): 258.E1–258.E13. doi:10.1016/j.radonc.2005.03.003. PMID 16299924.
- ^ "Strontium | Radiation Protection | US EPA". EPA. 24 April 2012. Diakses tanggal 19 Maret 2023.
- ^ "Chernobyl: Assessment of Radiological and Health Impact, 2002 update; Chapter I – The site and accident sequence" (PDF). OECD-NEA. 2002. Diakses tanggal 19 Maret 2023.
- ^ Murray, W. H. (1977). The Companion Guide to the West Highlands of Scotland
 . London: Collins. ISBN 978-0-00-211135-5.
. London: Collins. ISBN 978-0-00-211135-5.
- ^ Crawford, Adair (1790). "On the medicinal properties of the muriated barytes". Medical Communications. 2: 301–59.
- ^ Sulzer, Friedrich Gabriel; Blumenbach, Johann Friedrich (1791). "Über den Strontianit, ein Schottisches Foßil, das ebenfalls eine neue Grunderde zu enthalten scheint". Bergmännisches Journal: 433–36.
- ^ "Thomas Charles Hope, MD, FRSE, FRS (1766-1844) - School of Chemistry". www.chem.ed.ac.uk.
- ^ Doyle, W.P. "Thomas Charles Hope, MD, FRSE, FRS (1766–1844)". The University of Edinburgh. Diarsipkan dari versi asli tanggal 2 Juni 2013.
- ^ Meskipun Thomas C. Hope telah menyelidiki bijih stronsium sejak 1791, penelitiannya dipublikasikan dalam: Hope, Thomas Charles (1798). "Account of a mineral from Strontian and of a particular species of earth which it contains". Transactions of the Royal Society of Edinburgh. 4 (2): 3–39. doi:10.1017/S0080456800030726.
- ^ Murray, T. (1993). "Elementary Scots: The Discovery of Strontium". Scottish Medical Journal. 38 (6): 188–89. doi:10.1177/003693309303800611. PMID 8146640.
- ^ Hope, Thomas Charles (1794). "Account of a mineral from Strontian and of a particular species of earth which it contains". Transactions of the Royal Society of Edinburgh. 3 (2): 141–49. doi:10.1017/S0080456800020275.
- ^ Davy, H. (1808). "Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia". Philosophical Transactions of the Royal Society of London. 98: 333–70. Bibcode:1808RSPT...98..333D. doi:10.1098/rstl.1808.0023
 .
.
- ^ Taylor, Stuart (19 Juni 2008). "Strontian gets set for anniversary". Lochaber News. Diarsipkan dari versi asli tanggal 13 Januari 2009.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements: X. The alkaline earth metals and magnesium and cadmium". Journal of Chemical Education. 9 (6): 1046–57. Bibcode:1932JChEd...9.1046W. doi:10.1021/ed009p1046.
- ^ Partington, J. R. (1942). "The early history of strontium". Annals of Science. 5 (2): 157. doi:10.1080/00033794200201411.
- ^ Partington, J. R. (1951). "The early history of strontium. Part II". Annals of Science. 7: 95. doi:10.1080/00033795100202211.
- ^ Banyak penyelidik awal lainnya memeriksa bijih stronsium, di antaranya: (1) Martin Heinrich Klaproth, "Chemische Versuche über die Strontianerde" (Eksperimen kimia pada bijih stronsian), Crell's Annalen (September 1793) no. ii, hlm. 189–202 ; dan "Nachtrag zu den Versuchen über die Strontianerde" (Penambahan Eksperimen pada Bijih Stronsian), Crell's Annalen (Februari 1794) no. i, hlm. 99 ; juga (2) Kirwan, Richard (1794). "Experiments on a new earth found near Stronthian in Scotland". The Transactions of the Royal Irish Academy. 5: 243–56.
- ^ Fachgruppe Geschichte Der Chemie, Gesellschaft Deutscher Chemiker (2005). Metalle in der Elektrochemie. hlm. 158–62.
- ^ Heriot, T. H. P (2008). "strontium saccharate process". Manufacture of Sugar from the Cane and Beet. ISBN 978-1-4437-2504-0.
- ^ Börnchen, Martin. "Der Strontianitbergbau im Münsterland". Diarsipkan dari versi asli tanggal 11 Desember 2014. Diakses tanggal 19 Maret 2023.
- ^ Martin, Josèm; Ortega-Huertas, Miguel; Torres-Ruiz, Jose (1984). "Genesis and evolution of strontium deposits of the granada basin (Southeastern Spain): Evidence of diagenetic replacement of a stromatolite belt". Sedimentary Geology. 39 (3–4): 281. Bibcode:1984SedG...39..281M. doi:10.1016/0037-0738(84)90055-1.
- ^ "Chain Fission Yields". iaea.org.
- ^ Nordin, B. E. (1968). "Strontium Comes of Age". British Medical Journal. 1 (5591): 566. doi:10.1136/bmj.1.5591.566. PMC 1985251
 .
.
- ^ Turekian, K. K.; Wedepohl, K. H. (1961). "Distribution of the elements in some major units of the Earth's crust". Geological Society of America Bulletin. 72 (2): 175–92. Bibcode:1961GSAB...72..175T. doi:10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2
 .
.
- ^ a b Ober, Joyce A. "Mineral Commodity Summaries 2010: Strontium" (PDF). Survei Geologi A.S. Diakses tanggal 19 Maret 2023.
- ^ Heuel-Fabianek, B. (2014). "Partition Coefficients (Kd) for the Modelling of Transport Processes of Radionuclides in Groundwater" (PDF). Berichte des Forschungszentrums Jülich. 4375. ISSN 0944-2952.
- ^ Stringfield, V. T. (1966). "Strontium". Artesian water in Tertiary limestone in the southeastern States. Geological Survey Professional Paper. United States Government Printing Office. hlm. 138–39.
- ^ Angino, Ernest E.; Billings, Gale K.; Andersen, Neil (1966). "Observed variations in the strontium concentration of sea water". Chemical Geology. 1: 145. Bibcode:1966ChGeo...1..145A. doi:10.1016/0009-2541(66)90013-1.
- ^ Sun, Y.; Sun, M.; Lee, T.; Nie, B. (2005). "Influence of seawater Sr content on coral Sr/Ca and Sr thermometry". Coral Reefs. 24: 23. doi:10.1007/s00338-004-0467-x.
- ^ Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M. (5 March 2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses. ISBN 978-0-87335-233-8.
- ^ a b Ober, Joyce A. "Mineral Commodity Summaries 2015: Strontium" (PDF). Survei Geologi A.S. Diakses tanggal 19 Maret 2023.
- ^ Kemal, Mevlüt; Arslan, V.; Akar, A.; Canbazoglu, M. (1996). Production of SrCO3 by black ash process: Determination of reductive roasting parameters. hlm. 401. ISBN 978-90-5410-829-0.
- ^ a b c d MacMillan, J. Paul; Park, Jai Won; Gerstenberg, Rolf; Wagner, Heinz; Köhler, Karl dan Wallbrecht, Peter (2002) "Strontium and Strontium Compounds" dalam Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a25_321.
- ^ "Cathode Ray Tube Glass-To-Glass Recycling" (PDF). ICF Incorporated, USEP Agency. Diarsipkan dari versi asli (PDF) tanggal 19 Desember 2008. Diakses tanggal 19 Maret 2023.
- ^ Ober, Joyce A.; Polyak, Désirée E. "Mineral Yearbook 2007: Strontium" (PDF). Survei Geologi A.S. Diakses tanggal 19 Maret 2023.
- ^ Méar, F.; Yot, P.; Cambon, M.; Ribes, M. (2006). "The characterization of waste cathode-ray tube glass". Waste Management. 26 (12): 1468–76. doi:10.1016/j.wasman.2005.11.017. PMID 16427267.
- ^ Price, T. Douglas; Schoeninger, Margaret J.; Armelagos, George J. (1985). "Bone chemistry and past behavior: an overview". Journal of Human Evolution. 14 (5): 419–47. doi:10.1016/S0047-2484(85)80022-1.
- ^ Steadman, Luville T.; Brudevold, Finn; Smith, Frank A. (1958). "Distribution of strontium in teeth from different geographic areas". The Journal of the American Dental Association. 57 (3): 340–44. doi:10.14219/jada.archive.1958.0161. PMID 13575071.
- ^ Schweissing, Matthew Mike; Grupe, Gisela (2003). "Stable strontium isotopes in human teeth and bone: a key to migration events of the late Roman period in Bavaria". Journal of Archaeological Science. 30 (11): 1373–83. doi:10.1016/S0305-4403(03)00025-6.
- ^ Dasch, J. (1969). "Strontium isotopes in weathering profiles, deep-sea sediments, and sedimentary rocks". Geochimica et Cosmochimica Acta. 33 (12): 1521–52. Bibcode:1969GeCoA..33.1521D. doi:10.1016/0016-7037(69)90153-7.
- ^ a b Krom, M. D.; Cliff, R.; Eijsink, L. M.; Herut, B.; Chester, R. (1999). "The characterisation of Saharan dusts and Nile particulate matter in surface sediments from the Levantine basin using Sr isotopes". Marine Geology. 155 (3–4): 319–30. Bibcode:1999MGeol.155..319K. doi:10.1016/S0025-3227(98)00130-3.
- ^ Benson, L.; Cordell, L.; Vincent, K.; Taylor, H.; Stein, J.; Farmer, G.; Kiyoto, F. (2003). "Ancient maize from Chacoan great houses: where was it grown?". Proceedings of the National Academy of Sciences. 100 (22): 13111–15. Bibcode:2003PNAS..10013111B. doi:10.1073/pnas.2135068100
 . PMC 240753
. PMC 240753  . PMID 14563925.
. PMID 14563925.
- ^ English NB; Betancourt JL; Dean JS; Quade J. (October 2001). "Strontium isotopes reveal distant sources of architectural timber in Chaco Canyon, New Mexico". Proc Natl Acad Sci USA. 98 (21): 11891–96. Bibcode:2001PNAS...9811891E. doi:10.1073/pnas.211305498
 . PMC 59738
. PMC 59738  . PMID 11572943.
. PMID 11572943.
- ^ Barnett-Johnson, Rachel; Grimes, Churchill B.; Royer, Chantell F.; Donohoe, Christopher J. (2007). "Identifying the contribution of wild and hatchery Chinook salmon (Oncorhynchus tshawytscha) to the ocean fishery using otolith microstructure as natural tags". Canadian Journal of Fisheries and Aquatic Sciences. 64 (12): 1683–92. doi:10.1139/F07-129.
- ^ Porder, S.; Paytan, A.; E.A. Hadly (2003). "Mapping the origin of faunal assemblages using strontium isotopes". Paleobiology. 29 (2): 197–204. doi:10.1666/0094-8373(2003)029<0197:MTOOFA>2.0.CO;2.
- ^ "Chemistry of Firework Colors – How Fireworks Are Colored". Chemistry.about.com. 10 April 2012. Diarsipkan dari versi asli tanggal 2008-05-13. Diakses tanggal 19 Maret 2023.
- ^ "Ferrite Permanent Magnets". Arnold Magnetic Technologies. Diarsipkan dari versi asli tanggal 14 Mei 2012. Diakses tanggal 19 Maret 2023.
- ^ "Barium Carbonate". Chemical Products Corporation. Diarsipkan dari versi asli tanggal 6 Oktober 2014. Diakses tanggal 19 Maret 2023.
- ^ Ghom (1 Desember 2005). Textbook of Oral Medicine. hlm. 885. ISBN 978-81-8061-431-6.[pranala nonaktif permanen]
- ^ CartlidgeMar. 1, Edwin; 2018; Pm, 12:00 (28 Februari 2018). "With better atomic clocks, scientists prepare to redefine the second". Science | AAAS (dalam bahasa Inggris). Diakses tanggal 19 Maret 2023.
- ^ "FDA ANDA Generic Drug Approvals". BPOM A.S.
- ^ "What are the fuels for radioisotope thermoelectric generators?". qrg.northwestern.edu.
- ^ Doyle, James (30 Juni 2008). Nuclear safeguards, security and nonproliferation: achieving security with technology and policy. hlm. 459. ISBN 978-0-7506-8673-0.
- ^ O'Brien, R. C.; Ambrosi, R. M.; Bannister, N. P.; Howe, S. D.; Atkinson, H. V. (2008). "Safe radioisotope thermoelectric generators and heat sources for space applications". Journal of Nuclear Materials. 377 (3): 506–21. Bibcode:2008JNuM..377..506O. doi:10.1016/j.jnucmat.2008.04.009.
- ^ "Strontium 343730". Sigma-Aldrich.
- ^ De Deckker, Patrick (2004). "On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios". Hydrobiologia. 517 (1–3): 1. doi:10.1023/B:HYDR.0000027333.02017.50.
- ^ Pors Nielsen, S. (2004). "The biological role of strontium". Bone. 35 (3): 583–88. doi:10.1016/j.bone.2004.04.026. PMID 15336592.
- ^ Cabrera, Walter E.; Schrooten, Iris; De Broe, Marc E.; d'Haese, Patrick C. (1999). "Strontium and Bone". Journal of Bone and Mineral Research. 14 (5): 661–68. doi:10.1359/jbmr.1999.14.5.661
 . PMID 10320513.
. PMID 10320513.
- ^ Emsley, John (2011). Nature's building blocks: an A–Z guide to the elements. Oxford University Press. hlm. 507. ISBN 978-0-19-960563-7.
- ^ Agency for Toxic Substances and Disease Registry (21 Januari 2015). "ATSDR – Public Health Statement: Strontium". cdc.gov. Agency for Toxic Substances and Disease Registry. Diakses tanggal 19 Maret 2023.
- ^ Tiller, B. L. (2001), "4.5 Fish and Wildlife Surveillance" (PDF), Hanford Site 2001 Environmental Report, DOE, diarsipkan dari versi asli (PDF) tanggal 11 Mei 2013, diakses tanggal 19 Maret 2023
- ^ Driver, C. J. (1994), Ecotoxicity Literature Review of Selected Hanford Site Contaminants (PDF), DOE, doi:10.2172/10136486, OSTI 10136486, diakses tanggal 19 Maret 2023
- ^ "Freshwater Ecology and Human Influence". Area IV Envirothon. Diarsipkan dari versi asli tanggal 1 Januari 2014. Diakses tanggal 19 Maret 2023.
- ^ "Radioisotopes That May Impact Food Resources" (PDF). Epidemiology, Health and Social Services, State of Alaska. Diarsipkan dari versi asli (PDF) tanggal 21 Agustus 2014. Diakses tanggal 19 Maret 2023.
- ^ "Human Health Fact Sheet: Strontium" (PDF). Argonne National Laboratory. Oktober 2001. Diarsipkan dari versi asli (PDF) tanggal 24 Januari 2014. Diakses tanggal 19 Maret 2023.
- ^ "Biological Half-life". HyperPhysics. Diakses tanggal 14 Januari 2014.
- ^ Glasstone, Samuel; Dolan, Philip J. (1977). "XII: Biological Effects" (PDF). The effects of Nuclear Weapons. hlm. 605. Diakses tanggal 19 Maret 2023.
- ^ Shagina, N. B.; Bougrov, N. G.; Degteva, M. O.; Kozheurov, V. P.; Tolstykh, E. I. (2006). "An application of in vivo whole body counting technique for studying strontium metabolism and internal dose reconstruction for the Techa River population". Journal of Physics: Conference Series. 41 (1): 433–40. Bibcode:2006JPhCS..41..433S. doi:10.1088/1742-6596/41/1/048
 .
.
- ^ Meunier P. J.; Roux C.; Seeman E.; Ortolani, S.; Badurski, J. E.; Spector, T. D.; Cannata, J.; Balogh, A.; Lemmel, E. M.; Pors-Nielsen, S.; Rizzoli, R.; Genant, H. K.; Reginster, J. Y. (Januari 2004). "The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis" (PDF). New England Journal of Medicine. 350 (5): 459–68. doi:10.1056/NEJMoa022436. hdl:2268/7937. PMID 14749454.
- ^ Reginster JY; Seeman E; De Vernejoul MC; Adami, S.; Compston, J.; Phenekos, C.; Devogelaer, J. P.; Diaz Curiel, M.; Sawicki, A.; Goemaere, S.; Sorensen, O. H.; Felsenberg, D.; Meunier, P. J. (Mei 2005). "Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: treatment of peripheral osteoporosis (TROPOS) study" (PDF). The Journal of Clinical Endocrinology & Metabolism. 90 (5): 2816–22. doi:10.1210/jc.2004-1774
 . PMID 15728210.
. PMID 15728210.
- ^ "Strontium ranelate: cardiovascular risk – restricted indication and new monitoring requirements". Medicines and Healthcare products Regulatory Agency, UK. March 2014.
- ^ Price, Charles T.; Langford, Joshua R.; Liporace, Frank A. (5 April 2012). "Essential Nutrients for Bone Health and a Review of their Availability in the Average North American Diet". Open Orthop. J. 6: 143–49. doi:10.2174/1874325001206010143. PMC 3330619
 . PMID 22523525.
. PMID 22523525.
- ^ a b "Strontium". WebMD. Diakses tanggal 19 Maret 2023.
- ^ a b "Strontium for Osteoporosis". WebMD. Diakses tanggal 20 November 2017.
- ^ Hahn, G.S. (1999). "Strontium Is a Potent and Selective Inhibitor of Sensory Irritation" (PDF). Dermatologic Surgery. 25 (9): 689–94. doi:10.1046/j.1524-4725.1999.99099.x. PMID 10491058. Diarsipkan dari versi asli (PDF) tanggal 31 Mei 2016.
- ^ Hahn, G.S. (2001). Anti-irritants for Sensory Irritation. Handbook of Cosmetic Science and Technology. hlm. 285. ISBN 978-0-8247-0292-2.
- ^ Kim, Hyun Jeong; Kim, Min Jung; Jeong, Se Kyoo (2006). "The Effects of Strontium Ions on Epidermal Permeability Barrier". The Korean Dermatological Association, Korean Journal of Dermatology. 44 (11): 1309. Diarsipkan dari versi asli tanggal 2021-06-04. Diakses tanggal 2023-03-19.
- ^ a b c Potera, Carol (2011). "HAZARDOUS WASTE: Pond Algae Sequester Strontium-90". Environ Health Perspect. 119 (6): A244. doi:10.1289/ehp.119-a244
 . PMC 3114833
. PMC 3114833  . PMID 21628117.
. PMID 21628117.
- ^ Boehm, BO; Rosinger, S; Belyi, D; Dietrich, JW (18 Agustus 2011). "The parathyroid as a target for radiation damage". The New England Journal of Medicine. 365 (7): 676–8. doi:10.1056/NEJMc1104982. PMID 21848480.
- ^ Liu, Mingxue; Dong, Faqin; Kang, Wu; Sun, Shiyong; Wei, Hongfu; Zhang, Wei; Nie, Xiaoqin; Guo, Yuting; Huang, Ting; Liu, Yuanyuan (2014). "Biosorption of Strontium from Simulated Nuclear Wastewater by Scenedesmus spinosus under Culture Conditions: Adsorption and Bioaccumulation Processes and Models". Int J Environ Res Public Health. 11 (6): 6099–6118. doi:10.3390/ijerph110606099
 . PMC 4078568
. PMC 4078568  . PMID 24919131.
. PMID 24919131.
Bibliografi
- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
Pranala luar
- (Inggris) WebElements.com – Stronsium
- (Inggris) Strontium di The Periodic Table of Videos (Universitas Nottingham)
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||



















