Histopathology image classification: Highlighting the gap between manual analysis and AI automation
Contenidos


La precipitación es la creación de un sólido a partir de una solución. Cuando la reacción ocurre en una solución líquida, el sólido formado se llama 'precipitado'. La sustancia química que hace que se forme el sólido se llama 'precipitante'. Sin suficiente fuerza gravitatoria (sedimentación) para unir las partículas sólidas, el precipitado permanece en suspensión. Después de la sedimentación, especialmente cuando se usa una centrífugadora para presionarla en una masa compacta, el precipitado puede denominarse "gránulo". La precipitación se puede utilizar como medio. El líquido libre de precipitados que queda por encima del sólido se llama "sobrenadante". Los polvos derivados de la precipitación también se conocen históricamente como 'flores'. Cuando el sólido aparece en forma de fibras de celulosa que han sido sometidas a un procesamiento químico, el proceso a menudo se denomina regeneración.
A veces, la formación de un precipitado indica la aparición de una reacción química. Si la solución de nitrato de plata se vierte en una solución de cloruro de sodio, se produce una reacción química que forma un precipitado blanco de cloruro de plata. Cuando la solución de yoduro de potasio reacciona con la solución de nitrato de plomo (II), se forma un precipitado amarillo de yoduro de plomo (II).
La precipitación puede ocurrir si la concentración de un compuesto excede su solubilidad (como al mezclar solventes o cambiar su temperatura). La precipitación también puede ocurrir rápidamente de una solución sobresaturada.
En los sólidos, la precipitación ocurre si la concentración de un sólido está por encima del límite de solubilidad en el sólido huésped, debido a, p. enfriamiento rápido o implantación de iones, y la temperatura es lo suficientemente alta como para que la difusión pueda conducir a la segregación en precipitados. La precipitación en sólidos se usa habitualmente para sintetizar nanoclusters.[1]
Una etapa importante del proceso de precipitación es el inicio de la nucleación. La creación de una partícula sólida hipotética incluye la formación de una interfaz, que requiere algo de energía basada en la energía de superficie relativa del sólido y la solución. Si esta energía no está disponible y no hay disponible una superficie de nucleación adecuada, se produce sobresaturación.
Aplicaciones
Las reacciones de precipitación se pueden usar para hacer pigmentos, eliminar sales del agua en el tratamiento del agua y en el análisis inorgánico cualitativo clásico.
La precipitación también es útil para aislar los productos de una reacción durante el tratamiento. Idealmente, el producto de la reacción es insoluble en el disolvente de reacción. Por lo tanto, precipita a medida que se forma, preferiblemente formando cristales puros. Un ejemplo de esto sería la síntesis de porfirinas en ácido propiónico a reflujo. Al enfriar la mezcla de reacción a temperatura ambiente, precipitan los cristales de la porfirina y se recogen por filtración:[2]
La precipitación también puede ocurrir cuando se agrega un antidisolvente (un solvente en el cual el producto es insoluble), reduciendo drásticamente la solubilidad del producto deseado. Posteriormente, el precipitado se puede separar fácilmente por filtración, decantación o centrifugación. Un ejemplo sería la síntesis de cloruro de tetrafenilporfirina crómico: se agrega agua a la solución de reacción de DMF y el producto precipita.[3] La precipitación también es útil para purificar productos: el bmim-Cl crudo se recoge en acetonitrilo y se vierte en acetato de etilo, donde precipita.[4] Otra aplicación importante de un antidisolvente es la precipitación de ADN en etanol.
En la metalurgia, la precipitación de una solución sólida también es una forma útil de fortalecer las aleaciones; Este proceso se conoce como fortalecimiento de la solución sólida.
Precipitado antigénico
En inmunología, las reacciones de precipitación son las más simples de realizar y visualizar, al hacer reaccionar un antígeno soluble con un anticuerpo correspondiente.[5] Al antígeno en cuestión se le llama precipitógeno, es multivalente (posee varias copias del mismo determinante antigénico) y puede ser de naturaleza proteica, toxinas u otros productos de bacterias, hongos, virus, etc. Al anticuerpo se le llama precipitina y por lo general pertenece a las IgG. Estas reacciones son comunes en los laboratorios de diagnóstico, que usan medios líquidos o sólidos (agar) para realizar la prueba, útil, por ejemplo en el examen de VDRL para el diagnóstico de sífilis congénita, o en la inmunodifusión doble de Ouchterlony.[6]
Precipitación química
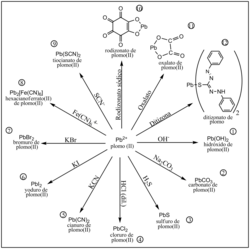
Mediante la adición de reactivos, los contaminantes solubles se transforman en formas insolubles o de una menor solubilidad. La eliminación de la disolución será tanto más completa (cuantitativa) cuanto más insoluble sea el compuesto formado. Por ejemplo, se pueden eliminar los bicarbonatos del agua mediante la adición de hidróxido de calcio, Ca(OH)2, el cual forma carbonato de calcio, CaCO3, compuesto poco soluble que sedimenta en forma de fino polvo.[7]
Es la tecnología de pretratamiento más común para la eliminación de contaminantes que se utiliza para reducir la concentración de metales en el agua residual a niveles que no causen preocupación. Es posible eliminar un metal pesado disuelto (como plomo, mercurio, cobre o cadmio, que esté como cloruro, nitrato o sulfato) adicionando hidróxido de sodio o de calcio, que produce la precipitación del correspondiente hidróxido de plomo, mercurio, cobre o cadmio. También se utiliza para eliminar la dureza del agua, técnica llamada ablandamiento.
Representación mediante ecuaciones químicas
Un ejemplo de reacción de precipitación: se agrega nitrato de plata acuoso (AgNO3) a una solución que contiene cloruro de potasio (KCl), se observa la precipitación de un sólido blanco, cloruro de plata (AgCl). (Zumdahl, 2005)
El cloruro de plata (AgCl) ha formado un sólido, que se observa como un precipitado.
Esta reacción se puede escribir enfatizando los iones disociados en una solución combinada. Esto se conoce como ecuación iónica.
Una forma final de representar una reacción de precipitado se conoce como ecuación iónica neta o reacción iónica neta.
Colores de precipitados

y Fe3+
Muchos compuestos que contienen iones metálicos producen precipitados con colores distintivos. Los siguientes son colores típicos para varios metales. Sin embargo, muchos de estos compuestos pueden producir colores muy diferentes a los enumerados.
| Oro | Negro |
| Cromo | Verde oscuro, verde turbio, naranja, violeta, amarillo, marrón |
| Cobalto | Rosado |
| Cobre | Azul |
| Hierro (II) | Verde |
| Hierro (III) | Marrón rojizo |
| Manganeso | Rosa pálido |
| Níquel | Verde |
| Plomo | Amarillo |
Otros compuestos generalmente forman precipitados blancos.
Análisis de aniones/cationes
La formación de precipitados es útil en la detección del tipo de catión en una sal. Para hacer esto, un base reacciona primero con la sal desconocida para producir un precipitado que es el hidróxido de la sal desconocida. Para identificar el catión se anota el color del precipitado y su solubilidad en exceso. A menudo se utilizan procesos similares en secuencia; por ejemplo, una solución de nitrato de bario reaccionará con iones de sulfato para formar un precipitado de sulfato de bario sólido, lo que indica que es probable que haya iones de sulfato presentes.
Digestión
La digestión, o envejecimiento del precipitado, ocurre cuando se deja un precipitado recién formado, generalmente a una temperatura más alta, en la solución de la que precipita. Da como resultado partículas más limpias y más grandes. El proceso físico-químico subyacente a la digestión se llama maduración de Ostwald.
Véase también
- Precipitación homogénea
- Equilibrio de solubilidad
- Transición de fase
- Ensayo químico
- Análisis clínicos
Referencias
- ↑ Dhara, S. (2007). «Formation, Dynamics, and Characterization of Nanostructures by Ion Beam Irradiation». Critical Reviews in Solid State and Materials Sciences 32 (1): 1-50. Bibcode:2007CRSSM..32....1D. doi:10.1080/10408430601187624.
- ↑ A. D. Adler; F. R. Longo; J. D. Finarelli; J. Goldmacher; J. Assour; L. Korsakoff (1967). «A simplified synthesis for meso-tetraphenylporphine». J. Org. Chem. 32 (2): 476-476. doi:10.1021/jo01288a053.
- ↑ Alan D. Adler; Frederick R. Longo; Frank Kampas; Jean Kim (1970). «On the preparation of metalloporphyrins». Journal of Inorganic and Nuclear Chemistry 32 (7): 2443. doi:10.1016/0022-1902(70)80535-8.
- ↑ Dupont, J., Consorti, C., Suarez, P., de Souza, R. (2004). "Preparation of 1-Butyl-3-methyl imidazolium-based Room Temperature Ionic Liquids". Org. Synth.; Coll. Vol. 10: 184.
- ↑ «Reacción antígeno-anticuerpo». Consultado el 20 de agosto de 2014.
- ↑ «Ensayos inmunológicos». Archivado desde el original el 24 de diciembre de 2014. Consultado el 20 de agosto de 2014.
- ↑ «Precipitación. Técnicas». Consultado el 20 de agosto de 2014.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre precipitado.
Wikcionario tiene definiciones y otra información sobre precipitado.




















