FAIR and interactive data graphics from a scientific knowledge graph
Indice
| Etano | |
|---|---|
 | |
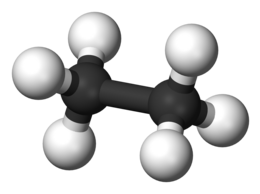 | |
| Nome IUPAC | |
| etano | |
| Nomi alternativi | |
| R-170 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C2H6 |
| Massa molecolare (u) | 30,07 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 200-814-8 |
| PubChem | 6324 |
| SMILES | CC |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 1,3562 |
| Temperatura di fusione | −182,7 °C (90,3 K) |
| ΔfusH0 (kJ·mol−1) | 0,583 |
| ΔfusS0 (J·K−1mol−1) | 6,46 |
| Temperatura di ebollizione | −88,6 °C (184,5 K) |
| ΔebH0 (kJ·mol−1) | 10 |
| Punto critico | 305,26 K (32,1 °C) 4,94 MPa (49,4 bar) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −84 |
| ΔfG0 (kJ·mol−1) | −32 |
| S0m(J·K−1mol−1) | 229,2 |
| C0p,m(J·K−1mol−1) | 52,5 |
| Indicazioni di sicurezza | |
| Punto di fiamma | −135 °C (138 K) |
| Limiti di esplosione | 3 - 12,5% vol. |
| Temperatura di autoignizione | 515 °C (788 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 220 - 280 |
| Consigli P | 210 - 377 - 381 - 403 [1] |
L'etano è l'unico alcano con due atomi di carbonio; è un idrocarburo alifatico, il secondo nella serie degli alcani, di formula molecolare C2H6, o anche (CH3)2. In esso il carbonio ha stato di ossidazione -3, a differenza che nel metano (-4). Può essere considerato il dimero del radicale metile (H3C•); il gruppo alchilico che da esso deriva è l'etile (C2H5–).
A temperatura e pressione ambiente è un gas[2] estremamente infiammabile, esplosivo in miscela con l'aria, incolore, inodore e atossico.
Presenza in natura

Produzione
Industrialmente si ottiene per distillazione frazionata del gas naturale, di cui è uno dei principali componenti, insieme al metano.
Nelle raffinerie di petrolio è presente nei gas incondensabili in testa alle colonne di distillazione.
Può essere ottenuto anche per riduzione dell'etino e dell'etene (idrogenazione catalitica con catalizzatore a base di Pd-C)
In laboratorio può essere ottenuto per elettrolisi (elettrolisi di Kolbe) dell'acido acetico:
Applicazioni
Nell'industria chimica, è la materia prima per la produzione dell'etene per cracking catalitico.
Struttura molecolare
Gli atomi di carbonio hanno solo quattro legami semplici e sono quindi ibridati sp3; ciascuno di essi ha attorno a sé l'altro carbonio e tre idrogeni in un ambiente tetraedrico. La struttura di equilibrio della molecola dell'etano in fase gassosa è stata studiata attraverso la spettroscopia rotazionale nella regione delle microonde e con la tecnica della diffrazione elettronica. Sono così state ricavate distanze ed angoli di legame con notevole precisione. Dalle microonde risulta:
r(C-C) = 152,8(3) pm; r(C-H) = 108,8(5) pm; ∠CCH = 111,6(5)°;
dalla diffrazione elettronica:
r(C-C) = 152,4(3) pm; r(C-H) = 108,9(5) pm; ∠CCH = 111,9(5)°;[3]
(in parentesi le incertezze sull'ultima cifra).
Conformazioni
La rotazione attorno ad un legame semplice è in genere possibile, anche se questo implica per la molecola superare una barriera energetica (tensione torsionale). Nell'etano a temperatura ambiente e anche molto minore la barriera per la rotazione dei metili attorno all'asse del legame C–C è relativamente piccola, circa 12 kJ/mol, il che permette alla molecola di etano di assumere tutte le conformazioni possibili tra due estreme in funzione dell'angolo di rotazione (angolo di torsione[4]). La conformazione detta eclissata, con l'angolo diedro HCCH di 0°, è la meno stabile ed ha simmetria D3h;[5] quella detta sfalsata, con l'angolo diedro HCCH di 60°, è la più stabile (è il minimo di energia potenziale) ed ha simmetria D3d.[5] L'instabilità della forma eclissata deriva principalmente dalla reciproca repulsione degli elettroni di legame (legami C-H) che in questa conformazione sono disposti reciprocamente a distanze minime e in parte dalle repulsioni dei nuclei degli atomi di idrogeno, che non hanno gusci sottostanti di elettroni.[6] Tuttavia, la situazione sembra essere più complessa[7] e nella stabilizzazione della forma sfalsata gioca un ruolo non proprio secondario l'iperconiugazione.[8][9] A temperatura ambiente la rotazione è praticamente libera e la forma sfalsata prevale sulla eclissata per il 99%.
 |
Animazione delle modificazioni conformazionali dell'etano |
Note
- ^ Scheda dell'etano sul sito dell'Organizzazione Internazionale del Lavoro (ILO)
- ^ Al di sotto di 32 °C è tecnicamente un vapore.
- ^ (EN) Marlin D. Harmony, The equilibrium carbon–carbon single‐bond length in ethane, in The Journal of Chemical Physics, vol. 93, n. 10, 15 novembre 1990, pp. 7522–7523, DOI:10.1063/1.459380. URL consultato il 30 giugno 2022.
- ^ (EN) Valerie Coulter, Advanced Organic Chemistry, 1ª ed., Global Media, 2009, p. 262, ISBN 978-93-80168-87-6.
- ^ a b CCCBDB list all species by point group, su cccbdb.nist.gov. URL consultato il 30 giugno 2022.
- ^ (EN) F. A. Carey e R. J. Sundberg, Advanced Organic Chemistry Part A: Structure and Mechanisms, Fifth Edition, Springer Science+Business Media, LLC, 2007, p. 78, ISBN 978-0-387-68346-1.
- ^ G. Ercolani, Determination of the Rotational Barrier in Ethane by Vibrational Spectroscopy and Statistical Thermodynamics, in J. Chem. Educ., vol. 82, n. 11, 2005, pp. 1703–1708, Bibcode:2005JChEd..82.1703E, DOI:10.1021/ed082p1703.
- ^ (EN) F. A. Carey e R. J. Sundberg, Advanced Organic Chemistry Part A: Structure and Mechanisms, Fifth Edition, Springer Science+Business Media, LLC, 2007, pp. 79-80, ISBN 978-0-387-68346-1.
- ^ Y. Mo, W. Wu, L. Song, M. Lin, Q. Zhang e J. Gao, The Magnitude of Hyperconjugation in Ethane: A Perspective from Ab Initio Valence Bond Theory, in Angew. Chem. Int. Ed., vol. 43, n. 15, 2004, pp. 1986–1990, DOI:10.1002/anie.200352931, PMID 15065281.
Altri progetti
 Wikizionario contiene il lemma di dizionario «etano»
Wikizionario contiene il lemma di dizionario «etano» Wikimedia Commons contiene immagini o altri file su etano
Wikimedia Commons contiene immagini o altri file su etano
Collegamenti esterni
- (EN) ethane, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 32920 · LCCN (EN) sh85045073 · GND (DE) 4140260-1 · BNF (FR) cb12377868x (data) · J9U (EN, HE) 987007555684405171 · NDL (EN, JA) 00575958 |
|---|






















