Effects of the storage conditions on the stability of natural and synthetic cannabis in biological matrices for forensic toxicology analysis: An update from the literature
| İzatin | |
|---|---|
 | |
 | |
| Ümumi | |
| Kimyəvi formulu | C₈H₅NO₂[1] |
| Molyar kütlə | 147.1308 g/mol q/mol |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 91-56-5 |
| PubChem | 7054 |
| RTECS | NL7873000 |
| ChEBI | 27539 |
| ChemSpider | 6787 |
İzatin -Tribulin kimi də tanınan izatin, C8H5NO2 kiimyəvi formullu indoldan əldə edilən üzvi birləşmədir. Bu birləşmə ilk dəfə 1840-cı ildə Otto Linné Erdman[1] və August Laurent[2] tərəfindən indiqo boyasının nitrat və xrom turşuları ilə oksidləşməsi nəticəsində əldə edilmişdir. İzatin, Couroupita guianensis[3][4] cinsindən İzatis cinsinin bitkilərində, həmçinin insanlarda adrenalinin metabolik törəməsi kimi tapılan təbii məhsuldur.[5] Qırmızı-narıncı toz kimi görünür və o, adətən antitumorallar,[6] virus əleyhinə,[7] anti-HİV[8] və vərəm əleyhinə maddələr daxil olmaqla, geniş çeşidli bioloji aktiv birləşmələrin sintezi üçün tikinti bloku kimi istifadə olunur.[ 9] İzatin nüvəsi həmçinin “Maya mavisi” və “Maya sarısı” boyalarına rəng vermək üçün istifadə olunur.[10] Mündəricat
Sintez
Sandmeyer metodologiyası
Sandmeyer metodologiyası izatinin sintezi üçün ən qədim və sadə üsuldur.[11] Metod, α-izonitrozoasetanilidinin sintezi üçün tətbiq olunur. Reaksiya natrium sulfatda hidroksilamin və xlorid turşusunun iştirakı ilə xloral hidrat və ilkin arilamin (məsələn, anilin) arasında qarşılıqlı təsirlə gedir. Güclü turşuların (məsələn, sulfat turşusu) təsir etdiyi bu reaksiya nəticəsində >75% çıxımla izatin sintez olunur.
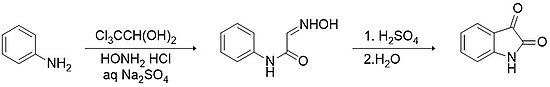
Stolle metodologiyası
Stolle proseduru həm əvəzlənmiş, həm də əvəz olunmamış izatinlərin sintezində Sandmeyer metodologiyasına ən yaxşı alternativ hesab olunur.[12] Bu halda birincili və ya ikincili arilaminlər oksalil xlorid ilə kondensasiyasından xlorooksalilanilid aralıq məhsulu əmələ gəlir, sonra Lyuis turşusunun (məsələn, alüminium trixlorid, titan tetraxlorid, bor trifluorid və s.) iştirakı ilə tsiklləşə bilər.
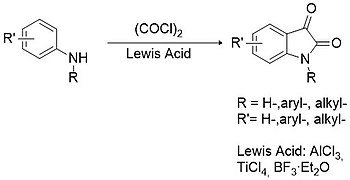
Digər prosedurlar
N-əvəz edilmiş izatinlərin sintezinə daha yeni yanaşmalar kommersiyada mövcud olan əvəz edilmiş indolların və ya oksiindolların müxtəlif oksidləşdirici maddələrlə birbaşa oksidləşməsini nəzərdə tutur.

Reaktivlik
Aromatik halqanın, keton və γ-laktam hissəsinin olması izatinə həm elektrofil, həm də nukleofil kimi istifadə olunması üçün nadir potensial verir. Həqiqətən də o, N-əvəzetmələri, elektrofilik reaksiyalar kimi çoxlu sayda reaksiyalara məruz qalır: fenil həlqəsinin C-5 və C-7 mövqelərində aromatik əvəzetmə, C-3 karbonil qrupuna nukleofil əlavə, oksidləşmə, üzüklərin genişlənməsi. Bu unikal reaktivliyə görə izatin üzvi sintezdə ən qiymətli tikinti bloklarından biri hesab olunur.
N-Əvəzetmə
İzatin nüvəsinin N-funksionallaşması prosesi amin hissənin deprotonasiyası, müvafiq natrium və ya kalium duzunun əmələ gəlməsi və sonradan elektrofilin (məsələn, alkil və ya asil halogenidləri) əlavə edilməsi ilə asanlıqla əldə edilə bilər.

Digər tərəfdən, N-arilasiya adətən mis palladium katalizatorlarından istifadə edilrək aril halogenidləri ilə çarpaz birləşmə reaksiyaları ilə əldə edilir.[16][17]

On the other hand, N-arylation is usually achieved by cross-coupling reactions with aryl halides using copper al palladium catalysts.[2][3]
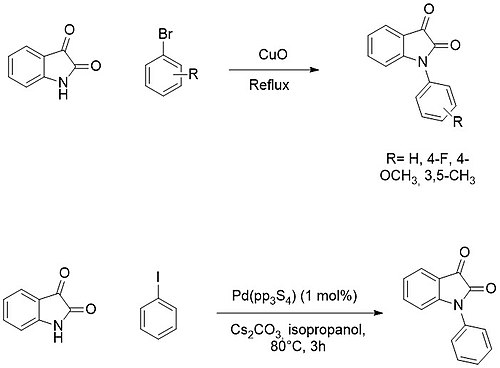
Həlqə genişlənməsi
Üzvi sintez sahəsində həlqənin genişlənməsi mühüm reaksiyalar hesab olunur, çünki onlar "klassik" üsullarla sintezi çətin olan orta ölçülü həlqənin (7-9 atom) alınmasına imkan verir.[18] Bu günə qədər izatin törəmələrinin həlqə genişlənməsi ilə bağlı yalnız bir neçə məqalə bildirilmişdir. Birincisi, dərman kimyasında mühüm skafoldlar olan izoksazokinolinləri əmələ gətirmək üçün izatinlər, aminourasillər və izoksazolonları əhatə edən turşu katalizatorlu çoxkomponentli reaksiyadır.[19]

Digər bir çoxkomponentli reaksiyada izatini inden-1,3-dion və N-əvəz edilmiş piridinium bromid ilə reaksiyaya daxil edərək dibenzo[b,d]azepin-6-onları sintez etməklə unikal iki karbonlu genişlənmə əldə edilmişdir.[20]

C-2/C-3 nukleofilik əlavə
İsatin C-2 və C-3 mövqelərində karbonillərə nukleofilik əlavə olunur. Prosesin vəziyyətə görə seçiciliyi həm substratdan (izatinin nüvəsindəki əvəzedicilərin, xüsusən də azot atomu ilə bağlı olanların xüsusiyyətləri) və reaksiya şəraitindən (həlledici, temperatur və s.) çox asılıdır. Bəzi hallarda nukleofil əlavədən sonra ikincili reaksiyalar (məsələn, siklləşmə, halqanın genişlənməsi, halqanın açılması və s.) baş verir.

İzatinə həlledicidən asılı nukleoflik əlavənin nümunəsi[21]
Oksidləşmə
Hidrogen peroksid və ya xrom anhidriddən istifadə edərək izatinin oksidləşməsi nəticəsində, həm herbisid məhsullarında, həm də dərman kimyasında geniş tətbiq olunan bir birləşmə olan izatoik anhidrid[22][23] sintez olunur.

Dimerləşmə
Metanolda KBH4 ilə izatinin dimerləşməsindən indirubin sintez olunur.[24] Bu, indiqo piqmentinin qırmızı komponentinin və yüksək effektiv sitotoksik birləşmənin əsas hissəni təşkil edir.

Reduksiya
Qeyri-amid karbonil qrupunun reduksiyası, müvafiq olaraq, oksindolun alınması üçün tətbiq olunur.
İstinadlar
- ^ Erdmann, Otto Linné (1840). "Untersuchungen über den Indigo". Journal für Praktische Chemie. 19 (1): 321–362. doi:10.1002/prac.18400190161.
- ^ Laurent, Auguste (1840). "Recherches sur l'indigo". Annales de Chimie et de Physique. 3 (3): 393–434.
- ^ Pinto, A. C. (2001). "The chemistry of isatins: a review from 1975 to 1999". J. Braz. Chem. Soc. 12 (3): 273. doi:10.1590/S0103-50532001000300002.
- ^ Bergman, J. (1988). "The structure and properties of some indolic constituents in Couroupita guianensis aubl". Tetrahedron. 41 (14): 2879. doi:10.1016/S0040-4020(01)96609-8.
- ^ Chiyanzu, I. (2003). "Synthesis and evaluation of isatins and thiosemicarbazone derivatives against cruzain, falcipain-2 and rhodesain". Bioorg. Med. Chem. Lett. 13 (20): 3527–30. doi:10.1016/S0960-894X(03)00756-X. PMID 14505663.
- ^ Mallamo, J.P. (2006). "Structure-guided identification of novel VEGFR-2 kinase inhibitors via solution phase parallel synthesis". Bioorg. Med. Chem. Lett. 16 (8): 2158–62. doi:10.1016/j.bmcl.2006.01.063. PMID 16460933.
- ^ He, Y. (2006). "Design, synthesis, and biological evaluations of novel oxindoles as HIV-1 non-nucleoside reverse transcriptase inhibitors". Bioorg. Med. Chem. Lett. 16 (8): 2109–12. doi:10.1016/j.bmcl.2006.01.066. PMID 16464578.
- ^ Sriram, D. (2005). "Synthesis and evaluation of anti-HIV activity of isatin beta-thiosemicarbazone derivatives". Bioorg. Med. Chem. Lett. 15 (20): 4451–5. doi:10.1016/j.bmcl.2005.07.046. PMID 16115762.
- ^ Bin-Jubair, F.A.S. (2010). "Anti-Tubercular activity of Isatin and Derivatives". Int. J. Res. Pharm. Sci. 1: 113.
- ^ Vuzquez de Agredos-Pascual, M.L. (2011). "From Maya Blue to "Maya Yellow": A Connection between Ancient Nanostructured Materials from the Voltammetry of Microparticles". Angew. Chem. Int. Ed. 50 (25): 5741–4. doi:10.1002/anie.201100921. PMID 21557419.
- ^ Sandmeyer, T. (1919). "Über Isonitrosoacetanilide und deren Kondensation zu Isatinen". Helv. Chim. Acta. 2: 234. doi:10.1002/hlca.19190020125.
- ^ Stollé, R. (1922). "Über N-substituierte Oxindole und Isatine". J. Prakt. Chem. (In German). 105 (1): 137–148. doi:10.1002/prac.19221050111.
- ^ Ji, S.J. (2014). "I2/TBHP-Catalyzed Chemoselective Amination of Indoles". Org. Lett. 16: 3094–3097.
- ^ Kirsch, S.F. (2015). "Synthesis of Isatins through Direct Oxidation of Indoles with IBX-SO3K/NaI". Synthesis. 47 (13): 1937–1943. doi:10.1055/s-0034-1380517.
- ^ Wei, W.T. (2018). "Synthesis of Indoline-2,3-diones by Radical Coupling of Indolin-2-ones with tert-Butyl Hydroperoxide". Synlett. 29 (2): 215–218. doi:10.1055/s-0036-1589106.
- ^ Coppola, Gary M. (September 1987). "Arylation of isatins. A direct route to -arylisatoic anhydrides". Journal of Heterocyclic Chemistry. 24 (5): 1249–1251. doi:10.1002/jhet.5570240503.
- ^ Majumder, Arpi; Gupta, Ragini; Mandal, Mrinmay; Babu, Madhu; Chakraborty, Debashis (April 2015). "Air-stable palladium(0) phosphine sulfide catalysts for Ullmann-type C–N and C–O coupling reactions". Journal of Organometallic Chemistry. 781: 23–34. doi:10.1016/j.jorganchem.2014.11.018.
- ^ Donald, James R.; Unsworth, William P. (3 July 2017). "Ring-Expansion Reactions in the Synthesis of Macrocycles and Medium-Sized Rings". Chemistry - A European Journal. 23 (37): 8780–8799. doi:10.1002/chem.201700467. PMID 28295709.
- ^ Poomathi, Nataraj; Mayakrishnan, Sivakalai; Muralidharan, Doraiswamy; Srinivasan, Rajagopal; Perumal, Paramasivan T. (2015). "Reaction of isatins with 6-amino uracils and isoxazoles: isatin ring-opening vs. annulations and regioselective synthesis of isoxazole fused quinoline scaffolds in water". Green Chemistry. 17 (6): 3362–3372. doi:10.1039/c5gc00006h.
- ^ Shi, Rong-Guo; Wang, Xiao-Hua; Liu, Ruzhang; Yan, Chao-Guo (2016). "Two-carbon ring expansion of isatin: a convenient construction of a dibenzo[b,d]azepinone scaffold". Chemical Communications. 52 (37): 6280–6283. doi:10.1039/c6cc00525j. PMID 27079548. S2CID 36547699.
- ^ Bergman, Jan; Stålhandske, Claes; Vallberg, Hans (1997). "Studies of the Reaction between Indole-2,3-diones (Isatins) and Secondary Aliphatic Amines" (PDF). Acta Chemica Scandinavica. 51: 753–759. doi:10.3891/acta.chem.scand.51-0753.
- ^ Yang, Shuangshuang; Li, Xishuai; Hu, Fangfang; Li, Yinlong; Yang, Yunyun; Yan, Junkai; Kuang, Chunxiang; Yang, Qing (25 October 2013). "Discovery of Tryptanthrin Derivatives as Potent Inhibitors of Indoleamine 2,3-Dioxygenase with Therapeutic Activity in Lewis Lung Cancer (LLC) Tumor-Bearing Mice". Journal of Medicinal Chemistry. 56 (21): 8321–8331. doi:10.1021/jm401195n. PMID 24099220.
- ^ Bao, Yajie; Yan, Yizhe; Xu, Kun; Su, Jihu; Zha, Zhenggen; Wang, Zhiyong (20 April 2015). "Copper-Catalyzed Radical Methylation/C–H Amination/Oxidation Cascade for the Synthesis of Quinazolinones". The Journal of Organic Chemistry. 80 (9): 4736–4742. doi:10.1021/acs.joc.5b00191. PMID 25849218.
- ^ Wang, Cuiling; Yan, Jiaxu; Du, Mo; Burlison, Joseph A.; Li, Chi; Sun, Yanni; Zhao, Danqing; Liu, Jianli (May 2017). "One step synthesis of indirubins by reductive coupling of isatins with KBH 4". Tetrahedron. 73 (19): 2780–2785. doi:10.1016/j.tet.2017.03.077.
- ↑ Isatin (ing.).
- ↑ Coppola, Gary M. "Arylation of isatins. A direct route to -arylisatoic anhydrides". Journal of Heterocyclic Chemistry. 24 (5). September 1987: 1249–1251. doi:10.1002/jhet.5570240503.
- ↑ Majumder, Arpi; Gupta, Ragini; Mandal, Mrinmay; Babu, Madhu; Chakraborty, Debashis. "Air-stable palladium(0) phosphine sulfide catalysts for Ullmann-type C–N and C–O coupling reactions". Journal of Organometallic Chemistry. 781. April 2015: 23–34. doi:10.1016/j.jorganchem.2014.11.018.
















