Design of generalized search interfaces for health informatics
| Trinitrotolueeni | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
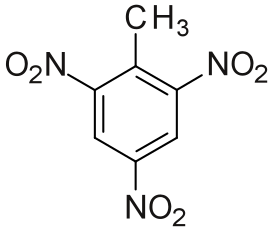
| IUPAC-nimi | 2-metyyli-1,3,5-trinitrobentseeni |
| CAS-numero | |
| PubChem CID | |
| SMILES | CC1=C(C=C(C=C1[N+](=O)[O-])[N+](=O)[O-])[N+](=O)[O-] |
| Ominaisuudet | |
| Molekyylikaava | C7H5N3O6 |
| Moolimassa | 227,131 g/mol |
| Sulamispiste | 80,35 °C |
| Kiehumispiste | 295 °C |
| Tiheys | 1,654 g/cm³ |
| Liukoisuus veteen | 130 mg/l (20 °C) |
TNT (trinitrotolueeni, trotyyli, 2,4,6-trinitrometyylibentseeni, rotuli, C7H5N3O6) on yleinen sekundaarisena räjähdysaineena käytetty kemiallinen yhdiste, jota syntetisoitiin ensimmäisen kerran vuonna 1863.[1] TNT:n tuttuuden vuoksi monien muiden räjähteiden ja aseiden tehoa mitataan TNT-kilogrammoissa. TNT:n räjähdysenergia on 4,184 MJ/kg. Hiroshimaan pudotetun atomipommin räjähdysvoima vastasi noin 13 kilotonnia (eli 13 miljoonaa kilogrammaa) TNT:tä.
TNT-molekyylissä on tolueeniin liittyneenä kolme nitroryhmää orto- ja para-asemiin.
TNT on melko myrkyllinen ja syöpää aiheuttava yhdiste, joka voi imeytyä ihon läpi aiheuttaen erilaisia oireita.[2]
Ominaisuudet ja käyttö

TNT ei ole erityisen suorituskykyinen räjähde.[1] Sen tiheys on 1,64 g/cm³ ja räjähdysnopeus 6 940 m/s.[1] Sen kemiallinen vakaus, kohtalainen iskun- ja kitkankestävyys ja valettavaksi riittävän alhainen sulamispiste (80,8 °C) tekevät siitä kuitenkin käyttötavoiltaan hyvin monipuolisen etenkin sotilaskäyttöön.[1] TNT:n happivajaus on –74 %, mistä johtuen sen käyttö yhdessä happipitoisemman ammoniumnitraatin kanssa amatoliksi kutsuttuna seoksena on ollut yleistä.[1] Nykyään "räjähtävältä voimaltaan" eli brisanssiltaan vaikuttavammat nitroamiinit, kuten HMX ja RDX, ovat kuitenkin pääosin korvanneet amatolit. TNT sopii edelleen perusräjähteeksi. Sitä käytetään myös sitovana räjähteenä useissa sekundaariräjähdeseoksissa kuten heksotoleissa (RDX ja TNT), Torpexissa (RDX, TNT ja Al) ja pentoliitissa (PETN ja TNT).[1]
TNT:n valmistamiseen vaadittavat raaka-aineet ovat halpoja ja helposti saatavilla olevia, joten TNT:tä voidaan edullisesti ja nopeasti tuottaa hyvin suuria määriä.[1]
Valmistus
Tolueenin nitraaminen on helppoa sen sisältämän metyyliryhmän vuoksi.[1] Kuitenkin nitroryhmien lukumäärän kasvaessa myös aromaattisen renkaan elektronivajaus kasvaa ja sen altistaminen elektrofiliselle hyökkäykselle vaikeutuu merkittävästi.[1] Tämän vuoksi tolueenin polynitraaminen happoseoksella suoraan TNT:ksi ei ole teollisesti järkevää, vaan se tehdään kahdessa tai kolmessa vaiheessa.[1]
Teollinen TNT:n valmistaminen saastuttaa ilmaa ja vesistöjä.[1] Polynitrauksen di- ja trinitrausvaiheissa käytetyt happoliuokset pyritään puhdistamaan typpihapolla ja käyttämään uudelleen mono- ja dinitrausvaiheissa.[1] Siitä huolimatta käytettyjen happoliuosten hävittäminen on merkittävä ongelma. TNT:n sulfiittikäsittelyyn liittyvästä pesemisestä syntyvä TNT:n epävakaita ja epäsymmetrisiä isomeerejä sisältävä "punainen vesi" muodostaa myös jäteongelman.[1]
Dinitrotolueenin nitraaminen TNT:ksi edellyttää oleumin eli savuavan rikkihapon käyttöä yhdessä happoseoksen kanssa vaihtelevassa lämpötilassa.[1] Tästä vaiheesta syntyy tetranitrometaanin ja typenoksidien kaltaisia epäpuhtauksia ja saasteita.[1]
Räjähdyksen kemia
Räjähtäessään TNT hajoaa seuraavasti:
- 2 C7H5N3O6 → 3 N2 + 5 H2O + 7 CO + 7 C
- 2 C7H5N3O6 → 3 N2 + 5 H2 + 12 CO + 2 C
Reaktio on eksoterminen, mutta sillä on korkea aktivointienergia. Koska reaktio vapauttaa hiiltä, räjähde nokeaa. Hiiltä voidaan käyttää räjähteen tehon kasvattamiseen, jos läsnä on happipitoista yhdistettä.
Trinitrotolueenin isomeerit
2,4,6-trinitrotolueenillä on seuraavat isomeerit.
- 2,3,4-trinitrotolueeni CAS-numero 602-29-9
- 2,4,5-trinitrotolueeni CAS-numero 610-25-3
- 3,4,5-trinitrotolueeni CAS-numero 603-15-6
- 2,3,5-trinitrotolueeni CAS-numero 609-74-5
- 2,3,6-trinitrotolueeni CAS-numero 18292-97-2
Lähteet
Aiheesta muualla
- TNTn kansainvälinen kemikaalikortti
- PubChem: 2,4,6-Trinitrotoluene (englanniksi)
- DrugBank: Trinitrotoluene (englanniksi)
- Toxin and Toxin Target Database (T3DB): 2,4,6-Trinitrotoluene (englanniksi)
- Kyoto Encyclopedia of Genes and Genomes (KEGG): 2,4,6-Trinitrotoluene (englanniksi)
















