Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Biologia celular |
|---|
| Célula animal |
|
Organelos da célula animal |
| Célula vegetal |
|
Organelos da célula vegetal 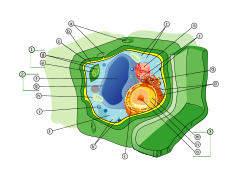
1. Cloroplasto
2. Vacúolo
3. Núcleo
|
|
Portal Biologia celular Portal Biologia |
Lisossomas (português europeu) Lisossomos (português brasileiro) são organelas celulares citoplasmáticos que possuem a capacidade de degradar partículas. A partir disso, elas desempenham uma importante função de reciclagem de componentes celulares envelhecidos, além de defesa contra agentes externos e participação no processo de autofagia. Os lisossomos estão ainda envolvidos em outros processos celulares, como reparo de membrana e secreção, por exemplo.
Seu objetivo primário é cumprido através da clivagem controlada de macromoléculas (como, por exemplo, proteínas, ácidos nucléicos, polissacarídeos, e lipídios), catalisada por cerca de 80[1] enzimas hidrolíticas, entre as quais se encontram proteases, nucleases, glicosidases, lipases, fosfolipases, fosfatases, e sulfatases. Todas essas enzimas são produzidas no retículo endoplasmático rugoso, transferidas para as bolsas do Complexo de Golgi e depois armazenadas nos endossomos tardios, de onde irão para lisossomos maduros (ou continuarão lá até o endossomo amadurecer em um lisossomo). Elas possuem atividade ótima em pH ácido (aproximadamente 5,0) o qual é mantido com eficiência no interior do lisossomo. Em função disto, o conteúdo do citosol é duplamente protegido contra ataques do conteúdo lisossomal, uma vez que a membrana do lisossomo mantém as enzimas de degradação isoladas do citosol (essa função é exercida, aparentemente, pelos carboidratos que ficam associados à face interna da membrana), mas mesmo em caso de vazamento, essas enzimas terão sua ação inibida pelo pH citoplasmático (aproximadamente 7,2) causando dano reduzido à célula.
Os lisossomos também possuem uma membrana envoltória característica: proteínas transportadoras contidas nessa membrana, permitem que os produtos finais da digestão de macromoléculas (tais como aminoácidos, açúcares, nucleotídeos e até mesmo pequenos peptídeos) transitem para o citosol onde serão excretados ou reutilizados pela célula.[2] A membrana do lisossomo possui também bombas de H+, que, através da hidrólise de ATP, bombeiam íons H+ para o lúmen (como uma ATPase invertida), mantendo assim o pH ácido, ideal para a ação enzimática. A maioria das membranas lisossomais é altamente glicosilada, de modo que lhe é conferida proteção das enzimas contidas no lúmen.
É importante notar, por fim, que a digestão feita pelos lisossomos em células animais não tem a mesma função da digestão em um organismo pluricelular em si mesmo. Em metazoários em geral, os nutrientes chegam nas células já apropriados para a entrada no metabolismo e, portanto, não precisam de um análogo ao estômago ou duodeno intracelular. Assim, o papel do lisossomo não é alimentar a célula, embora isso possa ser feito em certa medida na autofagia. Existem 4 vias principais para a entrega de compostos a serem degradados para o lisossomo: endocitose, macropinocitose - que é um tipo de endocitose -, autofagia e fagocitose.
Christian de Duve, o então presidente do laboratório de Química Fisiológica na Universidade Católica de Lovaina, na Bélgica, estudava os mecanismos de ação da insulina em células hepáticas. Em 1949, ele e sua equipe estudaram a enzima glicose 6-fosfatase. Eles já suspeitavam que a enzima desempenhasse um papel fundamental na regulação de açúcar no sangue. Visando isolar a enzima, utilizaram o método de fracionamento celular, que utiliza a centrifugação na separação dos conteúdos de uma célula, preservando a função de cada componente.
A detecção da atividade enzimática após o fracionamento foi bem-sucedida. Esse foi um evento crucial na inesperada descoberta dos lisossomos. Usando uma enzima padrão ácido fosfatase, eles determinaram que a atividade era apenas 10% do valor esperado. Um dia, foi medida novamente a atividade enzimática das frações segmentadas que haviam sido refrigeradas durante cinco dias. Surpreendentemente, a atividade enzimática daquela primeira amostra havia-se normalizado. Eles obtiveram o mesmo resultado, a cada vez que repetiram o procedimento e chegaram à conclusão de que alguma barreira membranosa estava limitando o acesso da enzima ao seu substrato. Descreveram essa barreira como uma "bolsa envolta por uma membrana contendo fosfatase ácida."[3]
A enzima provinha de uma fração com resíduos membranosos, e tornou-se claro que se tratava de organelas. Em 1955, De Duve as chamou de "lisossomos", refletindo suas propriedades digestivas.[4] No mesmo ano, Alex B. Novikoff, da Universidade de Vermont, visitou o laboratório de Duve e obteve com sucesso as primeiras imagens de microscópio eletrônico da nova organela. Usando o microscópio óptico, microscópio eletrônico e um método de coloração de fosfatases ácidas, Duve e Novikoff confirmaram a localização das enzimas hidrolíticas dos lisossomos.[5][6] Graças à sua descoberta, De Duve ganhou o prêmio Nobel de Medicina de 1974.
Originalmente, De Duve havia chamado as organelas de "bolsas suicidas" da célula, pelo seu hipotetizado papel na apoptose.[7] Porém, tem sido demonstrado que participam pouco no processo de morte celular.[8]
Tudo dentro de uma célula tende a ser altamente organizado e isso não seria muito diferente com o reconhecimento do que deve ou não ser direcionado às organelas. Assim, antes de ser levado ao lisossomo para ser reciclada ou para lá exercer sua função, uma proteína, organela ou partícula externa precisa antes ser devidamente endereçada. Esse endereçamento se dá em três vias para a degradação e uma para a entrega de moléculas próprias do lisossomo. A primeira são as vesículas conhecidas como endossomos tardios, formada por material que veio do meio extracelular (através de endocitose) e enzimas próprias de lisossomos. Essas vesículas entregam seu conteúdo pela fusão com lisossomos (formando os endolisossomos). Ou, ainda, pode ocorrer o amadurecimento de um endossomo tardio para formar um lisossomo novo. A segunda rota é dada a partir da autofagia e se consagra pela fusão de um autofagossomo ao lisossomo. Já a terceira rota leva corpos fagocitados para a degradação a partir da fusão do fagossomo ao lisossomo. Nessas três vias há o reconhecimento constituiçãodas membranas das vesículas. E, por fim, cerca de 80% das proteínas[9] que deverão compor o lisossomo são entregues pelo reconhecimento de manose 6-fostato previamente ligada a elas (mas algumas proteínas vão por vias independentes, como as que envolvem LIMP2 e sortilina[10]).
A manose 6-fosfato é adicionada à proteína na região cis do aparato de golgi, após ser reconhecida pela configuração dos aminoácidos de uma região da proteína. Assim, mediada pelo catalisador N-acetilglicosamina-1-fosfato transferase, o oligossacarídeo ligado ao N da cadeia lateral da asparigina recebe uma manose 6-fosfato. Após isso, na região trans do Complexo de Golgi, dois receptores independentes reconhecem a manose 6-fosfato e se ligam à proteína marcada, sob pH 6,5 a 6,7. Osreceptores, então, (se ligam a adaptinas, que convocarão clatrinas) promovem a formação de vesículas que levarão a hidrolase para endossomos tardios.[11] No endossomo tardio, o ph 6 causa a dissociação da proteína com o receptor de manose 6-fosfato, permitindo que a hidrolase comece a exercer sua função. Enfim, o endossomo tardio pode entregar a proteína ao se fundir a um lisossomo ou pode ele mesmo amadurecer a um lisossomo.
No processo de endocitose, as vesículas que brotaram da membrana plasmática, contendo proteínas receptoras e seus ligantes, perdem seu revestimento e se fundem com endossomos iniciais, que se localizam próximo à membrana celular. A partir desses endossomos iniciais, as proteínas podem seguir diferentes vias dentro da célula: reciclagem, transcitose e degradação.[12]
No processo de reciclagem, proteínas receptoras retornam ao seu domínio original na membrana plasmática, por meio de vesículas de transporte que brotam do endossomo inicial. As proteínas receptoras podem ser transportadas a um domínio diferente do seu original na membrana plasmática, no processo de transcitose. E, por fim, as proteínas podem permanecer no endossomo inicial e seguir a via de degradação.[12]
Os endossomos iniciais, por sua vez, migram em direção ao interior celular pelos microtúbulos e durante esse percurso, brotam dele muitas vesículas de transporte, enquanto também se fundem a ele diversas vesículas provenientes da membrana plasmática e também do Complexo de Golgi. Por esse motivo, os endossomos passam a ser chamados de corpos multivesiculares, e esses corpos continuam seu percurso até passarem a se fundir entre si para formar um endossomo tardio, ou se fundir com endossomos tardios preexistentes.[12]
Os endossomos tardios já possuem hidrolases lisossomais, e ao se fundirem a endossomos preexistentes, formam endolisossomos, que por sua vez, fundem-se uns aos outros. Dessa forma, endossomos tardios e endolisossomos são estruturas idênticas, variando apenas no estado de maturação no ciclo da digestão celular.[12] Assim como os próprios lisossomos e os endolisossomos, que não possuem distinção real entre si, apenas pelos diferentes estágios no ciclo,[2] já que todos eles são compartimentos com meio ácido (pH baixo) e que possuem enzimas hidrolíticas para degradação de moléculas na digestão celular.
Os endolisossomos, quando completam a degradação de seus conteúdos pelas hidrolases, amadurecem em lisossomos, de forma que também desaparecem, na digestão no endolisossomo, as vesículas intraluminais.[2]
Ainda pode haver associação de lisossomos primários, aqueles que contêm apenas enzimas hidrolíticas, e não possuem material para degradação em seu interior, com endossomos tardios, formando lisossomos secundários. Endossomos terciários são aqueles que contêm apenas resíduos não digeridos no processo de digestão celular.[13]
Endossomos terciários podem, então, liberar seu conteúdo no meio extracelular, pelo processo de clasmocitose, ou então, em alguns tipos de células como as do tecido muscular e nervoso, pode ser armazenado no citoplasma. O acúmulo desses endossomos terciários, chamados grânulos de lipofuscina, é um dos fatores de envelhecimento da célula.[13]
A endocitose é um meio pelo qual a célula capta componentes solúveis do meio externo e os direciona para o interior da superfície celular, processo comumente chamado de pinocitose. A membrana plasmática, na presença ou não de revestimento proteico para auxiliar o processo - como vesículas revestidas por clatrina - , sofre uma invaginação e, com isso, circunda o material solubilizado. Dessa forma, formam-se fossas na membrana plasmática, que se destacam internamente, formando as vesículas endocíticas.[2]
Além disso, algumas células especializadas são capazes de realizar uma variante desse processo, denominado fagocitose.[2]
Por meio do processo de endocitose e de sua associação com os lisossomos, a célula consegue captar e realizar a hidrólise de macromoléculas solúveis e, por conseguinte, utilizar seus monômeros para promover o desenvolvimento celular. Além disso, como os receptores da membrana plasmática, além de outras proteínas transmembrânicas, são englobados juntamente ao material, esse processo permite que a célula retire esses elementos da membrana e os recicle. Assim, a composição da membrana plasmática pode ser ajustada, a fim de se adequar às necessidades momentâneas da célula, que são reflexo de mudanças nas condições extracelulares.[2]
Ademais, também é fundamental para o processamento do colesterol, que se encontra no meio extracelular associado a uma lipoproteína, LDL; formando o composto lipoproteico colesterol-LDL, que entra na célula por endocitose. As hidrolases ácidas do lisossomo permitem a separação do colesterol da LDL, permitindo que esse seja utilizado nos processos celulares.[14]
A Pinocitose ocorre quando há predominância de liquido na substancia a ser transportada ao interior da célula e é subdividida em micropinocitose e macropinocitose. No primeiro caso, serve à interiorização de pequenas porções de substancias do meio extracelular. Já a macropinocitose captura grandes porções.[2]
Lisossomos fazem parte de inúmeras vias de tráfego intracelular que convergem. A macropinocitose é ativada em resposta a receptores da superfície celular que são ativadas por diferentes cargas, e ela é especializada na captura de fluidos não específicos, membranas e partículas ligadas à membrana plasmática. A macropinocitose é um mecanismo de endocitose independente de clatrina e pode ser ativado na maioria dos tipos celulares. Esse mecanismo é induzido com fatores de crescimento, fragmentos celulares resultantes de apoptose e alguns vírus. Esses fatores resultam na ativação de complexos sinalizadores dessa via que, por sua vez, culminam em mudança conformacional dos filamentos de actina no meio intracelular e a formação de protusões na superfície celular. Quando essas estruturas colapsam novamente para a célula, grandes vesículas endocíticas e repletas de fluidos são formadas, chamadas de macropinossomos. Essas vesículas são integrantes de uma via de degradação: elas irão ser acidificadas e, posteriormente, fundidas com endossomos tardios ou endolisossomos, sem que se recicle seu conteúdo de volta para a membrana plasmática.[2][15]
Muitos vírus que não conseguem adentrar nas células por meio de vesículas ligadas a clatrina entram nas células por micropinocitose. Uma vez dentro do endossomo que teve origem nesse processo, ocorre a fusão do envelope viral com a membrana do endossomo, processo que é mediado por glicoproteínas virais e é de grande semelhança com o mecanismo de fusão de membranas mediado por proteínas SNARE durante o tráfego de vesículas normal.[2][15]
Os produtos da digestão no lisossomo podem: 1) Ser transferidos para o citoplasma e aproveitados em vias de biossíntese, caso sejam unidades básicas de moléculas do organismo 2) Ficar acumulados nas células (pigmentos de envelhecimento) 3) Ser eliminados por exocitose (ou clasmocitose), no caso dos produtos não digeridos. Assim, o lisossomo não é necessariamente o último destino de substâncias nas vias de transporte celular.[2]
Melanócitos da pele, por exemplo, produzem e armazenam pigmentos em seus lisossomos. Esses melanossomos liberam seus pigmentos no meio extracelular por meio do processo de exocitose, o qual é, posteriormente, englobado por queratinócitos, o que causa a pigmentação normal da pele.[16] Em determinadas disfunções genéticas que prejudicam ou bloqueiam esse processo de exocitose, causando um quadro de albinismo.[17]
Já foram observadas no sangue, vesículas circulando, ou exossomos, que podem estar relacionadas com o transporte de componentes entre as células. Alguns exossomos podem derivar de processos diferentes do brotamento de vesículas na membrana plasmática, sendo, contudo, processos equivalentes ao descrito.[2][15]
A fagocitose é uma importante variação do processo de endocitose usado para várias funções e realizado por células especializadas em tal função. Ela é um tipo de transporte ativo mediado por vesículas no qual ocorre a formação de um fagossomo que pode receber componentes enzimáticos vindos do retículo endoplasmático. Através dela se dá a nutrição de organismos unicelulares, como por exemplo protozoários predadores, e ocorre ainda em favor da defesa de seres pluricelulares, nos humanos por meio dos neutrófilos, macrófagos - fagocitam o equivalente a 25% do seu próprio volume a cada hora e remove 3% da sua própria membrana a cada minuto -[18] e as formas modificadas dos neutrófilos em tecidos específicos - osteoclastos no tecido ósseo,micróglias no tecido nervoso e monócitos no sangue - fazem a fagocitose buscando capturar ‘’restos’’ celulares fruto do mecanismo de apoptose,[19] ou então defender o organismo contra parasitas invasores. Portanto, a fagocitose só ocorre para partículas sólidas e com uma dimensão relativamente avantajada (vesículas com diâmetro maior que 250 nm),[18] diferentemente da pinocitose que ocorre para a ingestão de macromoléculas solúveis.[2]

Esse processo é mediado por receptores de membrana que se ligam a proteínas, glicoproteínas ou carboidratos constituintes da membrana de outra célula, bactéria ou vírus. As células fagocitárias reconhecem imunoglobulinas presentes na superfície membranosa do corpo estranho, os receptores da célula se ligam a tais moléculas informacionais e, a partir daí, ocorre a projeção de filamentos de actina que fazem a protrusão da plasmalema formando pseudópodes que culminam por englobar o patógeno.[19] Alguns patógenos possuem por mecanismo de sobrevivência fruto da seleção natural a capacidade de secretar toxinas que rompem o fagossomo, burlando assim o sistema de defesa de uma célula eucariota. A fagocitose também pode remover dos vasos sanguíneos agregados lipídicos, corroborando, dessa forma, no combate à aterosclerose.[18]
As etapas da fagocitose são: 1) Adesão: anticorpos marcam a partícula invasora para fagocitose, a adesão ativa receptores que desencadeiam a montagem da actina 2) Englobamento: montagem de trama de actina impulsiona a formação de pseudópodos. 3) Fusão com vesículas contendo enzimas. 4) Degradação: formação de um lisossomo contendo diversas enzimas hidrolíticas que agem sobre vários substratos específicos, degradando-os.[2][18]
Uma das vias mais importantes de degradação por meio de lisossomos para a célula é a da autofagia. Ela permite uma intervenção celular para dois contextos potencialmente danosos: falta de alimento e a presença de organelas ou outras estruturas defeituosas.[2] É um processo altamente regulado, dependente de fatores inibitórios ou excitatórios como hormônios, fatores de crescimento ou mesmo jejum. Aliás, a intervenção para esse último contexto, discutivelmente a que foi evolutivamente selecionada primeiro,[20] pode ser considerada uma autofagia não seletiva, porque quaisquer estruturas presentes no citosol poderão ser degradadas para repor as concentrações celulares de metabólitos. Já a autofagia seletiva refere-se especificamente ao empacotamento de organelas como mitocôndrias, retículo endoplasmático e ribossomos[2] defeituosos, seguido pela reciclagem do material. A autofagia específica de mitocôndrias se chama de mitofagia.
A autofagia, em um pouco de maior detalhe, consiste no seguinte: o alvo do citoplasma vai ser envolto por vesículas, de origem ainda não conhecida,[2] que se fundem para formar um autofagossomo. O autofagossomo se fundirá ainda com um lisossomo para formar um autofagolisossomo para que ocorra a degradação. O processo é altamente regulado,[21] com a cinase mTOR1, associada a sensores de nutrientes, fosforilando e inibindo a atividade de ULK1, cinase chave que uma vez ativada mediante a desativação de mTOR mediada pela falta de nutrientes, por exemplo, dará início ao processo de autofagia.[22] Após essa sinalização que permite a ativação de ULK1, um dos passos da autofagia é a delimitação do autofagossomo por vesículas de membranas, mediadas pela proteína ATG9.[2] Eventualmente, conforme já citado, esse autofagossomo se fundirá com um lisossomo de forma a finalmente permitir a degradação e consequente reciclagem do material capturado.
De forma simplificada poderia se dizer que vacúolos são os lisossomos em plantas, fungos e algas. Essas organelas, no entanto, acabaram assumindo uma alta versatilidade, de forma que uma definição restrita de lisossomos se torna insuficiente. Os vacúolos ocupam, geralmente, mais de 30% do volume celular (podendo chegar a 90% em algumas células especializadas) e são tão importantes que a sua presença é um checkpoint no processo de divisão celular.[23] De fato, além de degradação molecular, os vacúolos são essenciais para o armazenamento, controle do tamanho celular, pH citosólico e pressão de turgescência. Eles são úteis até para a coloração de pétalas e estocagem de proteínas em sementes.[2]
É útil observar, porém, que, apesar de gigantes, os vacúolos não ocupam todo o volume e funções citadas como um único compartimento. Assim, é comum haver vacúolos de tamanhos e funções diferentes na mesma célula.[24] Mas de qualquer forma eles ainda são grandes o suficiente para acomodar corpos residuais que não cabem em lisossomos de mamíferos[25] ou serem vistos com facilidade.[2]
Lisossomos estão intimamente associados com um grupo de doenças geneticamente determinadas chamadas de doenças de depósito lisossômico. De forma geral, essas doenças se resumem em problemas metabólicos relacionados com o não-funcionamento ou mal funcionamento de alguma enzima. A doença de Pompe é um exemplo desse tipo de disfunção, sendo ela uma condição autossômica recessiva metabólica relacionada com o acúmulo de glicogênio em lisossomos devido à falta de alfa-glicosidase ácida.[26] Pacientes com Pompe têm perda progressiva de força muscular, que acaba evoluindo em problemas cardíacos e respiratórios podendo levar também à morte quando não tratada. De toda forma, as doenças de depósito lisossômico, por meio do acúmulo de alguma macromolécula específica em lisossomos ou endossomos,[27] o que acaba levando a transdução anormal de sinais, culminando em desordens patológicas. Os mais diversos tecidos podem ser afetados por esse tipo de doença, incluindo o cérebro.[28]
Apesar desse tipo de doença mais icônico que são relacionadas com lisossomos, e tendo em mente a sua atividade ser tão fundamental para a célula, há ainda um número de doenças complexas que têm sido apontados fatores de influência em sua patogênese relacionados com lisossomos, como o Mal de Alzheimer.[29]