Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Glutationa Alerta sobre risco à saúde | |
|---|---|
| |

| |
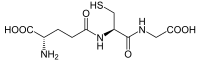
| Outros nomes | * 2-Amino-5-[1-(carboxymethylcarbamoyl)-2-mercapto- ethyl]amino-5-oxo-pentansäure * γ-L-Glutamyl-L-cysteinyl-glycin * GSH |
| Identificadores | |
| Número CAS | |
| PubChem | |
| MeSH | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C10H17N3O6S |
| Massa molar | 307.325 |
| Ponto de fusão |
185–195 °C [1] |
| Solubilidade em água | pouco solúvel em água (100 g/l a 20 °C), praticamente insolúvel em etanol [1] |
| Riscos associados | |
| LD50 | 5000 mg/kg (camundongo, oral)[2] |
| Compostos relacionados | |
| Aminoácidos relacionados | Ácido glutâmico Cisteína Glicina |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Glutationa, glutationo ou glutatião (γ-glutamilcisteinilglicina) é um tripeptídeo linear, com uma ligação 'Y-amida incomum, constituído por três aminoácidos: ácido glutâmico, cisteína e glicina, sendo o grupo tiol da cisteína o local ativo responsável pelas suas propriedades bioquímicas. É um antioxidante hidrossolúvel que está profusamente distribuída em tecidos animais, vegetais e em microrganismos, existe, na maioria das células, em concentrações compreendidas entre 1 e 8 mM, estando, geralmente, na sua maior quantidade no fígado. É o tiol mais prevalente e o mais abundante peptídeo de baixo peso molecular. Ao longo dos processos evolutivos foi adaptada para realizar uma gama diversa de funções, participando de vários processos metabólicos[3].
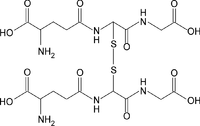
A Glutationa pode ser encontrada na forma reduzida (GSH) ou oxidada (GSSG, forma dimerizada da GSH). A razão GSH/GSSG é normalmente utilizada para estimar o estado redox dos sistemas biológicos, sendo extremamente importante. Em situações normais a GSSG representa apenas uma pequena fracção da glutationa total (menos de 10%).
Foi descrito pela primeira vez, em 1888 por Rey-Pailhade, como “philothion”, designando simplesmente algo que continha enxofre, posteriormente cristalizado por diversos investigadores, onde se verificou a presença relevante deste elemento, sendo assim designado de glutationa (L-gama-glutamil-L-cisteinilglicina)[4].
A glutationa está omnipresente na célula, onde:
A mitocôndria e o núcleo têm a sua própria reserva de GSH, de importância crucial na proteção destas estruturas contra a ação das espécies reativas de oxigênio.
A glutationa é sintetizada no fígado em dois passos, catalisados pela γ-glutamil-cisteina-sintetase (GCS) e pela glutationa-sintetase, usando o glutamato e a cisteína como substratos, formando o dipeptídeo γ-GluCys, o qual se combina com a glicina numa reação catalisada pela glutationa sintetase (GS) para a geração de GSH. A adenosina trifosfato (ATP) é co-substrato para ambas as enzimas. O nível intracelular de GSH é regulado por feedback, sendo a atividade da GCS inibida pelo seu produto final[10]. A GSH é distribuída, através da circulação sanguínea, para todos os tecidos.
A degradação da GSH e GSSG ocorre ao nível extracelular e, especialmente, ao nível renal, numa reação catalisada pela γ-glutamiltranspeptidase (GGT) e pela cisteinil-glicina-dipeptidase[11]. As etapas da degradação são: (1) Catabolismo extenso internamente nos espaços apicais, bem como no interior de compartimentos sinusoidais de algumas espécies; (2) Recaptação celular de alguns produtos de degradação; (3) Utilização intracelular destes produtos de degradação, ou conversão de conjugados de cisteína (Cys-SR) em ácido mercaptúrico. O catabolismo de conjugados de glutationa leva à formação de conjugados com a cisteína. Estes conjugados são transportados de novo para as células, onde podem funcionar como substrato para as N-acetiltransferases, com o intuito de gerar conjugados com a N-acetilcisteína (N-Acetil-Cys-SR), ou ácidos mercaptúricos. Estes ácidos são depois exportados a partir de células com a finalidade de eliminá-los através da urina ou fezes[12].
A ação antioxidante consiste na neutralização de radicais livres e redução do peróxido de hidrogênio. A glutationa é a primeira linha de defesa contra ROS, que o organismo humano concretiza a favor da sua homeostasia[13]. Na célula existem duas formas principais de defesa antioxidante: enzimática e não enzimática. A defesa enzimática compreende várias enzimas do ciclo redox da glutationa (glutationa redutase e glicose-6-fosfato-desidrogenase), sendo mais importante a GPx (Glutationa peroxidase). Existem ainda outros sistemas enzimáticos na defesa antioxidante, que inserem no seu mecanismo a enzima superóxido dismutase (SOD) e a catalase. A primeira faz com que ocorra a dismutação do radical superóxido em peróxido de hidrogênio e oxigênio, já a segunda converte o peróxido de hidrogênio em água e oxigênio molecular. É através destes sistemas que muitas das reações prejudiciais são evitadas ou alteradas[14].
O metabolismo de xenobióticos manifesta-se em duas etapas: funcionalização (fase I), onde o componente a ser excretado sofre uma alteração química da molécula, que pode ser provocada por oxidação, redução ou hidrólise; conjunção (fase II), onde a molécula vai ser preparada para poder ser expulsa pelo organismo, para isso acopla-se a molécula que servirá como meio de transporte. A fase II só é funcional caso haja um grupo reativo adequado para a conjugação, esse grupo reativo necessário à fase II é adquirido com a primeira fase[15]. A conjugação dos xenobióticos com a glutationa, efetuando a destoxificação, é catalisada por uma família de GST (Glutationa-S-transferase). Estas enzimas estão presentes na maioria dos tecidos, embora em concentrações mais elevadas no fígado, intestino, rim, testículos, glândula supra-renal e pulmão, onde se localizam no citoplasma numa percentagem de 95%, e no retículo endoplasmático cerca de 5%[16].
A glutationa é uma molécula determinante em diversos processos celulares e como tal, qualquer alteração na sua homeostasia pode influenciar a etiologia e/ou progressão de diversas doenças humanas[17]. Diversos estudos descrevem o decréscimo dos níveis de glutationa com o aumento da idade de uma pessoa, estando assim implicado com o aparecimento de certas doenças associadas ao envelhecimento[18]. Os níveis de glutationa são um indicador muito sensível da funcionalidade e viabilidade celular[19].