Type a search term to find related articles by LIMS subject matter experts gathered from the most trusted and dynamic collaboration tools in the laboratory informatics industry.
| Diborane | ||
| ||
 | ||
| Structure du diborane | ||
| Identification | ||
|---|---|---|
| Nom UICPA | diborane(6) | |
| Synonymes |
boranylidyneborane |
|
| No CAS | ||
| No ECHA | 100.039.021 | |
| No CE | 242-940-6 | |
| No RTECS | HQ9275000 | |
| PubChem | 6328200 | |
| ChEBI | 33590 | |
| SMILES | ||
| InChI | ||
| Apparence | gaz comprime, incolore, d'odeur caractéristique[1]. | |
| Propriétés chimiques | ||
| Formule | B2H6 | |
| Masse molaire[2] | 27,67 ± 0,014 g/mol H 21,86 %, B 78,14 %, |
|
| Propriétés physiques | ||
| T° fusion | −165 °C[1] | |
| T° ébullition | −92 °C[1] | |
| Solubilité | dans l'eau : hydrolysé en dihydrogène et en acide borique[1] | |
| Masse volumique | 1,18 kg·m-3 à 15 °C | |
| T° d'auto-inflammation | 40 à 50 °C[1] | |
| Point d’éclair | 38 °C | |
| Limites d’explosivité dans l’air | 0,8–88 %vol[1] | |
| Point critique | 40,5 bar, 289,8 K [3] | |
| Thermochimie | ||
| ΔvapH° | 14,28 kJ·mol-1 (1 atm, −92,49 °C)[4] | |
| Précautions | ||
| SGH[5] | ||
| H220, H280, H330, P210, P260, P304, P315, P340, P377, P381, P403 et P405 |
||
| NFPA 704 | ||
| Transport[5] | ||
| Écotoxicologie | ||
| Seuil de l’odorat | bas : 1,8 ppm haut : 3,5 ppm[6] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| |
||
Le diborane est un composé chimique de formule B2H6. Cette molécule, constituée de bore et d'hydrogène, résulte de l'union de deux groupes borane BH3 liés par deux de leurs atomes d'hydrogène. Il ne doit pas être confondu avec le diborane(4), de formule B2H4, dans lequel les deux atomes de bore sont liés par une liaison covalente ; le diborane est parfois appelé diborane(6) pour le distinguer de ce composé.
À température ambiante, il s'agit d'un gaz incolore à l'odeur douceâtre qui s'enflamme facilement en présence d'humidité. Il forme avec l'air des mélanges hautement explosifs. C'est un composé clef du bore, aux applications variées. Sa formation est endothermique et l'enthalpie libre de formation est positive (36 kJ·mol-1). Le diborane tend donc à se décomposer en libérant de l'hydrogène H2, mais avec une cinétique assez lente.
Le diborane est un gaz incolore plus léger que l’air ; il se condense à −92,5 °C sous 101,3 kPa ; sa masse volumique est 421 g·m-3 et sa chaleur latente de vaporisation est 515,39 kJ·mol-1. Il se solidifie à −165 °C. À 15 °C, sa pression de vapeur saturante est de 3,94 MPa et le rapport entre les volumes de gaz et de liquide est égal à 362. Gazeux, il est très inflammable et peut provoquer spontanément de violentes explosions dans l’air. Son point critique se trouve à 16,6 °C et 4,053 MPa.
Le diborane se décompose lentement, même à température ambiante, en dihydrogène et en hydrures de bore supérieurs. Cette décomposition s’accélère avec l’accroissement de la température. Le diborane est sensible à l’humidité et s’hydrolyse instantanément en dihydrogène et en acide borique H3BO3 suivant la réaction exothermique :
Au contact du lithium et de l’aluminium, le diborane donne des hydrures qui peuvent s’enflammer spontanément. Il n’exerce pas d’action corrosive sur les métaux usuels mais attaque la plupart des caoutchoucs et des matières plastiques, hormis par exemple le polytétrafluoroéthylène [CF2-CF2]n et le polychlorotrifluoroéthylène [CClF-CF2]n.
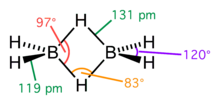
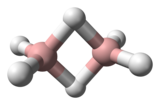
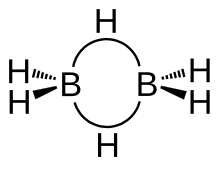
Le diborane présente une géométrie D2h avec deux atomes d'hydrogène liants et quatre atomes d'hydrogène terminaux. Les liaisons entre les atomes de bore et les hydrogènes terminaux sont conventionnelles (une paire d'électrons impliquée dans chaque liaison B-H, formant une liaison covalente), mais celles entre les atomes de bore et les hydrogènes liants sont d'une nature différente (une paire d'électrons impliquée dans chaque pont B-H-B, formant une liaison à trois centres et deux électrons). La longueur de ces liaisons est par conséquent différente : 119 pm pour les B-H terminaux, mais 133 pm pour les liaisons B-H des ponts B-H-B, ce qui signifie que la force de ces liaisons est également différente (plus faible dans le pont B-H-B que dans la liaison B-H terminale).
Le gallium forme un composé de structure semblable : le digallane Ga2H6.
Le diborane est un composé central de la chimie du bore et a donc été particulièrement étudié, de sorte que de nombreuses synthèses existent. La plupart des préparations mettent en œuvre des hydrures avec des halogénures ou des alcoolates. La production industrielle utilise le trifluorure de bore BF3 :
Deux préparations de laboratoire utilisent du trichlorure de bore BCl3 avec du tétrahydruroaluminate de lithium LiAlH4, ou du trifluorure de bore BF3 avec du borohydrure de sodium NaBH4 ; ces deux méthodes ont un rendement de 30 % en diborane :
L'oxydation de sels de borohydrures peut être utilisée pour préparer de petites quantités :
Le diborane est un réactif qui trouve un grand nombre d'applications. Les réactions dans lesquelles il intervient font souvent intervenir des bases de Lewis pour donner de nouvelles molécules. Il réagit avec l'ammoniac pour former du borazane BH3NH3 ou de la borazine B3N3H6 selon les conditions opératoires.
Il a été étudié comme ergol dans la propulsion des fusées (avec des oxydants fluorés tels que le fluor F2 et le difluorure d'oxygène OF2)[7], pour la vulcanisation des élastomères, comme catalyseur dans la polymérisation des monomères organiques, pour accroître la vitesse de flamme, comme dopant dans l'industrie des semi-conducteurs et comme réactif pour la production de silicium ultrapur destiné aux circuits électroniques.